
Лекции по ФХ 2 семестр / лекция 8 гетер катализ
.docxКИСЛОТНО—ОСНОВНОЙ ГОМОГЕННЫЙ КАТАЛИЗ
|
Общий |
Специфический |
|
Катализаторы — это любые основания и кислоты Бренстеда. |
Н+(Н3О+),ОН- |
Н2О + СН3СООН → СН3СОО- + Н3О+
осн-е к-та осн-е к-та
Н2О + NН3 → NН4+ + ОН-
к-та осн-е к-та осн-е
К=К0 + К1Ск-ты + К2Сосн + К3СН3О+ + К4СОН- (1)
К0 — константа скорости реакции без катализатора;
К1,К2,К3,К4 — каталитические константы.
1. Кислотный катализ.
А + Н3О+ → АН ⃰ + Н2О
АН ⃰ + В + Н2О → АВ + Н3О+
Пример. Гидролиз сложных эфиров в присутствии минеральных кислот.
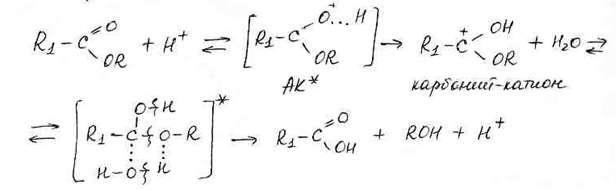
Исходя из уравнения (1), константа скорости данного процесса будет описываться уравнением:
К=К3СН3О+; lgK = lgK3 + lgСН3О+; т.к. lgСН3О+= - рН, то
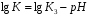
2. Основной катализ.
А + ОН- → А' + H2O
А' + H2O + В → АВ +ОН-
А' ≡ А без Н.
К= К4СОН-. Прологарифмируем данное выражение, получим
lgK = lgK4 + lgС ОН- ; Кw = CH+*COH-
lgK = lgK4 + lgКw - lgCH+
lgK = lgK4 + lgКw + pH
В итоге получаем: lgK = lgK' + pH
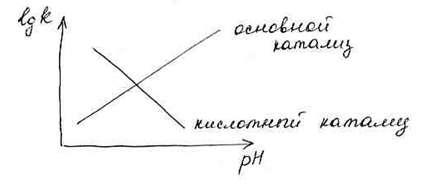
При специфическом кислотно-основном катализе логарифм константы скорости реакции линейно от величины рН раствора.
ГЕТЕРОГЕННЫЙ КАТАЛИЗ
Гетерогенный катализ позволяет интенсифицировать производственные процессы, использовать более доступные и дешёвые исходные материалы, получать новые вещества с нужными свойствами. В настоящее время гетерогенно — каталитические процессы используют в таких важнейших производствах, как получение серной кислоты, синтез аммиака, метанола, получение синтетического топлива, искусственного каучука, пластических масс и т.д.
Гетерогенный катализ протекает на границе раздела фаз, в газовой фазе на твёрдой поверхности.
Стадии гетерогенного катализа:
1 Подход (диффузия);
2 Адсорбция;
3 Процесс;
4 Десорбция;
5 Отвод продуктов (диффузия).
Для гетерогенного катализа очень важна стадия адсорбции- эта адсорбция называется активированной, между катализатором и реагирующими веществами образуются определённые связи.
ОСОБЕННОСТИ ГЕТЕРОГЕННОГО КАТАЛИЗА
1.Катализатор и реагирующие вещества должны обладать определенным сродством друг к другу:
а) Окислительно—восстановительные процессы (гидрирование, дегидрирование, окисление).
В эту группу входят различные металлы, которые различаются по каталитической активности.
Группа А: Ti, V, Cr, Mn, Zn, Nb, Mo, Hf, Ta, W. Они сильно хемосорбируют органические молекулы, N2 и СО. В чистом виде — плохие катализаторы.
Группа В: Fe, Co, Ni, Tc, Ru, Re — катализаторы реакции Фишера—Тропша (СО + Н2) и синтез аммиака.
Группа С: Сu, Rh, Pd, Os, Jr, Pt. Катализаторы скелетных реакций углеводородов и гидрогенизационных процессов.
Группа D: Ag, Au. Серебро—катализатор эпоксидирования этилена и окисления метанола в формальдегид. (Не катализирует реакции с разрывом связи С-С).
Сопутствующие вещества - оксиды металлов Al2O3, Cr2O3, Fe2O3, ZnO и др.
Примеры.
4NH3 + 5O2 = 4NO + 6H2O ( кат. Pt/Rh,Pd)
Промышленный способ получения азотной кислоты.
CO + 3H2 = CH4 + H2O (кат. Ni/Cr2O3,Al2O3).
Конверсия метана с водяным паром при получении водорода:
CH4 + H2O = CO + 3H2 (кат. Ni/Al2O3).
б) Кислотно—основное взаимодействия (гидратация, изомеризация, полимеризация).
Твердые кислые катализаторы:
-
нелетучие минеральные кислоты (Н3РО4,Н3ВО3);
-
натуральные минералы (бентонит, каолинит, монтмориллонит);
-
смешанные оксиды (Al2O3*SiO2, Al2O3*B2O3 и т.д.);
-
соли сильных кислот (AlCl3, CuSO4, NiSO4, TiCl4).
Пример: гидратация олефинов в присутствии Н3РО4.
С2Н4 + H2O → С2Н5ОН (кат. Н3РО4/ SiO2).
Твердые основные катализаторы:
неорганические основания м амиды (NaOH, KOH, KNH2);
неорганические соли и оксиды основного характера (ВаО, СаО, МgO, K2CO3, CaCO3 и т.д.).
К гетерогенным кислотно-основным катализатором относят иониты-сшитые полимеры с функциональными ионогенными группами.
Термически нестабильны.
Особое место занимают цеолиты—алюмосиликаты, содержащие оксиды щелочных и щелочноземельных металлов. Формула цеолитов:

Ме — катион металла (Na, K, Ca, Ba, Sr), n - его валентность. Цеолиты являются катализаторами крекинга и гидрокрекинга углеводородов и многих других кислотно-основных процессов (гидрирование бензола в циклогексан, окисление этилена, деалкилирование толуола).
Гидрокрекинг — одновременно крекинг, гидроочистка и изомеризация).
2. Состояние поверхности катализатора.
а) адсорбция происходит по активным центрам;
б) каталитическую активность увеличивают промоторы за счет увеличения поверхности, избирательности и срока действия. Различают структурообразующие и модифицирующие промоторы. Структурообразующие промоторы препятствуют увеличению размеров кристаллов катализатора, стабилизируя его активную фазу. Модифицирующие промоторы влияют на строение и химической состав активной фазы катализатора.
в) уменьшают активность катализаторов каталитические яды — вещества, которые даже в малых количествах необратимо сорбируются на поверхности катализатора и затрудняют к ней доступ реагирующих веществ.
Типичные яды: Н2S, CS2,тиофен, тиоспирты, НСN, CO, соединения фосфора, мышьяка и др. Каждый катализатор имеет свой набор ядов. Степень отравления катализатора.6
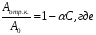
А отр.к. — активность отравленного катализатора,
А0 — активность катализатора до отравления,
α — коэффициент отравления,
С — концентрация яда.
г) Катализатор является наиболее активным в момент приготовления, когда он термодинамически неустойчив. "Старение" катализатора — это переход его в термодинамически устойчивое состояние (перекристаллизация в поверхностном слое, изменение структуры химического состава носителей и т.д.).
д) Катализаторы наносят на высокопористой материалы (миликагель, алюмогель, пены, уголь и т.д.).
Активность катализатора — это отношение скорости реакции (w) к массе или объему катализатора.
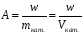
Удельная активность катализатора — это скорость, отнесенная к единице поверхности катализатора.
Так как активность связана с удельной поверхностью (м2/г) катализатора, то она возрастает прямо пропорционально поверхности, с его измельчением.
ТЕОРИЯ ГЕТЕРОГЕННОГО КАТАЛИЗА
Единой теории гетерогенного катализа пока не существует, вместо нее используют следующие:
-
мультиплетная теория Баландина;
-
теория активных ансамблей Кобозева;
-
электронная теория;
-
теория полупроводниковых катализаторов Волькенштейна;
-
теория Борескова.
МУЛЬТИПЛЕТНАЯ ТЕОРИЯ БАЛАНДИНА
Это теория основывается на двух соответствиях реагирующих веществ с катализатором:
1) структурное;
2) энергетическое.
Принцип структурного соответствия. Роль каталитически активного центра играют несколько атомов или ионов катализатора, расположенные на его поверхности в соответствии со степенью со строением кристаллической решетки. Они образуют так называемый мультиплет, который в зависимости от числа входящих в него частиц катализатора является дуплетом, триплетом и т.д. (Содержит соответственно две, три, и т.д. частиц). Отдельные атомы мультиплета являются центрами адсорбции, на которых адсорбируются индексные атомы реагирующих молекул. Индексные атомы реагирующего вещества, которые адсорбируются на одном активном центре, склонны к образованию связи, на разных активных центрах - к разрыву связи.
Принцип энергетического соответствия. Наибольшая активность катализатора достигается при определенных значениях энергии активированного мультиплетного комплекса, когда скорости его образования и распада близки друг к другу, т.е. энергия активации стадий образования комплекса и его распада должны быть приблизительно равны.

Обозначим:
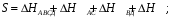
где
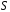 —
сумма энергий связей всех участников
реакций.
—
сумма энергий связей всех участников
реакций.
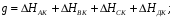
где
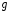 —
сумма энергий связей в комплексе.
—
сумма энергий связей в комплексе.
Считаем, что Е1=Е2, тогда Е1— Е2=0.
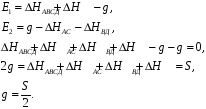
Сумма энергий связей в комплексе должна быть равна полусумме энергий связи всех участников реакций.
ТЕОРИЯ АКТИВНЫХ АНСАМБЛЕЙ
По этой теории каталитическая активность определяется совокупностью свободных атомов на поверхности катализатора, не входящих в кристаллическую решетку и способных к миграции. Поверхность катализатора состоит из большого числа областей миграции, разделенных между собой геометрическими и энергетическими барьерами. Каталитическим действием обладают только активные ансамбли, состоящие из определенного числа атомов внутри области миграции.
ЭЛЕКТРОННАЯ ТЕОРИЯ
Электронная теория объясняет каталитическую активность металлов и полупроводников наличием электронов проводимости, которые могут принимать участие в окислительно—восстановительных превращениях на поверхности катализатора. Переход электронов из валентной зоны в зону проводимости приводит к образованию дырок. Свободная валентность в виде электронов и дырок в состоянии перемещаться по поверхности, способствуя возникновению связи между адсорбированными молекулами реагирующих веществ и катализатором.
