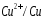- •Стандартные электродные потенциалы
- •Электродный процесс
- •Электродные измерение электродных потенциалов
- •Классификация электродов
- •Электроды I рода
- •Электроды II рода
- •Окислительно—восстановительные электроды (редокс—электроды)
- •Типы гальванических элементов
- •Химические элементы
- •Концентрационные элементы
- •Химические источники тока
- •Гальванические первичные элементы
- •Аккумуляторы
- •Топливные элементы
- •Применение потенциометрических методов
- •Определение рН растворов
- •Ионное произведение воды
- •Определения рН растворов водородным электродом
- •Определение рН растворов стеклянным электродом
- •Определение направление овр
- •Определение термодинамических характеристик химических реакций
Стандартные электродные потенциалы
Способ изменения или расчета абсолютных значений электродных скачков потенциала пока не найдено.Однако ЭДС цепи, состоящий из двух или большего числа электродов, доступна алгебраической сумме всех межфазных скачков потенциалов. В простейшем случае она равна разности двух электродных скачков потенциала, т.е. является мерой их относительных значений. Величина каждого из электродных скачков потенциала может быть принята за нулевую точку условной шкалы электродных потенциалов. Международным соглашением установлена шкала потенциалов, по которой скачок потенциала стандартного водородного электрода при всех температурах равна нулю.
Стандартный
водородный электрод состоит из
платинированной платины, находящейся
в контакте с раствором, активность ионов
водорода в котором
 (Н2SO4),
и омываемой потоком газообразного
водорода с давлением водорода
(Н2SO4),
и омываемой потоком газообразного
водорода с давлением водорода
 .
.
Электродный процесс


включает 3 стадии:
1.
Адсорбция молекулярного водорода на
платине
 ;
;
2.
Диссоциация адсорбированных молекул
на атоме, каталитически ускоряемую
платиной
 ;
;
3.
Ионизация атомарного водорода и переход
его в раствор

Третья стадия определяет возникновение электродного скачка потенциала и поэтому называется потенциалопределяющей. Таким образом, устанавливается равновесие между ионами водорода в растворе и газообразным водородом.
Водородный электрод записывается следующим образом:

Электродный
процесс:

Электродный потенциал водородного электрода запишется по уравнению Нернста:

Так
как парциальное давление водорода равно
единице =1,то
это выражение упрощается:
=1,то
это выражение упрощается:


 стандартный
потенциал водородного электрода при
активности ионов водорода
стандартный
потенциал водородного электрода при
активности ионов водорода
 =1,
в условиях, когда давление газообразного
водорода равно единице
=1,
в условиях, когда давление газообразного
водорода равно единице =1,
а температура равна 289К, принят за нуль
(
=1,
а температура равна 289К, принят за нуль
( =0).
=0).
Электродный
скачок потенциала в условной шкале
водородного электрода называется
электродным
потенциалом и
означается через
 .
Он равен ЭДС электрохимического элемента,
состоящего из стандартного водородного
и данного электродов. Запись такого
элементавсегда
начинается с водородного электрода,
т.е. он считается левым.
.
Он равен ЭДС электрохимического элемента,
состоящего из стандартного водородного
и данного электродов. Запись такого
элементавсегда
начинается с водородного электрода,
т.е. он считается левым.
Электродные измерение электродных потенциалов
Для определения электродных потенциалов собирают гальванический элемент, состоящий из электрода, потенциал которого нас интересует, и стандартного водородного электрода, а затем измеряют ЭДС данного элемента.
Стандартный водородный электрод, потенциал которого принят равным нулю и который всегда должен быть левым относительно другого электрода, записывается следующим образом:

Определим потенциал цинкового электрода. Цинковый электрод записывается в виде:

Потенциал этого электрода определяется электродвижущей силой элемента.




Опыт
показывает, что при работе элемента
цинк окисляется:
 Значит,
потенциалу цинкового электорода должен
быть приписан отрицательный знак.
Абсолютная величина цинкового электрода
равна:
Значит,
потенциалу цинкового электорода должен
быть приписан отрицательный знак.
Абсолютная величина цинкового электрода
равна:


Так как заряд цинка отрицательнее заряда платины, электроны будут переходить от цинка к платине, т.е. справа налево. В этом же направлении — и это характерно для отрицательного электрода, находящегося в паре со стандартным водородным электродом — будут переходить и катионы в соответствующих растворах элемента.
В отличие от цинкового электрода медный электрод имеет положительный потенциал, соответствующий положительной ЭДС элемента:




Здесь
в медном электроде самопроизвольно
идет восстановительная реакция:


ЭДС данного элемента будет равна потенциалу медного электрода.
При активностях ионов меди и цинка, равных единице, ЭДС соответствующих элементов определяют стандартные потенциалы медного и цинкового электродов.




 —стандартный
электродный потенциал цинкового
электрода.
—стандартный
электродный потенциал цинкового
электрода.
Стандартный электродные потенциалы образуют ряд, который применительно к системам металл — ионы металла в водном растворе соответствует расположению металлов по их химической активности, т.е. ряду напряжений:
|
Электрод |
|
|
|
|
|
|
|
-2,713 |
-0,763 |
0,00 |
0,337 |
0,799 |
Разность потенциалов двух электродов в водородной шкале ЭДС элемента, составленного из этих электродов, и включает два электродных скачка потенциала на границе металл—раствор электролита и скачок потенциала на границе металл—металл, если диффузионный потенциал раствор—раствор пренебрежимо мал.
Хотя водородный электрод при правильной работе дает очень точные результаты, воспроизводимые до 10-5 В, но работать с ним достаточно неудобно, т.к. он весьма чувствителен к чистоте используемого водорода и к состоянию поверхности платины. Поэтому в настоящее время при экспериментальном измерении потенциалов электродов используют электроды II рода: каломельные или хлорсеребряный. Эти электроды обладают постоянным значением потенциала, которые приводятся в таблицах, и их называют электродами сравнения.