
Лекции по ФХ 2 семестр / Лекция 6
.docФОТОХИМИЧЕКИЕ РЕАКЦИИ.
Фотохимическими называются реакции, протекающие под действием света, а также невидимых лучей, близких по длине волны к видимому свету.
В отличие от термических реакций, в которых энергия, необходимая для преодоления энергетического барьера, обеспечивается за счет кинетической энергии наиболее быстро движущихся молекул, в случае фотохимических реакций дополнительная энергия приносится излучением.
Механизмы фотохимических реакций разнообразны. Несмотря на это, во всех случаях можно выделить первичные процессы, непосредственно вызываемые действием света, и вторичные реакции, не требующие освещения для своего протекания и поэтому называемые темновыми.
Фотохимические реакции
/ \
первичные вторичные
(световые) (темновые)
Типы фотохимических реакций:
1. Фотодиссоциация:
а) распад на атомы или радикалы:
![]()
б) распад на ионы:
![]()
В общем случае это выглядит следующим образом:
![]() (фотоэффект)
(фотоэффект)
ионизация молекул или атомов с выделением электрона.
2. Фотоприсоединение:
а) димеризация
![]()
б) фотоокисление
![]()
3. Фотоизомеризация:
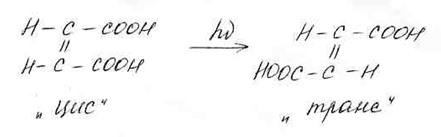
4. Фотосенсибилизация:
Этот эффект наблюдается в случае, когда активные частицы, появившиеся в результате облучения, отдают свою энергию молекуле другого вещества, а та затем вступает в химическую реакцию. Например, диссоциация молекулярного водорода в присутствии паров ртути.
![]() ;
;
![]()
5. Ассимиляция углерода растениями:
(поглощение
![]() )
)
![]()
6. Фотографические процессы:
![]()
ЗАКОНЫ ФОТОХИМИИ.
Закон Гротгуса-Дрепера. Химическое превращение осуществляется только теми квантами света, которые могут быть поглощены данным веществом.
Закон эквивалентности Эйнштейна. Каждый поглощенный квант света инициирует только одну молекулу.
![]()
Количественной характеристикой фотохимических реакций является квантовый выход.
![]() ,
,
где
![]()
![]() квантовый
выход;
квантовый
выход;
![]() количество
активных молекул;
количество
активных молекул;
![]() количество
квантов света, которые при этом
поглотились.
количество
квантов света, которые при этом
поглотились.
По закону эквивалентности квантовый выход для первичных реакций равен единице.
![]()
Например, реакция образования
![]() из смеси
из смеси
![]() и
и
![]() .
.
|
Отклонения от закона эквивалентности |
|
|
|
|
|
Протекание цепных реакций.
|
1) квант света поглощается другим веществом; 2) протекание побочных реакций; 3) протекание обратимых реакций. |
Отклонения от закона эквивалентности связаны с протеканием вторичных (темновых) процессов, а первичные процессы строго соответствуют закону эквивалентности.
КИНЕТИКА ФОТОХИМИЧЕСКИХ РЕАКЦИЙ.
Закон Бугера-Ламберта-Бера:
![]()
![]() интенсивность
падающего света;
интенсивность
падающего света;
![]() молярный
коэффициент поглощения;
молярный
коэффициент поглощения;
с – концентрация;
![]() длина
столба, через который проходит свет;
длина
столба, через который проходит свет;
![]() интенсивность
прошедшего света.
интенсивность
прошедшего света.
За протекающие фотохимические реакции ответственна разность:
![]()
основное уравнение фотохимических реакций
![]() скорость фотохимической реакции
скорость фотохимической реакции
![]() коэффициент
пропорциональности.
коэффициент
пропорциональности.
АНАЛИЗ УРАВНЕНИЯ.
1)
![]() ,
тогда величиной
,
тогда величиной
![]() можно пренебречь относительно 1. Поэтому
можно пренебречь относительно 1. Поэтому
![]() .
.
![]() ,
реакция протекает по нулевому порядку
(n=0).
,
реакция протекает по нулевому порядку
(n=0).
2)
![]() ,
тогда
,
тогда
![]() ,
а
,
а
![]() .
.
Поэтому
![]() (n=1).
(n=1).
Реакция протекает по уравнению первого порядка.
ЗАВИСИМОСТЬ СКОРОСТИ ФОТОХИМИЧЕСКИХ РЕАКЦИЙ ОТ ТЕМПЕРАТУРЫ.
Для обычных реакций
![]() .
.
Для фотохимических реакций
![]() ,
,
т. е. скорость фотохимических реакций практически не зависит от температуры. Это объясняется тем, что за счет поглощения света в первичных реакциях приобретается настолько большая энергия, что повышение температуры может изменить её незначительно.
Скорость фотохимической реакции
определяется интенсивностью падающего
света и длиной волны:
![]() ,
,
![]() .
.
Все фотохимические реакции делятся на два типа:
1) реакции, которые могут протекать
как на свету, так и в темноте (![]() )
– фотокаталитические реакции. В
этом случае свет играет роль источника
дополнительной энергии, необходимой
для преодоления энергетического барьера
и возбуждения реакции.
)
– фотокаталитические реакции. В
этом случае свет играет роль источника
дополнительной энергии, необходимой
для преодоления энергетического барьера
и возбуждения реакции.
![]()
2) реакции, которые в темноте
термодинамически неразрешимы (![]() ),
а при облучении светом происходит
изменение свободной энергии системы
(
),
а при облучении светом происходит
изменение свободной энергии системы
(![]() ),
и реакция становится термодинамически
возможной. В основном, это реакции
фотохимического разложения. В них
количество прореагировавшего вещества
пропорционально количеству поглощенного
света.
),
и реакция становится термодинамически
возможной. В основном, это реакции
фотохимического разложения. В них
количество прореагировавшего вещества
пропорционально количеству поглощенного
света.
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ.
Гетерогенными называются процессы, происходящие на поверхности раздела соприкасающихся фаз. Например, химические процессы: горение топлива, окисление металлов кислородом воздуха, реакции на поверхности катализаторов; физические процессы: растворение газов и твердых тел в жидкостях, кристаллизация чистых жидкостей и растворов и др.
Все гетерогенные процессы протекают в 5 стадий:
1) подвод вещества к поверхности раздела фаз;
2) адсорбция;
3) химический процесс;
4) десорбция;
5) отвод продуктов реакции.
1 и 5 стадии описываются законами диффузии, 3 стадия – законами кинетики, 2 и 4 стадии – законами адсорбции.
Скорость всего процесса определяется лимитирующей (самой медленной) стадией. По характеру лимитирующей стадии определяется область протекания реакции в целом. Если лимитирующими стадиями являются 1 и 5 стадии, то говорят, что процесс протекает в диффузионной области, если лимитирующая 3 стадия – то в кинетической области.
ДИФФУЗИЯ.
Диффузия – это процесс самопроизвольного выравнивания концентраций.
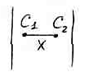
Движущей силой диффузии является
градиент концентрации
![]() .
.
1) Диффузия протекает в том случае,
если имеется градиент концентрации, т.
е.
![]() (условие протекания диффузии).
(условие протекания диффузии).
2) Диффузия идет в направлении от
области с большей концентрацией к
области с меньшей концентрацией:
![]() ;
;
![]() (направление процесса).
(направление процесса).
3) Пределом протекания процесса
диффузии является выравнивание
концентраций (![]() ).
).
По зависимости градиента концентрации от времени диффузия делится на 2 процесса:
1) стационарный
![]() ,
где
,
где
![]() время.
Подчиняется I закону Фика.
время.
Подчиняется I закону Фика.
2) нестационарный
![]() .
Подчиняется II закону
Фика.
.
Подчиняется II закону
Фика.
Стационарная диффузия описывается I законом Фика:
![]() ,
,
где
![]() коэффициент
диффузии;
коэффициент
диффузии;
![]() площадь
сечения, через которую проходит диффузия;
площадь
сечения, через которую проходит диффузия;
![]() градиент
концентрации;
градиент
концентрации;
![]() время;
время;
![]() масса
вещества, которая проходит через сечение
S за время
масса
вещества, которая проходит через сечение
S за время
![]() с градиентом концентрации
с градиентом концентрации
![]() .
.
Коэффициент диффузии зависит от
вязкости среды
![]() и температуры
и температуры
![]() :
:
![]() ,
,
где
![]() const
Больцмана;
const
Больцмана;
Т – температура, К;
![]() вязкость
среды.
вязкость
среды.
Повышение температуры в меньшей степени влияет на диффузионные процессы, чем на кинетические. Повышение температуры на 100С увеличивает коэффициент диффузии примерно на 20%.
![]()
Факторы, влияющие на коэффициент диффузии:
1. Температура: Т↑ D↑.
2. Вязкость:
![]() ↑
D↓.
↑
D↓.
3. Перемешивание: с увеличением скорости перемешивания диффузия будет увеличиваться.
4. Площадь: S↑ D↑, S↓ D↓.
Приведем I закон Фика к виду:
![]()
Условия стационарной диффузии:
![]() и
и
![]()
Нестационарная диффузия описывается II законом Фика:
![]() ;
;
![]()
![]()
ПРИМЕРЫ ПРОЦЕССОВ СТАЦИОНАРНОЙ ДИФФУЗИИ.
1. Растворение твердых тел в жидкостях.
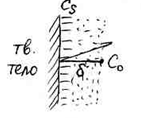
а) растворение труднорастворимого соединения.
![]() значения
концентраций при
значения
концентраций при
![]() и
и
![]() =0.
=0.
![]()
При стационарной диффузии концентрация изменяется вдоль направления диффузии линейно, а градиент концентрации может быть записан с помощью конечных величин:
![]() ;
;
![]() ;
;
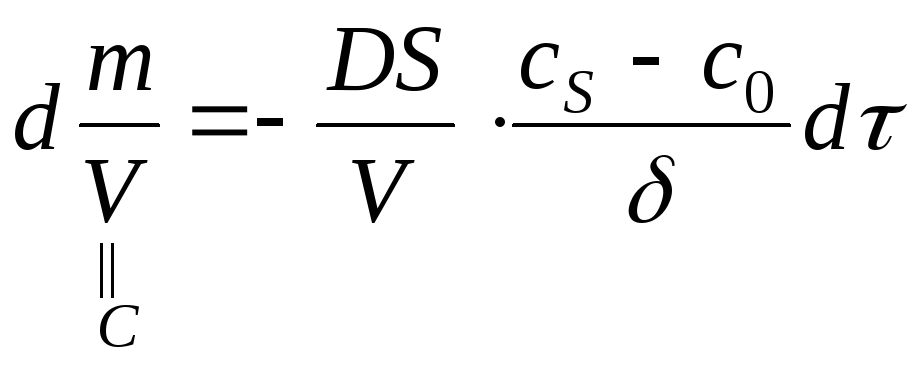 ;
;
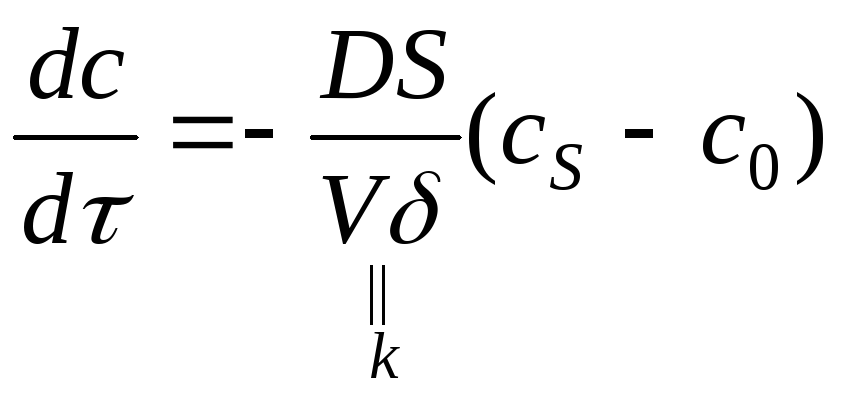 ;
;
![]()
![]() уравнение Щукарева,
n=1
уравнение Щукарева,
n=1
![]()
![]() это
максимально возможная концентрация
вещества при данной температуре и в
данном объеме.
это
максимально возможная концентрация
вещества при данной температуре и в
данном объеме.
![]()
б) растворение металлов в кислотах.
– подход
![]() к поверхности Ме (диффузия);
к поверхности Ме (диффузия);
– сольватация;
– разрушение кристаллической решетки;
– отвод сольватированного иона.
Процесс растворения идет намного
быстрее, чем подвод ионов
![]() к поверхности Ме, т. е. лимитирующей
стадией является стадия диффузии.
к поверхности Ме, т. е. лимитирующей
стадией является стадия диффузии.
![]() ,
,
где
![]() начальная
концентрация кислоты;
начальная
концентрация кислоты;
![]() концентрация
кислоты в момент времени
концентрация
кислоты в момент времени
![]() .
.
Скорость растворения металла в кислоте зависит только от концентрации кислоты.
2. Кристаллизация вещества из раствора.
![]()

![]()
3. Химическая реакция на границе раздела фаз.
Имеем два процесса: диффузию и кинетику.
![]()
В стационарной области
![]() или
или
![]()
![]() .
.
![]()
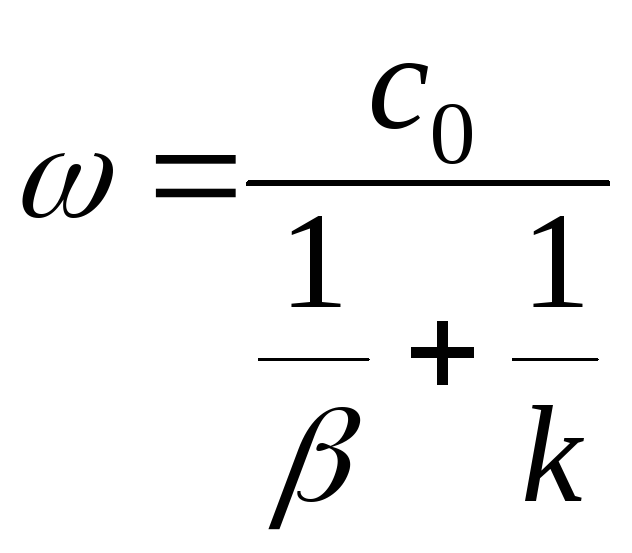 – уравнение скорости реакции,
протекающей на границе раздела фаз
– уравнение скорости реакции,
протекающей на границе раздела фаз
![]() кинетическое
сопротивление реакции;
кинетическое
сопротивление реакции;
![]() диффузионное
сопротивление реакции.
диффузионное
сопротивление реакции.
АНАЛИЗ УРАВНЕНИЯ.
1)
![]() ,
то величиной
,
то величиной
![]() можно пренебречь относительно
можно пренебречь относительно
![]() .
Тогда
.
Тогда
![]() процесс протекает в диффузионной
области
процесс протекает в диффузионной
области
2)
![]() ,
то
,
то
![]() пренебрегаем относительно
пренебрегаем относительно
![]() .
.
![]() процесс протекает в кинетической
области
процесс протекает в кинетической
области
ОПРЕДЕЛЕНИЕ ОБЛАСТИ ПРОТЕКАНИЯ ГЕТЕРОГЕННОГО ПРОЦЕССА.
1. Влияние температуры.
Процесс проводят при различных температурах и определяют температурный коэффициент:
если
![]() ,
процесс протекает в кинетической
области;
,
процесс протекает в кинетической
области;
если
![]() ,
процесс протекает в диффузионной
области.
,
процесс протекает в диффузионной
области.
Коэффициент диффузии подчиняется уравнению Аррениуса.
![]()
Однако, энергия активации диффузионного процесса намного меньше энергии активации кинетического процесса.
2. Влияние перемешивания.
Процесс проводится при различной интенсивности перемешивания. Если интенсивность перемешивания влияет на скорость процесса, то он протекает в диффузионной области, а если не влияет, то в кинетической.
