
- •Неравновесная электрохимия. Электролиз
- •Кинетика электродных процессов. Поляризация и перенапряжение
- •Последовательность электродных процессов
- •Применение электролиза
- •Коррозия и защита металлов
- •Термодинамика химической коррозии
- •Кинетика химической коррозии
- •Электрическая коррозия. Механизм
- •Термодинамика электрохимической коррозии
- •Защита металлов от коррозии
Неравновесная электрохимия. Электролиз
Электролиз — это процесс, в котором химические реакции происходят под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов электролита. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока.
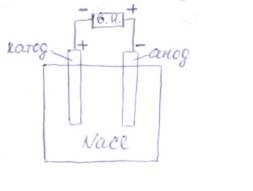
Рассмотрим электродные реакции на примере электролиза расплава NaCl. При плавлении происходит термохимическая диссоциация соли:
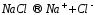
Если погрузить в расплавленную соль два графитовых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
а)
восстановление ионов
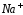 до металлического
до металлического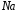 (катодный процесс) на отрицательном
электроде, т.е. электроде, на которой
поступает элементы от внешнего источника
тока:
(катодный процесс) на отрицательном
электроде, т.е. электроде, на которой
поступает элементы от внешнего источника
тока:
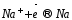 ;
;
б)
окисление хлорид-ионов
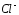 до
до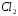 (анодный
процесс) на положительном электроде, с
которого электроны идут во внешнее
цепь:
(анодный
процесс) на положительном электроде, с
которого электроны идут во внешнее
цепь:
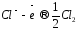 .
.
Суммарная
реакция
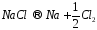 .
.
Электролиз подчиняется законом Фарадея:
Первый закон: 1)количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
Второй закон: 2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
При превращении одного моля эквивалентов вещества на электроде через него проходит ≈96500 Кл(А*с). Эта величина называется постоянная Фарадея (F).
На законах Фарадея основаны расчеты электрохимических установок, а на их базе созданы счетчики количества электричества (кулонометры, интеграторы тока) и другие устройства.
Электролиз подчиняется уравнениям кинетики электродных процессов.
Кинетика электродных процессов. Поляризация и перенапряжение
Равновесные потенциалы электродов могут быть определены в условиях отсутствия в цепи тока. При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциала электрода при прохождении тока называется поляризацией:
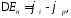
где
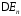 —
поляризация;
—
поляризация;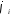 — потенциал электрода при прохождении
тока;
— потенциал электрода при прохождении
тока;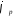 —
равновесный потенциал.
—
равновесный потенциал.
Также
различают анодную и катодную поляризацию
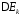 и
и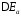 .
Изменение потенциала при прохождении
тока также называется перенапряжением.
Этот термин обычно употребляют, когда
известна причина изменения потенциала.
Это также относится к некоторым конкретным
процессом, например, к катодному выделению
водорода (водородное перенапряжение).
.
Изменение потенциала при прохождении
тока также называется перенапряжением.
Этот термин обычно употребляют, когда
известна причина изменения потенциала.
Это также относится к некоторым конкретным
процессом, например, к катодному выделению
водорода (водородное перенапряжение).
Для экспериментального определения поляризации строят кривые зависимости потенциала электрода от протекающего через электрод тока. Так как ток пропорционален количеству вещества, прореагировавшего на электроде в единицу времени, то значение тока может быть использована для количественной оценки скорости электрохимической реакции. Так как электроды могут быть разными по площади, то в зависимости от площади электрода при одном и том же потенциала могут быть разные токи. Поэтому скорость реакции обычно относят к единице площади поверхности. Отношение тока J к площади электрода называют плотностью тока i:
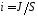
Любая электрохимическая реакция протекает минимум в 3 стадии:
а) подвод реагентов к электроду;
б) собственно электрохимическая реакция, которая может включать в себя и химические реакция;
в) отвод продуктов реакции от электрода.
Если бы все стадии протекали мгновенно, то потенциал электрода при прохождении тока не изменялся бы, следовательно поляризация была бы равна нулю. Однако все 3 стадии протекают с конечными скоростями; причем одна из них лимитирует всю реакцию и для ускорения необходимо изменение потенциала электрода, т.е. поляризация. Следовательно, возникновение поляризации обусловлено замедленностью отдельных стадий электрохимического процесса. Соответственно в зависимости от характера замедленной стадии на электроде возникает или концентрированная, или электрохимическая поляризация.
Концентрационная
поляризация. Изменение
потенциала электрода вследствие
изменения концентрации реагентов в
приэлектродном слое при прохождении
тока называется концентрационной
поляризацией. Так как по уравнению
Нернста потенциал электрода пропорционален
логарифму активности ионов (в разбавленных
растворах —
концентрации
ионов), то концентрационная поляризация
должна быть пропорциональна разности
логарифмов активностей ионов в
приэлектродном слое
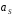 и в объеме раствора
и в объеме раствора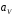 :
:
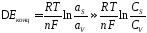
С увеличением плотности тока растет разность между активностями в приэлектродном слое и объеме раствора и возникает концентрационная поляризация:
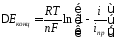
 ,
,
где
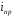 —
предельная
плотности тока:
—
предельная
плотности тока:
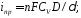
где
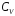 —
концентрация
реагента в объеме раствора,
—
концентрация
реагента в объеме раствора,
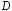 —
коэффициент
диффузии реагентов;
—
коэффициент
диффузии реагентов;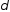 — толщина диффузионного слоя.
— толщина диффузионного слоя.
Как
видно из уравнения, концентрационная
поляризация
 снижается
с увеличением коэффициента диффузии и
концентрации реагента и уменьшаем
толщины диффузионного слоя. Диффузионным
слоем называется тонкий слой около
поверхности электрода, в котором не
происходит перемешивания жидкости и
молекулы переносятся лишь путем диффузии.
Концентрационная поляризация уменьшается
при перемешивании раствора.
снижается
с увеличением коэффициента диффузии и
концентрации реагента и уменьшаем
толщины диффузионного слоя. Диффузионным
слоем называется тонкий слой около
поверхности электрода, в котором не
происходит перемешивания жидкости и
молекулы переносятся лишь путем диффузии.
Концентрационная поляризация уменьшается
при перемешивании раствора.
Электрическая поляризация (перенапряжение). Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией (перенапряжением). Замедленность электрохимических стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Скорость электрохимических реакций может быть увеличена повышением температуры и применением катализатора. При повышении температуры растет доля активных молекул, в случае применения катализатора снижается энергия активации. Энергия активации электрохимической реакции может быть также снижена при изменении потенциала электрода по сравнению с его равновесным потенциалом, т.е. при поляризации.
Так
как при уменьшении энергии активации
растет скорость реакции, то увеличена
поляризации, т.е. к повышению плотности
тока. Чем больше энергия активации
процесса, т.е. чем медленнее процесс
протекает в прямом и обратном направлениях
при равновесии, тем большая поляризация
требуется для обеспечения определенной
скорости электрохимического процесса,
выражаемой через плотность тока. Связь
между электрохимическим перенапряжением
 и
плотностью тока выражаетсяуравнением
Тафеля,
которое вначале было получено империческим
путем, а затем выведено теоретически:
и
плотностью тока выражаетсяуравнением
Тафеля,
которое вначале было получено империческим
путем, а затем выведено теоретически:
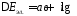
Константа
в зависимости от природы реакции и
температуры (при Т=298К в≈0,03-0,15). Константа
 зависит от природы реакции, материала
электрода, состава раствора и температуры.
При
зависит от природы реакции, материала
электрода, состава раствора и температуры.
При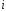 =1,
=1, .
Константы
.
Константы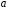 и
и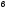 определяют графически из зависимости
поляризации от логарифма плотности
тока. Константа
определяют графически из зависимости
поляризации от логарифма плотности
тока. Константа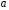 находим из графика при значении
находим из графика при значении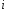 =1
или
=1
или =0.
=0.
А
тангенс угла наклона прямой равен
константе в:
 .
.

Таким образом, в зависимости от типа замедленной стадии поляризации может быть снижена перемешиваниям раствора, применением катализаторов ( например, электроды из Pt, Pd или Me группы Fe), увеличением температуры, концентрации реагентов и площади поверхности электродов.
