
Растворы электролитов
Электролит– это вещество, которое при определенных условиях способно распадаться на заряженные частицы, называемые ионами.
Под определенными условиями может
подразумеваться раствор, расплав, распад
на ионы под действием температуры
(термодиссоциация CaCO3CaO+CO2), в плазме и
фотодиссоциация – разложение веществ
под действием ионизирующего излучения
(Cl2![]() 2Cl).
2Cl).
Раствор электролита– это раствор, который способен проводить электрический ток.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
|
Сильные Электролиты, которые полностью диссоциируют в растворе АВА++ В- |
Слабые Электролиты, которые не диссоциируют полностью АВА++ В- |
|
1) соли (NaCl, KCl, MgSO4, CH3COONa) |
1) соли (Hg2Cl2) |
|
2) щелочи (NaOH, KOH, Ca(OH)2) |
2) основания(NH3) |
|
3) кислоты (HNO3, H2SO4, HCl, HClO4) |
3) кислоты (H2CO3, H3BO3, CH3COOH, C6H5COOH) |
|
|
4) органические соединения (C6H4(OH)2(гидрохинон),C6H5NH2(анилин)) |
Диссоциация электролитов наблюдается в полярных растворителях и зависит от их диэлектрической проницаемости . Чем выше значение диэлектрической проницаемости, тем полнее диссоциация.
Большая диэлектрическая проницаемость наблюдается для воды (при 25 0С=78,3). Лишь незначительное количество неводных растворов, например, формамид, имеют диэлектрическую проницаемость выше, чем у воды. Растворы электролитов в подобных растворителях обладают высокой электрической проводимостью.
В неполярных растворителях, таких как четыреххлористый углерод (=2,238), электролитической диссоциации практически не происходит.
В зависимости от числа образующихся в результате электролитической диссоциации катионов и анионов различают симметричные и несимметричные электролиты.
ЭЛЕКТРОЛИТЫ
|
Симметричные число катионов = числу анионов |
Несимметричные число катионов числу анионов |
|
1) NaCl,KBr,HCl 1,1 – зарядные (одно-одно-зарядные) |
1) K2SO4, H2SO4 1,2 - зарядные |
|
2) MgSO4,ZnSO4 2,2 - зарядные (двух-двух-зарядные) |
2) MgCl2, CaBr2 2,1 - зарядные |
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ.
СТЕПЕНЬ И КОНСТАНТА ДИССОЦИАЦИИ
Первая количественная теория растворов электролитов (теория электролитической диссоциации) была высказана Аррениусом. По этой теории молекулы электролитов при растворении распадаются на противоположно заряженные ионы. Процесс диссоциации слабого электролита обратим, т.е. наряду с диссоциацией молекул происходит образование молекул из ионов и, таким образом, в растворе наряду с ионами существуют и молекулы.
Доля молекул, распадающихся на ионы, оценивается степенью электролитической диссоциации, которую обычно обозначают.Степень диссоциации– это отношение числа молекул, распавшихся на ионы, к числу молекул растворенного вещества.
![]()
Степень диссоциации является характеристикой электролита:
Для неэлектролитов (сахароза) = 0;
Для сильных электролитов ≥ 1;
Для слабых электролитов 0 < < 1.
Рассмотрим диссоциацию уксусной кислоты:
СН3СООН![]() Н++ СН3СОО-
Н++ СН3СОО-
Так как процесс диссоциации слабого электролита обратим, то он характеризуется константой равновесия. Константа равновесия для процесса диссоциации есть константа диссоциации. Т.е. все закономерности, характерные для константы равновесия, справедливы и для константы диссоциации.
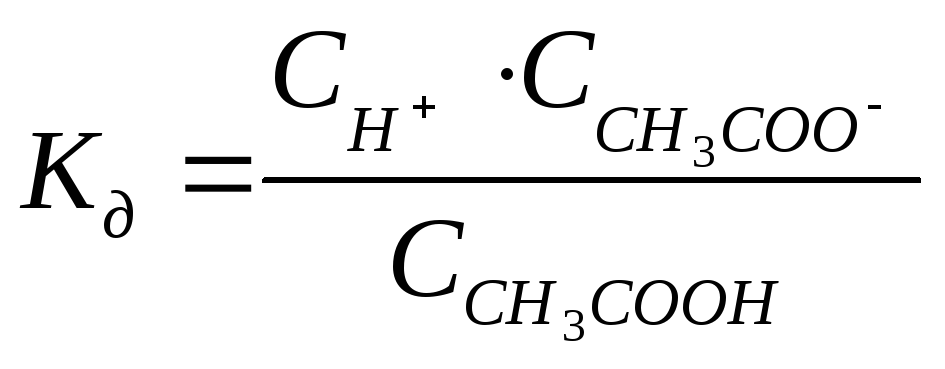 .
.
Константа диссоциации зависит от природы
растворителя и температуры (![]() =f(Т)),
но не зависит от концентрации электролита
в растворе (
=f(Т)),
но не зависит от концентрации электролита
в растворе (![]() f(С)).
f(С)).
Зависимость константы диссоциации от
температуры описывается уравнением
изобары Вант-Гоффа:
![]() .
.
Пусть концентрация растворенной уксусной
кислоты будет С, а степень диссоциации
равна . Тогда![]() ,
,![]()
![]() ;
;![]() ;
;![]() .
.
Подставим эти значения в выражение константы диссоциации:
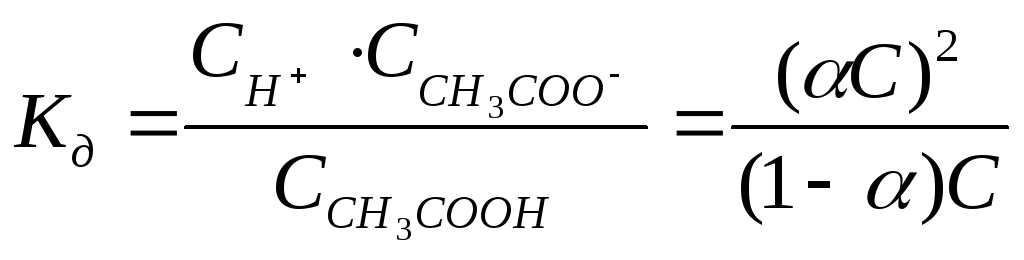 ;
;![]()
![]() - аналитическое выражение закона
разбавления Оствальда, где С – общая
концентрация электролита [моль/дм3].
- аналитическое выражение закона
разбавления Оствальда, где С – общая
концентрация электролита [моль/дм3].
Рассмотрим очень слабый электролит,
степень диссоциации которого намного
меньше единицы (<<1).
Тогда закон разбавления Оствальда
преобразуется:![]() .
.
Как видно, степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита. Чем больше концентрации, тем меньше степень диссоциации. В связи с этим вводится понятие бесконечно разбавленного раствора, в котором даже слабые электролиты полностью диссоциируют на ионы и отсутствуют силы электростатического взаимодействия.
ПРИЧИНЫ И МЕХАНИЗМ ИОНИЗАЦИИ
В ВОДНЫХ РАСТВОРАХ
