
Расчет кривой титрования сильной кислоты щелочью
Пример.
Титруют 100,00 см3
раствора HCl
с молярной концентрацией 0,1 моль/дм3
(![]() )
раствором NaOH
с молярной концентрацией 0,1 моль/дм3
(
)
раствором NaOH
с молярной концентрацией 0,1 моль/дм3
(![]() ).
Рассчитайте и постройте кривую титрования
с учетом разбавления раствора. Определите
величину скачка ∆рН вблизи Т.Э. для
уровня ошибок η = ± 1% и η = ± 0,1%. Подберите
индикатор для фиксирования конечной
точки титрования (КТТ).
).
Рассчитайте и постройте кривую титрования
с учетом разбавления раствора. Определите
величину скачка ∆рН вблизи Т.Э. для
уровня ошибок η = ± 1% и η = ± 0,1%. Подберите
индикатор для фиксирования конечной
точки титрования (КТТ).
Решение. Расчет кривой титрования ведем с учетом разбавления раствора в процессе титрования
г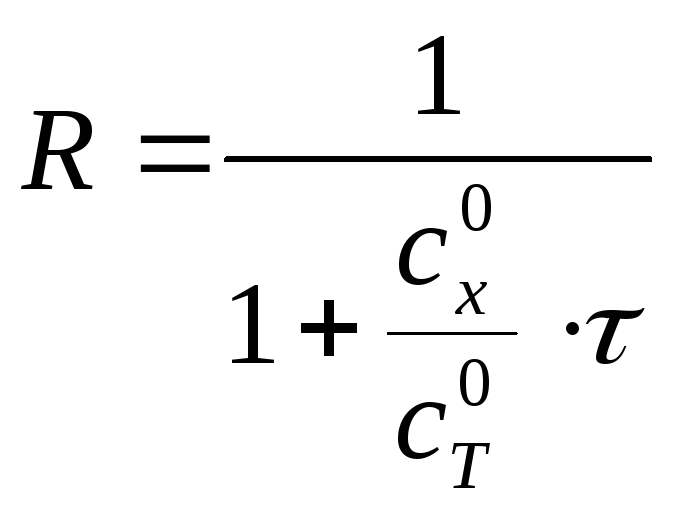 де
R
– степень разбавления раствора;
де
R
– степень разбавления раствора;
![]() – концентрация титруемой кислоты,
моль/дм3;
– концентрация титруемой кислоты,
моль/дм3;
![]() – концентрация титранта, моль/дм3;
τ – степень оттитровывания раствора.
– концентрация титранта, моль/дм3;
τ – степень оттитровывания раствора.
Так
как
![]() ,
то
,
то
![]() .
.
В процессе титрования протекает реакция HCl + NaOH =NaCl + H2O
Рассчитаем рН титруемого раствора, соответствующий основным моментам титрования:
а) До начала титрования τ = 0
В растворе только соляная кислота с концентрацией 0,1 моль/дм3
HCl↔H+ + Cl-
[H+] = [HCl] = 0,1моль/дм3, рН = -lg0,1 = 1
б) До Т.Э. при 0 < τ < 1. Концентрацию [H+] рассчитывают по формуле:
![]() рН=-lg[H+]
рН=-lg[H+]
τ
= 0,1 ![]() =
8,2 · 10-2
моль/дм3
рН = 1,09
=
8,2 · 10-2
моль/дм3
рН = 1,09
τ
= 0,5 ![]() =0,0333
моль/дм3
рН = 1,48
=0,0333
моль/дм3
рН = 1,48
τ
= 0,9 ![]() = 5,3 · 10-3
моль/дм3 рН
= 2,28
= 5,3 · 10-3
моль/дм3 рН
= 2,28
τ
= 0,99 ![]() =
5,0 · 10-4
моль/дм3 рН
= 3,30
=
5,0 · 10-4
моль/дм3 рН
= 3,30
τ
= 0,999 ![]() =
5,0 · 10-5
моль/дм3 рН
= 4,30
=
5,0 · 10-5
моль/дм3 рН
= 4,30
в) В Т.Э. при τ = 1в растворе только продукт реакции NaCl, соль, не вступающая в реакцию гидролиза
[H+] = [ОH-] = 10-7, рН=7
г) После Т.Э. τ > 1. Раствор содержит избыток ионов ОH-, концентрацию которых рассчитываем по уравнению:
![]() рН=14+lg[OH-]
рН=14+lg[OH-]
τ
= 1,001 ![]() = 5,0 · 10-5
моль/дм3 рН
= 9,7
= 5,0 · 10-5
моль/дм3 рН
= 9,7
τ
= 1,01 ![]() =
5,0 · 10-4
моль/дм3 рН
= 10,7
=
5,0 · 10-4
моль/дм3 рН
= 10,7
τ
= 1,1 ![]() =
4,8 · 10-3
моль/дм3 рН
= 11,7
=
4,8 · 10-3
моль/дм3 рН
= 11,7
τ
= 1,5 ![]() =
0,02 моль/дм3 рН
= 12,3
=
0,02 моль/дм3 рН
= 12,3
По полученным значениям строим кривую титрования:
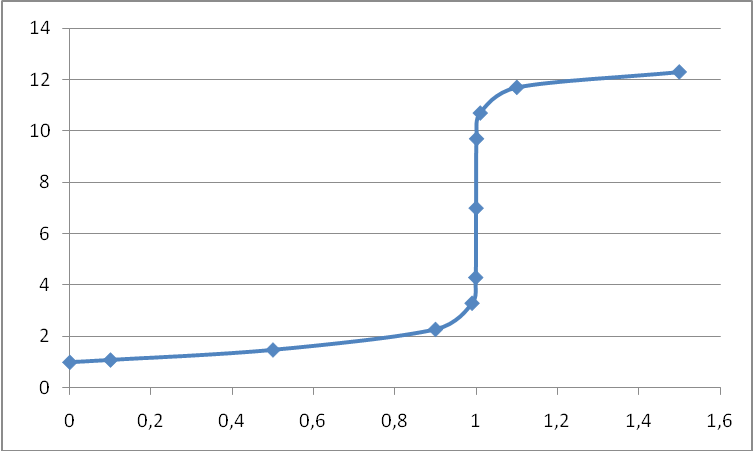
Скачок титрования ∆рН для ошибки титрования η = ± 0,1%:
![]()
Скачок титрования ∆рН для ошибки титрования η = ± 1%:
![]()
В данном случае для фиксирования КТТ можно использовать все три индикатора. Но наименьшая индикаторная ошибка титрования будет, в случае использования метилового красного (рТ = 5).
Окислительно-восстановительное титрование
К окислительно-восстановительным относятся химические процессы, которые сопровождаются изменением степени окисления атомов веществ, участвующих в реакции.
Вещества, атомы которых в ходе реакции понижают степень окисления благодаря присоединению электронов, называются окислителями, т.е. они являются акцепторами электронов. При этом окислители сами восстанавливаются. Восстановители, являясь донорами электронов, окисляются.
Продукт восстановления окислителя называются восстановленной формой, а продукт окисления восстановителя – его окисленной формой. Окислитель со своей восстановленной формой составляет полупару окислительно-восстановительной системы, а другой полупарой является восстановитель со своей окисленной формой. Таким образом, восстановитель с окисленной формой и окислитель со своей восстановленной формой составляют две полупары (редокс пары) окислительно-восстановительной системы.
Все ОВ процессы (редокс реакции) можно разделить на три типа
а) межмолекулярные, когда в ходе реакции ОВ переход электронов происходит между частицами различных веществ. Например
![]()
В данной реакции
роль окислителя в присутствии Н3О+
играют ионы
![]() а в качестве восстановителя выступают
ионы
а в качестве восстановителя выступают
ионы
![]()
б) дисмутационные
(диспропорционирования), в ходе которых
переход электронов происходит между
частицами одного и того же вещества. В
результате диспропорционирования
степень окисления одной части атомов
понижается за счет другой части таких
же атомов, степень окисления которых
становится больше. Например:
![]()
в) внутримолекулярные,
в которых переход электронов происходит
между двумя атомами, входящими в состав
одной и той же частицы вещества, приводящие
к разложению вещества на более простые.
Например:![]()
Оценка окислительно-восстановительной способности вещества.
Для выяснения возможности протекания ОВ реакции нужно знать ОВ потенциалы вступающих в реакцию веществ.
Количественно зависимость редокс-потенциала от концентрации окисленной и восстановленной форм выражают уравнением Нернста–Петерса:
![]()
где R –газовая постоянная, равна 8,314 Дж/моль·К;
Т – абсолютная температура раствора;
n- число отдаваемых или приобретаемых электронов;
F- число Фарадея, равное 96484,56 Кл·моль (количество электричества, соответствующее переносу 1 моль электронов);
[окисл] – концентрация окисленной формы; [восст] – концентрация восстановленной формы;
Ео - обозначает нормальный стандартный окислительно-восстановительный потенциал системы.
Самопроизвольное протекание окислительно-восстановительной реакции при стандартных условиях возможно, если Ео (окислителя) Ео (восстановителя).
При 25о формула Нернста-Петерса принимает вид
![]()
Окислительно-восстановительные реакции в титриметрии
ОВР, основой которых является обмен электронами, протекают между двумя редокс-парами.
Условно ОВ реакции относятся к 3-му типу и в общем виде они записываются:
![]()
При рассмотрении вопроса о возможности их использования в титриметрии необходимо дать ответ на следующие вопросы:
-
протекают ли реакция между данным окислителем и восстановителем?
Ответ на этот вопрос дается путем сравнения табличных значений нормальных редокс-потенциалов окислителя и восстановителя;
2) имеется ли скачок на кривой титрования, т.е. Е0 0, где Е0 = Е0ок - Е0восс
Титрование по методу окисления – восстановления возможно если Е0 0,4 В.Только в этом случае обеспечивается необходимая полнота и скорость реакции.
Титрантами в ОВ титровании служат растворы окислителя и восстановителя. Если раствор восстановителя титруется стандартным раствором окислителя то метод называют «оксидиметрия», если же раствор окислителя титруется стандартным раствором восстановителя то метод называют «редуктометрия»
Методы ОВ титрования называют по типу применяемого титранта. Наиболее широкое применение нашли следующие виды ОВ титрования: перманганатометрия – титрант KMnO4, йодометрическое - титранты растворы йода (J2) и тиосульфата натрия (Na2S2O3), броматометрическое (титрант КBrO3), бромометрическое (титрант Br2 (КBrO3 + KBr), дихроматометрическое (K2Cr2O7), церийметрическое - Се(SO4)2 и др.
Способы установления Т.Э.
Для определения точки эквивалентности при окислительно-восстановительном титровании используют:
а) безиндикаторные методы. В случае когда раствор титруемого вещества или титранта имеют окраску, ТЭ можно определить по исчезновению или появлению этой окраски, соответственно;
б) специфические индикаторы – изменяющие цвет при появлении титранта или исчезновении определяемого вещества. Например для системы J2/2J-, специфическим индикатором является крахмал, окрашивающий растворы содержащие J2 в синий цвет;
в) ОВ (редокс-) индикаторы – изменяющие цвет при изменении ОВ потенциала системы (одноцветные индикаторы – дифениламин, двухцветные – ферроин).
Кривые ОВ титрования
Кривые ОВ титрования ОВ изображают изменение ОВ потенциала системы по мере приливания раствора титранта.
Редуктометрия, когда раствор окислителя титруется стандартным раствором восстановителя
![]()
В редуктометрии кривые титрования рассчитывают:
1)
![]()
![]()
2)
![]()
![]()
3)
![]()
![]()
Оксидиметрия, когда раствор восстановителя титруется стандартным раствором окислителя
![]()
В оксидиметрии кривые титрования рассчитывают:
1)
![]()
![]()
2)
![]()
![]()
3)
![]()
![]()

