
- •Глава 1. «Строение материалов»
- •Раздел 1. Строение металлов
- •1.1. Атомно-кристаллическое строение
- •1.2. Дефекты строения кристаллических тел
- •1.3. Кристаллизация металлов
- •1.4. Формирование структуры деформированных металлов
- •Раздел 2. Строение сплавов
- •2.1. Фазы и структура металлических сплавов
- •2.2. Диаграммы состояния (фазового равновесия сплавов)
- •2.3. Диаграмма состояния системы железо – углерод
- •Раздел 3. Строение полимеров
- •3.1. Молекулярная структура полимеров
- •Глава 2. Модуль 2. «Свойства материалов и методы их определения»
- •Раздел 1. Свойства материалов
- •Критерии выбора материала
- •1.2. Механические свойства
- •1.3. Испытания долговечности
- •1.4. Изнашивание металлов
- •1.5. Физико-химические свойства материалов
- •Раздел 2. Методы контроля структуры и свойств материалов
- •2.1. Металлографические методы испытаний
- •2.2. Неразрушающие методы контроля
- •Глава 3. Модуль 3. «Термическая обработка»
- •Раздел 1. Основы теории термической обработки
- •Общие положения и определения
- •Классификация видов термической обработки стали
- •Теория термической обработки
- •Раздел 2. Технология термической обработки
- •2.1. Отжиг
- •2.2. Нормализация
- •2.3. Закалка
- •2.4. Отпуск
- •2.5. Термомеханическая обработка стали
- •Раздел 3. Поверхностное упрочнение металлов и сплавов
- •3.1. Упрочнение поверхности методом пластического деформирования
- •3.2. Поверхностная закалка
- •3.3. Химико-термическая обработка
- •3.4. Циркуляционный метод химико-термической обработки
- •Глава 4. Модуль 4. «Материалы, применяемые в технике»
- •Раздел 1. Промышленные стали и сплавы
- •Общая классификация и маркировка сталей
- •1.2. Маркировка сталей по евронормам
- •1.3. Инструментальные стали и сплавы
- •1.4. Коррозионностойкие стали
- •1.5. Жаростойкие и жаропрочные стали
- •1.6. Хладостойкие стали
- •1.7. Порошковые материалы
- •1.8. Чугуны
- •Раздел 2. Цветные металлы и сплавы
- •2.1. Медь и ее сплавы
- •2.2. Алюминий и его сплавы
- •2.3. Титан и его сплавы
- •2.4. Никель и его сплавы
- •Раздел 3. Неметаллические материалы
- •3.1. Пластические массы
- •3.2. Резины
- •Раздел 4. Композиционные материалы
- •4.1. Общая характеристика
- •Раздел 5. Материалы с особыми физическими свойствами
- •5.1. Магнитные материалы
- •5.2. Проводниковые материалы
- •5.3. Сплавы с особыми тепловыми и упругими свойствами
- •Приложение
- •Продолжение табл. 4
- •Продолжение табл. 4
- •Продолжение табл. 5
- •Продолжение табл. 5
- •Продолжение табл. 5
- •Перечень госТов на стали и сплавы
- •1. Сталь
- •2. Чугун
- •Глава 1. Модуль 1. «Строение материалов»……………….……13
Глава 1. «Строение материалов»
Раздел 1. Строение металлов
1.1. Атомно-кристаллическое строение
Металлы являются телами кристаллическими. Это означает, что атомы в занимаемом ими пространстве расположены строго упорядоченно, находясь в определенных местах на вполне определенных расстояниях друг от друга.
При этом атомы не перемещаются друг относительно друга, т. е. они имеют постоянных соседей. Находясь на своих местах, атомы вследствие термокинетического эффекта совершают колебания частотой 1013 Гц с изменяющейся в зависимости от температуры амплитудой. В ряде случаев под влиянием локальных тепловых процессов атомы кристаллических тел все же могут перемещаться между соседями в другие положения. Такие перемещения составляют суть явления, называемого диффузией. Диффузия однородных атомов между соседями называется самодиффузией.
Таким образом, сущность кристаллического строения металлов заключается в упорядоченном расположении в них атомов друг относительно друга.
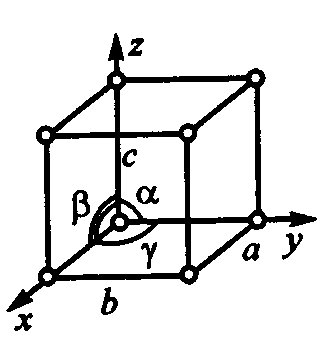
Рис. 1.1. Схема расположения частиц в кристалле
Для упрощения пространственное изображение заменяют схемами (рис. 1.1), отмечая точками центры тяжести частиц. Кристаллы различаются симметрией расположения частиц.
Если в кристалле провести три направления x, у, г, не лежащих в одной плоскости, то расстояния между частицами, расположенными по этим направлениям, в общем случае неодинаковы и соответственно равны а, b, c.
Плоскости, параллельные координатным плоскостям, находящиеся на расстоянии а, b, с разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед называют элементарной ячейкой. Последовательное перемещение его образует пространственную кристаллическую решетку. Верши-ны параллелепипеда называют узлами пространственной решет-ки. С этими узлами совпадают центры тяжести частиц, из кото-рых построен кристалл.
Для описания элементарной ячейки кристаллической решетки используют шесть величин: три отрезка, равные рассто-яниям а, b, с до ближайших частиц по осям координат, и три угла α, β, γ между этими отрезками.
Таблица 1.1
Кристаллические системы элементов
|
Система |
Ребра |
Углы |
|
Триклинная |
a ≠ b ≠ c |
α ≠ β ≠ γ |
|
Моноклинная |
a ≠ b ≠ c |
α = β = 90° |
|
|
|
γ ≠ 90° |
|
Ромбическая |
a ≠ b ≠ c |
α = β = γ = 90° |
|
Ромбоэдрическая |
a = b = c |
α = β = γ ≠ 90° |
|
Гексагональная |
a = b ≠ c |
α = β = 90° |
|
|
|
γ = 120° |
|
Тетрагональная |
a = b ≠ c |
α = β = γ = 90° |
|
Кубическая |
a = b = c |
α = β = γ = 90° |
Соотношения между этими величинами определяются симметрией, согласно которой все кристаллы подразделяют на семь систем (табл. 1.1).
Размер элементарной ячейки кристаллической решетки оценивают отрезки a, b, c .Их называют периодами решетки.
В большинстве случаев у реальных металлов решетки более сложные, так как элементарные частицы могут находиться не только в узлах, но и на гранях и в центре решетки.
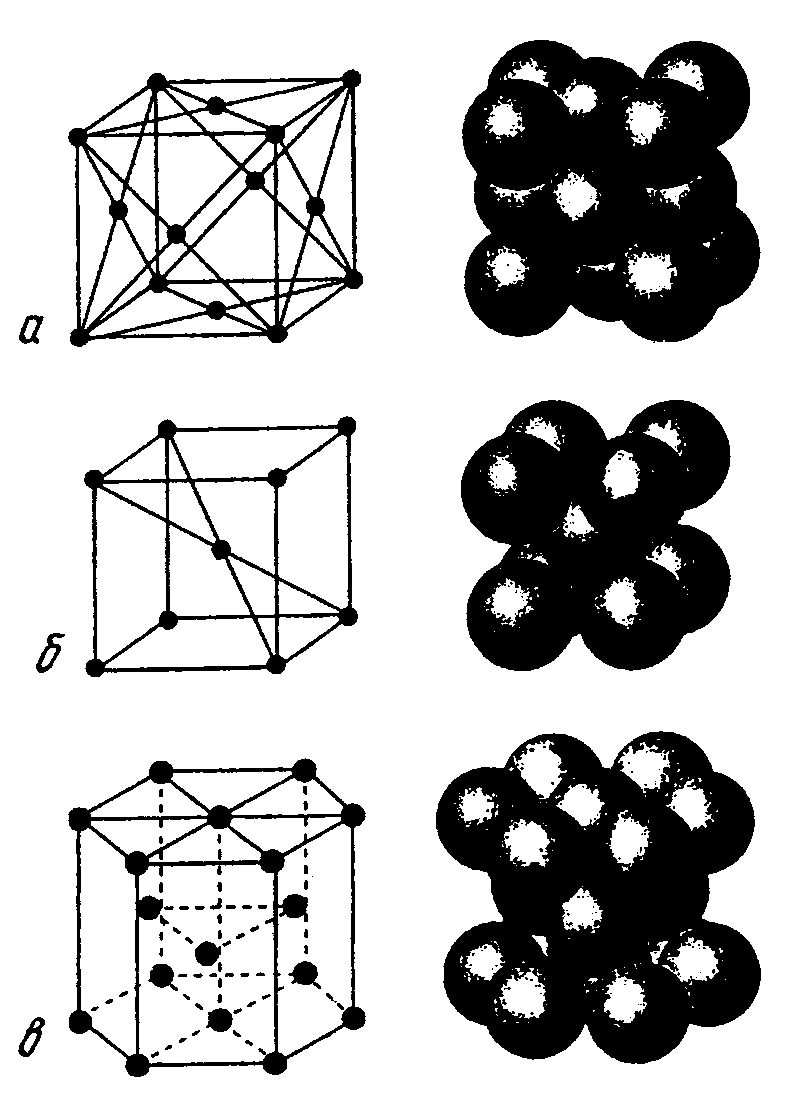
Рис. 1.2. Элементарные ячейки кристаллических решеток:
а – ГЦК; б – ОЦК; в – ГП
На рис. 1.2 показаны три типа элементарных ячеек крис-таллических решеток, наиболее характерных для металлов: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГП). Для характеристики кристаллических решеток введены понятия координационного числа и коэффициента компактности.
Координационным числом К называется число атомов, находящихся на наиболее близком равном расстоянии от данного атома. Для ОЦК решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП. В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП их 12.
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары, то нетрудно видеть, что в решетке помимо атомов имеется значительное свободное пространство. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности.
Коэффициент компактности Q равен отношению суммарного объема атомов, входящих в решетку, к объему решетки:
![]()
где R - радиус атома (иона); п - базис, или число атомов, приходящихся на одну элементарную ячейку; V - объем элементарной ячейки.
Для простой кубической решетки п = (1/8)∙ 8 = 1; V = а3 = (2R)3 и коэффициент компактности Q = 52 %.
Для
ОЦК п
=
(1/8) ∙ 8
+ 1=
2. Учитывая, что атомы соприкасаются
по диагонали куба,
длина которой равна 4
атомным радиусам, параметр
решетки равен а
=
4![]() ,
а
коэффициент
компактности QОЦК
= 68 %.
,
а
коэффициент
компактности QОЦК
= 68 %.
Проведя аналогичные вычисления, найдем QГЦК = 74 %,
QГП = 74 % . Таким образом, решетки ГЦК и ГП более компактны, чем ОЦК.
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку.
Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом α (α-Fе), при более высокой β, затем γ и т. д.
Температура превращения одной кристаллической модификации в другую называется температурой полиморфного превращения.
При полиморфном превращении меняется форма и тип кристаллической решетки. Так, при температуре ниже 911°С устойчиво α-Fe , в интервале 911 - 1392°С устойчиво γ-Fe . При нагреве выше 911°С атомы решетки ОЦК перестраиваются, образуя решетку ГЦК. На явлении полиморфизма основана термическая обработка.
Свойства материалов зависят от природы атомов, из которых они состоят, и силы взаимодействия между ними. В кристаллических материалах расстояния между атомами в разных кристаллографических направлениях различны. Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Различные свойства в кристалле в зависимости от направления испытания называется анизотропией.
