
hiUMM2012 / 2012_ХИ_часть_3_зачеты и эталоны
.pdfФЕДЕРАЛЬНАЯСЛУЖБА ПОНАДЗОРУВСФЕРЕОБРАЗОВАНИЯИНАУКИ
_______________________________________________________________
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ НАУЧНОЕ УЧРЕЖДЕНИЕ «ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»
Часть3
МАТЕРИАЛЫДЛЯПРОВЕДЕНИЯЗАЧЕТА
Х И М И Я
Москва
2012
Часть 3. Материалы для проведения зачета. Химия./ Каверина А.А., Добротин Д.Ю., Снастина М.Г.
©.Каверина А.А., Добротин Д.Ю., Снастина М.Г., 2012.
©.Федеральный институт педагогических измерений, 2012.

Материал для проведения зачетной работы. КИМ ЕГЭ 2011 г. Вариант 102
Критерии оценивания заданий с развёрнутым ответом
C1 |
Используя метод электронного баланса, составьте уравнение реакции |
|
||
|
|
|
Na2SO3 + … + KOH → K2MnO4 + … + H2O |
|
|
|
|
|
|
|
Определите окислитель и восстановитель. |
|
||
|
|
|
|
|
|
|
Содержание верного ответа и указания по оцениванию |
Баллы |
|
|
|
(допускаются иные формулировки ответа, не искажающие его смысл) |
||
|
|
|
||
|
Элементы ответа: |
|
||
|
1) составлен электронный баланс: |
|
||
|
2 |
Mn+7 + ē → Mn+6 |
|
|
|
1 |
S+4 – 2ē → S+6 |
|
|
|
2) указано, что сера в |
степени окисления +4 является восстановителем, а |
|
|
|
марганец в степени окисления +7 (или перманганат калия за счёт марганца в |
|
||
|
степени окисления +7) – окислителем; |
|
||
|
3) составлено уравнение реакции: |
|
||
|
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O |
|
||
|
Ответ правильный и полный, включает все названные выше элементы. |
3 |
||
|
В ответе допущена ошибка только в одном из элементов. |
2 |
||
|
В ответе допущены ошибки в двух элементах. |
1 |
||
|
Все элементы ответа записаны неверно. |
0 |
||
|
|
|
Максимальный балл |
3 |
C2 Даны вещества: оксид азота(IV), медь, раствор гидроксида калия и концентрированная серная кислота.
Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
|
|
Содержание верного ответа и указания по оцениванию |
Баллы |
||
|
(допускаются иные формулировки ответа, не искажающие его смысл) |
||||
|
|
||||
Элементы ответа: |
|
||||
написаны четыре уравнения возможных реакций между указанными |
|
||||
веществами: |
|
||||
1) |
2NO2 |
+ 2KOH = KNO2 + KNO3 + H2O |
|
||
2) |
2NO2 |
+4Cu |
t° |
N2 +4CuO |
|
|
|
||||
|
|
||||
3) |
2KOH +H2SO4(конц.) = K2SO4 + 2H2O |
|
|||
4) Cu +2H2SO4(конц.) =CuSO4 +SO2 ↑+ 2H2O |
|
|
Правильно записаны 4 |
уравнения возможных реакций. |
4 |
Правильно записаны 3 |
уравнения реакций. |
3 |
Правильно записаны 2 |
уравнения реакций. |
2 |
Правильно записано 1 уравнение реакции. |
1 |
|
Все элементы ответа записаны неверно. |
0 |
|
|
Максимальный балл |
4 |
*Примечание. Оцениваются первые четыре уравнения реакций. |
|
|
3

C3 Напишите уравнения реакций, с помощью которых можно осуществить превращения:
С, t° |
C H Cl, AlCl |
+Cl , свет |
Х3 →стирол |
→ |
|
|
ацетилен→Х1 →2 5 3 Х2 |
→2 |
|
||||
→полистирол. |
|
|
|
|
|
|
|
|
|
|
|||
Содержание верного ответа и указания по оцениванию |
|
Баллы |
||||
(допускаются иные формулировки ответа, не искажающие его смысл) |
||||||
|
||||||
Элементы ответа: |
|
|
|
|
|
|
написаны уравнения реакций, соответствующие схеме превращений: |
|
|
||||
С, t° |
|
|
|
|
|
|
1) 3C2H2 → C6H6 |
|
|
|
|
||
|
AlCl3 |
|
|
|
|
|
2) C6H6 + C2H5Сl → C6H5–C2H5 + HCl |
|
|
|
|||
|
свет |
|
|
|
|
|
3) CH3–CH2–C6H5 + Cl2 → CH3–CHCl–C6H5 + HCl |
|
|
|
|||
4) CH3–CHCl–C6H5 |
+ KOH (спирт. р-р) → CH2=CH–C6H5 + KCl + H2O |
|
|
|||
|
t° |
|
|
|
|
|
5) n CH2 =CH −C6H5 →(−CH2 − |
CH −)n |
|
|
|
||
|
|
|
|
|
|
|
|
C6H5 |
|
|
|
||
Ответ правильный и полный, включает все названные выше элементы. |
|
5 |
||||
Правильно записаны 4 уравнения реакций. |
|
|
|
4 |
||
Правильно записаны 3 уравнения реакций. |
|
|
|
3 |
||
Правильно записаны 2 уравнения реакций. |
|
|
|
2 |
||
Правильно записано одно уравнение реакции. |
|
|
1 |
|||
Все элементы ответа записаны неверно. |
|
|
|
0 |
||
|
|
|
Максимальный балл |
5 |
||
C4 В 15%-ном растворе серной кислоты массой 300 г растворили карбид алюминия. Выделившийся при этом метан занял объём 2,24 л (н.у.). Рассчитайте массовую долю
серной кислоты в полученном растворе.
4

Содержание верного ответа и указания по оцениванию |
Баллы |
|
(допускаются иные формулировки ответа, не искажающие его смысл) |
||
|
||
Элементы ответа: |
|
|
1) составлено уравнение реакции серной кислоты с карбидом алюминия и |
|
|
рассчитана его масса: |
|
|
Al4С3 + 6H2SO4 → 2Al2(SO4)3 + 3СН4 ↑ |
|
|
n(Al4С3) = 1/3·n(СН4) = 0,033 моль |
|
|
m(Al4С3) = 0,033моль · 144 г/моль = 4,8 г |
|
|
2) рассчитана масса выделившегося метана: |
|
|
n(СН4) = 2,24/22,4 = 0,1 моль |
|
|
m(СН4) = 0,1 моль · 16 г/моль = 1,6 г |
|
|
3) определена масса прореагировавшей серной кислоты: |
|
|
n(H2SO4) = 2·n(СН4) = 0,2 моль |
|
|
m(H2SO4) = 0,2 моль · 98 г/моль = 19,6 г |
|
|
4) рассчитана масса раствора и массовая доля оставшейся кислоты в нем: |
|
|
m(раствора) = 300 + 4,8 – 1,6 = 303,2 г |
|
|
w(H2SO4) = (300·0,15 – 19,6)/303,2 = 0,084 = 8,4% |
|
|
Ответ правильный и полный, включает все названные выше элементы. |
4 |
|
В ответе допущена ошибка в одном из названных выше элементов. |
3 |
|
В ответе допущены ошибки в двух из названных выше элементов. |
2 |
|
В ответе допущены ошибки в трёх из названных выше элементов. |
1 |
|
Все элементы ответа записаны неверно. |
0 |
|
Максимальный балл |
4 |
*Примечание. В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (первом, втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
C5 Cложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите
молекулярную формулу этого эфира.
Содержание верного ответа и указания по оцениванию |
Баллы |
|
(допускаются иные формулировки ответа, не искажающие его смысл) |
||
|
||
Элементы ответа. |
|
|
1) составлено уравнение гидролиза эфира в общем виде, найдено количество |
|
|
вещества едкого натра: |
|
|
RCOOR’ + NaOH → RCOONa + R’OH |
|
|
m(NaOH) = (34 + 16) – 30 = 20 г или n(NaOH) = 20/40 = 0,5 моль |
|
|
2) определена молярная масса эфира и его формула: |
|
|
из уравнения следует, что n(RCOOR’) = n(NaOH) = 0,5 моль, тогда |
|
|
M(RCOOR’) = m/n = 30/0,5 = 60 г/моль |
|
|
M(R1 + R2) = 60 – 12 – 32 = 16 г/моль, следовательно ими могут быть только |
|
|
атом Н и метил СН3 |
|
|
формула эфира НСООСН3 |
|
|
Ответ правильный и полный, включает все названные выше элементы. |
2 |
|
Правильно записан первый элемент ответа. |
1 |
|
Все элементы ответа записаны неверно. |
0 |
|
Максимальный балл |
2 |
5

Работы экзаменуемых вариант 102 ЕГЭ 2011 г Работа 1
6

7
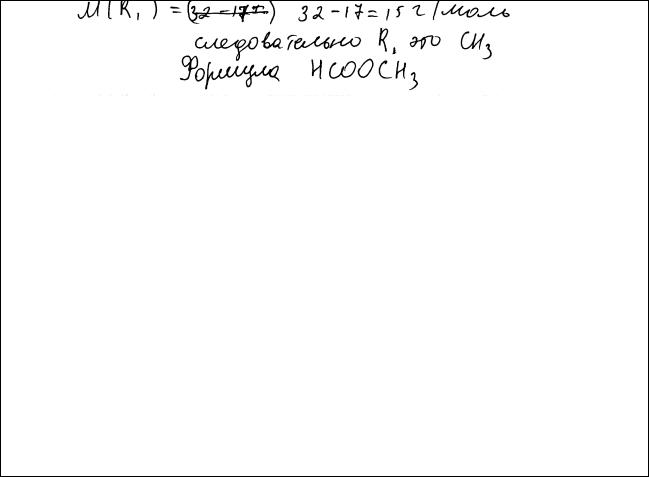
8

Работа 2
9

10
