Биологический факультет. ГОСник. Шпоры / ГОС Ответы / билет №09
.docБилет №9.Отдел покрытосеменные. Наличие цветка, покрытосемянность, наличие сосудов и др черты более сложной организации цветковых растений по сравнению с голосеменными. Морфологическая природа цветка и его частей. Пок/сем-е или цветковые(Ц.р.)- отд высших растений, имеющий цветок семязачатки (семяпочки), у Ц.р. заключены в полость завязи, гаметофиты (жен - зародышевый мешок, муж - зрелое пыльцевое зерно), крайне упрощены и развив-ся гораздо быстрее, чем голосеменные, в связи с чем они утратили гаметангии – антеридии и архегонии. Для Ц.р. хар-но двойное оплодотворение, семена цветковых заключены в плод. Наиболее хар-но для них наличие пестика, обр-го одним или несколькими плодолистиками (макро- и микроспорофиллами), сросшимися так, что в нижней части пестика обр-ся замкнутое полое вместилище – завязь, в которой развиваются семяпочки (видоизмененные мега- и макроспорангии). После оплод-я завязь разрастается – плод, внутри которого нах-ся, развив-ся из семяпочек – семена. Для Ц.р. хар-но 8-ми ядерный зародыш-й мешок, триплоидный эндосперм, обр-ся после оплод-я, рыльце, улавливающее пыльцу, и для большинства цветок с околоцветником. Из анатомических признаков хар-но наличие настоящих сосудов (трахей), а у голосем-х развиты – трахеиды. По сравнению с голосем-и покрт-сем-е имеют заросток еще более редуцированный. При развитии у них муж-го гаметофита никогда не обр-ся проталлиальные кл (остаток вегетативного тела – заростка), типичные для гол-сем-х, вегетат-я часть жен-го заростка сост-т из антипода, а у гол\сем жен-й гаметофит представлен тканевым телом, заключенным в мегаспору. У покрытосемянных преимущество в защите семяпочек и развив-ся семян от воздействия неблагоприятных факторов. Эволюция у Ц.р. шла от цветков с удлиненным (вытянутым) цветоложем, обоеполых, актиноморфных, со спиральным расположением неопр-х в числе, свободных (несросшихся) цветолистьев, цветков с верхней завязью и многочисленными семяпочками – к цветкам циклическим с вполне опр-м числом членов, не редко сросшихся друг с другом и распологаю-ся на плоском или вогнутом цветоложе, к цветкам зигоморфным и имеющим ниж-ю завязь с несколькими или одной семяпочкой. Распрост-ны по всему почти до крайних пределов растительности, опред-ют хар-р ландшафтов везде , кроме хвойных лесов, торфяных болот и тундр. Деятельности человека роль цветковых больше чем остальных растений. Пища, одежда, фураж для скота, вкусовые ароматические, лекарственные, дубильные вещ-ва, каучук. Материал для жилища топлива отделочные мат-лы, бумага в значительной степени поставляется пок\сем.
2. Белки: классификация, свойства, биологическая роль. Белки-главные компоненты живой клетки – это сложные органические биополимеры, состоящие из C, H, O, N и S. Их мономерами являются аминокислоты – определяют суть живой материи. Классификация б несовершенна-1)-в соответствии с вторичной и третичной стр-рой ;2) В соответствии с выполняемыми функциями выделяют сл. Группы белков: 1)каталитически активные белки-ферменты- ускоряют химические превращения в кл; 2) белки-гормоны-возд. На фундаментальные мех-мы регуляции обмена в-в(прониц-ть Кл. мембран, биос-з вторичных посредников;3) Регуляторные б-репрессия и активация генома и регуляция процессов роста, развития, морфогенез жив и раст (гистоны);4) защитные белки-антитела(иммуноглобулины);5) Токсические белки-внешняя защита (яд змей);6)Транспортные б-сывороточный альбумин(перенос жирн.к-т, гемоглабин, порины(обр. поры в мембране);7)структурные б -комп. Мембран, б. межклеточного матрикса(коллаген, ретикулин), белки ядерного матрикса, цитоплазм. скелета; 8)Сократительные б-миозин, актин;9)Рецепторные б-учавств. В передаче инф. в биол. сист.(опсин);10)белки-ингибиторы ферментов;11)белки вирусных оболочек и др. Свойства белков. Различают химические, физические и биологические св-ва. Химические св-ва белков оч. разнообразны благодаря аминокислотным радикалам различной природы->способны давать широкий круг р-ций: солеобразования (по NH2-и COOH-группам);окисления и восстановления (по HS-и SS-группировкам);алкилирования, ацилирования и этерификации (NH2, OH, COOH), амидирования (COOH), нитрования и галогенирования (по ароматическим ядрам), дезаминирования( NH2), фосфорилирования и сульфатирования (OH);реакции гидролиза пептидных связей;амфотерные св-ва б обусл. Наличием основных и кислых групп.Физические св-ва : большая молекулярная масса,двойное лучепреломление, подвижность в Эл. Поле, оптическая активность, СП-ть рассеивать световые лучи из-за боьших размеров и поглащать у/ф. Оптические св-ва используют при кол-ном определении белков. Транспортная ф-ция б связана с их СП-тью адсорбировать на пов-ти низкомол-ные органич.соед-ния и ионы. Биологические св-ва :биокаталитическая активность благодаря нал-ю активного центра в белках-ферментах; гормональная активность-сп-ть возд-ть на целые группы р-ций в организме; токсическая ак-ть;патогенная а-ть;защитные и рецепторные ф-ции, отв-ть за явление клеточной адгезии ->морфогенез; пластическая роль б-сочетаясь с др. мол-ми -> смешанные биополимеры-нуклеопротеины, липопротеины, гликопротеины-> образованиесуб-и-надкл. Образований; Денатурация-изм-ния третичной и четвертичной стр-ры под возд-ием внешних ф-ров(наруш. Дисульфидн. мостики, солевые, водор.связи, гидроф.вз-я. Структурная организация белков. 1)Первичная стр-ра-линейная полипептидная цепочка(специфичность б определяется набором а/к и их последоват-тью расположения в цепочке). В цепочке выдкляют остов (без радикалов), N-конец (начало NH3-группа), C-конец(COOH-);2)Вторичная стр-ра - Спиральнозакрученная белковая цепочка. Витки спирали удерживаются связями, которые образуются м/у группами СО и NH соседних витков. Различают ά и βспирали. Альфа-спираль представляет п/п цепочку закрученную вправо. Стержен—п/п остов, R-группы снаружи, стр-ру удерживают водородные связи; β-складчатая стр-ра, плоская, п/п цепи распол. Параллельно др другу,водор. Связи м/у близлижащими группами. В этих стр-рах нет сульфгидрильных групп(цистеин) и тяжелых R-групп. Третичная- дальнейшая укладка спирали в трехмерном пр-ве. Элементы вторичной стр-ры взаим. м/у собой. Различают глобулярные белки-уложенные в глобулу(ферменты, гормоны, антитела, белки-переносчики)и фибриллярные - п/пепт. цепи объед. в волокна, нерастворимые в воде. В формир. Третьичной стр-ры учавствуют водор. Связи м/у сближенными R-группами, ковалентные дисульфидные, ионные, гидрофобные. Гемоглабин-70% ά-спирали, рибонуклеаза-80% β-спирали. Сворачивание в третичную стр-ру зависит от последовательности а/к. Мех-м не ясен. Сверхвторичная стр-ра-взаимод м/у ά-и- β-спиралью(энергетич.> выгодно)-> άά, βά, βάβ и др. Аминокислоты. Около 300:1)белковые (20)-после матричного синтеза декодированные;2)белковые редкие – производные первых;3)небелковые(150). Не встр. в составе белков. Белковые: нормальные, основные, стандартные. Общая формула – COOH-CHR-NH2.Могут давать стереоизомеры(L-и-D-формы). L-форма –NH2-группа слева, D- справа(Фишер).Глицин не имеет изоформ (R=H).Амфотерность-сп-ть отдавать протоны(COOH) и принимать (R)-> а/к могут быть донорами и акцепторами протонов при изменении pH->классифицируют на 4 группы:1)R-цепь имеет неполярный и гидрофобный хар-р(ала, вал, лей, илей,про,мет,три)-> большое значение для гидрофобных областей-зоны слипания, стр-ра белков-про имеет жесткую конфигурацию, обр. жесткие уч-ки, вл. на конф-цию белка;2)R-группы незаряжены, но полярны (ОН)-сер,тре, тир, асп и глутамин имеют полярную амидную группу, цис-сульфгидр. Группу SH-> могут учавств. в обр. водор. связей;3)R-группа-положительнозар. аминогруппа- Лиз, арг, гис->связыв. С фосф. группами;4) отрицательнозар. R-группа-Асн, глу.
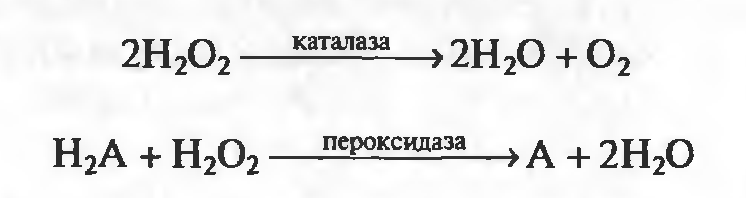
3. молекулярный кислород атмосферы имеет биогенное происхождение, его появление связано с формированием нового типа фотосинтеза (в качестве доноров электронов используется вода). До возникновения выделяющих кислород фотосинтезирующих эубактерий, единственный источник молекул.кислорода – реакция фотолиза паров воды в атмосфере, под действием коротковолнового ультрафиолета. Но количество этого кислорода было ничтожным. Он использовался для окисления газов первобытной атмосферы и востоновленных минералов, входящих в состав земной коры. Организмы осуществляющие фотосинтез с выделением О2 примитивно организованными являются фотосинтезирующие эубактерии (цианобактерии, прохлорофиты). Появление О2 связано с этими организмами или с их весьма далёкими предками. Значение накопления О2. образование О2 в возрастающих количествах сделало возможным: 1)протекание окислительной реакции в широких масштабах 2)изменился характер атмосферы, из восстановительной она стала окислительной. Кислород действует на прокариоты двояко: 1) может быть совершенно необходим 2)токсически. Токсический эффект О2 зависит от условий: концентрации растворённого О2, длительности экспозиции, состава окружающей среды. Токсичность может быть следствием активного акцептирования им электронов с растворённых переносчиков, функционирующих в процессах брожения, что будет приводить к истощению внутриклеточного пула восстановленных доноров электронов, необходимых для биосинтезов. Окисление О2 какого либо одного ключевого метаболита или фермента , приводящего к их инактивации. Защитные механизмы клетки: 1)ферментные системы 2)С помощью клеточных метаболитов 3)приспособления прокариот, помогающие им в защите от токсических эффектов молекулярного кислорода. Ферментные системы: супероксиддисмудаза(захватывает молекулы О2)-фермент,содержит в своём центре в качестве простетической группы ионы металла, у прокариот это атомы марганца или железа.Ионы марганца окисляются под действие кислорода,способен эффективно убирать образующиеся супероксидные ионы. Каталаза и пероксидаза(улавливают Н2О2)