
Шпоргалка (механика-термодинамика)
.doc
|
25.Постулаты МКТ. Связь между средней кинетической энергией поступательного движения молекул и температурой. Физический смысл температуры. Средняя и средняя квадратичная скорости молекул газа.
Постулаты МКТ - все тела состоят из частиц: атомов, молекул и ионов
- частицы находятся в непрерывном хаотическом движении (тепловом)
- частицы взаимодействуют друг с другом путём абсолютно упругих столкновений
Рассмотрим движение молекул газа в сосуде и определим давление системы молекул на стенки сосуда. Выделим элемент поверхности стенки сосуда площадью S, а систему координат для описания движения молекул выберем таким образом, чтобы одна из осей координат (например, ОХ) была перпендикулярна выделенному элементу стенки. При
абсолютно упругом соударении со
стенкой сосуда молекула, имеющая
проекцию скорости
Если
предположить равновероятное движение
молекул по всем направлениям в сосуде,
то число молекул, двигающихся вдоль
каждой из трех осей системы координат,
будет одинаковым и составит 1/3 от
общего числа молекул. Вдоль положительного
направления оси ОХ будт двигаться
половина от этого числа молекул, т.е.
1/6 от общего числа молекул в сосуде.
Таким образом,
Так как p = nkT, то
Средняя арифметическая скорость молекул
Средняя квадратичная скорость
|
26. Идеальный газ. Термодинамические параметры идеального газа. Уравнение Клапейрона-Менделеева. Плотность идеального газа. Связь между давлением, концентрацией и температурой.
Идеальным наз. газ, взаимодействием между молекулами которого можно пренебречь. Для модели идеального газа приняты следующие условия: - молекулы имеют пренебрежимо малые размеры по сравнению с объемом газа; - молекулы участвуют в хаотическом тепловом движении, характеризующимся равновероятным направлением скорости (то есть среднее значение любой из трех проекций скорости равно нулю); - взаимодействие молекул друг с другом и со стенками сосуда носит характер абсолютно упругого удара. термодинамики, наз. термодинамической. Термодинамическими параметрами (параметрами состояния) наз. физические величины, служащие для характеристики состояния термодинамической системы. Примерами термодинамических параметров являются давление, объем, концентрация, температура и др. Можно доказать, что не все параметры термодинамической системы, находящейся в равновесном состоянии, независимы: внутренние параметры такой системы зависят только от ее внешних параметров и температуры. Уравнение, связывающее любой термодинамический параметр системы с параметрами, принятыми в качестве независимых переменных, наз. уравнением состояния. Уравнение состояния, связывающее для однородного тела давление р, объем V и температуру Т, наз. термическим уравнением состояния: f(p,V,T)=0 Уравнение состояние идеального газа (уравненение Клапейрона-Менделеева):
R=8,31 Дж/(моль·К) Плотность:
p = nkT - связь между давлением, концентрацией и температурой. n
– концентрация
|
27. Основное уравнение МКТ (связь между давлением и средней кинетической энергией поступательного движения молекул газа).
Рассмотрим движение молекул газа в сосуде и определим давление системы молекул на стенки сосуда. Выделим элемент поверхности стенки сосуда площадью S, а систему координат для описания движения молекул выберем таким образом, чтобы одна из осей координат (например, ОХ) была перпендикулярна выделенному элементу стенки. При
абсолютно упругом соударении со
стенкой сосуда молекула, имеющая
проекцию скорости
Если
предположить равновероятное движение
молекул по всем направлениям в сосуде,
то число молекул, двигающихся вдоль
каждой из трех осей системы координат,
будет одинаковым и составит 1/3 от
общего числа молекул. Вдоль положительного
направления оси ОХ будт двигаться
половина от этого числа молекул, т.е.
1/6 от общего числа молекул в сосуде.
Таким образом,
Суммарный
импульс, передаваемый стенке за единицу
времени
Давление газа это суммарный импульс за единицу времени
Давление газа пропорционально произведению средней кинетической энергии движения молекул газа на концентрацию молекул в сосуде.
|
|
28. Внутренняя энергия идеального газа. Внутренняя энергия. Теорема о равномерном распределении энергии по степеням свободы. Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию
тела нельзя измерить напрямую. Можно
определить только изменение внутренней
энергии: Идеальный газ
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа не
зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости при
постоянном объёме,
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при
постоянном объёме (изохорных
процессах);
в общем случае Энергия движения молекулы определяется очередь, энергией ее поступательного движения, энергией ее вращения и энергией колебания атомов в молекуле:
Минимальное число независимых переменных, однозначно определяющих положение тела в пространстве (или минимальное число независимых перемещений тела в пространстве) наз. числом степеней свободы ( i ) тела. Для одноатомной молекулы i = 3 Закон
Больцмана о равномерном распределении
энергии молекул по степеням свободы:
если система молекул находится в
тепловом равновесии при температуре
Т, то средняя кинетическая энергия
молекул равномерно распределена по
степеням свободы, причем на каждую
степень свободы приходится энергия
Если же рассмотреть ν молей идеального газа, то кинетическая энергия его молекул
Внутренняя энергия заданного числа молей идеального газа – однозначная функция его температуры. Она зависит только от состояния идеального газа и не зависит от того, каким образом газ пришел в данное состояние. Изменение внутренней энергии данной массы идеального газа в произвольном процессе
По уравнению Менделеева-Клаперона
|
29.Работа в термодинамике. Коли́чество теплоты́. Теплоёмкость. Зависимость теплоёмкости газа от температуры. При рассмотрении термодинамических процессов механическое перемещение макротел в целом не рассматривается. Понятие работы здесь связывается с изменением объема тела, т.е. перемещением частей макротела друг относительно друга. Процесс этот приводит к изменению расстояния между частицами, а также часто к изменению скоростей их движения, следовательно, к изменению внутренней энергии тела. Элементарная работа, совершаемая газом над внешними телами:
Изохорный процесс:
Изобарный процесс:
Изотермический процесс:
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основныхтермодинамических величин. Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние dQ=dU+A
Теплоёмкость для различных состояний вещества
Теплоёмкость тела
(обычно обозначается латинской
буквой C) — физическая
величина,
определяющая отношение бесконечно
малого количества
теплоты δQ,
полученного телом, к соответствующему
приращению его температуры δT: Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:
где R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная. А при постоянном давлении
Молярная теплоемкость C — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
|
29.Теплоёмкости . Выводы По обьёму Количество теплоты, полученной телом, выражается через его массу и теплоёмкость известной формулой
Поскольку в изохорическом процессе газ не совершает работу, количество полученной им теплоты равно изменению внутренней энергии:
Приравнивая правые части обоих уравнений, получим
По давлению
Поскольку в изобарическом
процессе количество полученной газом
теплоты равно изменению внутренней
энергии плюс совершённой газом работе,
запишем :
П
|
|
|
|
|
|
31.Адиабатический процесс. Уравнение Пуассона.
|
32. Политропические процессы в идеальном газе. Уравнение политропы. Изопроцессы как частные случаи политропического процесса. Ограниченность классической теории теплоемкости.
Теплоемкость тела (системы) численно равна количеству теплоты, которое необходимо сообщить телу (системе), чтобы изменить его температуру на 1 К в данном процессе:
Удельная
теплоемкость вещества численно
равна количеству теплоты, которое
необходимо сообщить единице массы
тела (системы), чтобы изменить его
температуру на 1 К в данном процессе:
Молярная теплоемкость:
Политропным наз. процесс, в котором теплоемкость вещества не изменяется. В
случае идеального газа политропный
процесс определяется уравнением
с – молярная теплоемкость газа в политропном процессе,
Частные случаи уравнения политропы:
Уравнение Майера:
Экспериментальное подтверждение формул молярной теплоемкости для изопроцессов наталкивается на ряд трудностей. Хорошее согласие во всем интервале температур у формулы с экспериментом получается только в ограниченном интервале температур. Закон Больцмана о равномерном распределении температур справедлив только для диапазона 273<T<723 К. Происходит это из-за того, что МКТ не учитывает квантовый характер движения молекул и атомов в молекулах. При низких температурах у молекулы возбуждаются только степени свободы поступательного движения. На вращательные степени свободы приходится слишком малая энергия, ими пренебрегают. В этих условиях газ ведет себя как одноатомный. С ростом температуры начинают возбуждаться вращательные степени свободы, а затем колебательные. Молекула перестает быть жесткой, расстояния между атомами в молекуле начинают меняться. На колебательную степень свободы приходится энергия
Это и приводит к заниженным значениям теплоемкости идеального газа, получаемым согласно классической теории теплоемкости, по сравнению с результатами эксперимента. |
33. Тепловая машина. КПД тепловой машины. Холодильная машина.
|
|
34. Обратимые и необратимые процессы и циклы. Примеры таких процессов. Тепловая машина и ее КПД. Холодильная машина. Цикл Карно и его КПД.
Термодинамический процесс, совершаемый системой, наз. обратимым, если он может быть проведен в прямом и обратном направлениях через те же состояния (но в обратной последовательности) так, что после осуществления прямого и обратного процесса в окружающей среде не возникаем никаких остаточных изменений. Примеры:
Для осуществления превращения теплоты, переданной системе, в работу созданы специальные устройства – тепловые машины.
Цель
действия тепловой машины – получение
работы А, которую над внешними телами
будет совершать рабочее тело. Для
совершения рабочим тело работы ему
передается некоторое количество
теплоты
Мерой эффективноти преобразования теплоты, подведенной к рабочему телу, в работу тепловой машины над внешними телами является КПД, который равен отношению работы, совершенной рабочим телом за один цикл, к количеству теплоты, полученному рабочим телом от нагревателя в этом цикле:
1-2, 3-4 – изотермы, 2-3, 4-1 – адиабаты. КПД
цикла Карно будет максимальным среди
КПД всех возможных циклов, которые
рабочее тело может осуществить между
нагревателем и холодильником с
заданными температурами
|
34. Цикл Карно, КПД цикла Карно. Второе начало термодинамики Цикл Карно:
КПД
цикла Карно будет максимальным среди
КПД всех возможных циклов, которые
рабочее тело может осуществить между
нагревателем и холодильником с
заданными температурами
|
35. Неравенство Клаузиуса. Энтропия – функция состояния термодинамической системы. Основное свойство энтропии (формулировка второго начала термодинамики через энтропию). Статистический смысл второго начала.
Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.
Каждому состоянию газа соответствует некоторое распределение его молекул по объему и определенное распределение молекул по скоростям. В целом вероятность какого-либо состояния системы W больше вероятности w отдельного распределения в Р раз: W = wP, где Р – термодинамическая вероятность состояния системы. Она равна числу всевозможных микрораспределений частиц по координатам и скоростям, соответствующих данному термодинамическому состоянию (макросостоянию). W≤1, w≤1, Р≥ 1.
Статистическое толкование второго закона термодинамики: Энтропия изолированной системы не убывает: термодинамическая вероятность состояния изолированной системы не может убывать.
|
|
37. Статистические распределения. Свойства функции распределения
|
38. Распределение молекул газа по скоростям (распределение Максвелла). Смысл функции распределения. Наиболее вероятная, средняя и средняя квадратичная скорости молекул. Зависимость функции распределения от температуры.
Максвелловский закон распределения молекул газа по скоростям определяет, какое число dN молекул газа из общего числа его молекул N в единице объема имеет при данной температуре скорости, заключенные в интервале от v до v+dv:
Проанализируем поведение функции распределения молекул по скоростям
Средняя квадратичная скорость
Функция распределения плотности вероятности позволяет найти не число молекул, скорости которых лежат в определенном интервале скоростей, а только долю от общего числа молекул. Максвелловское распределение нельзя использовать для анализа систем молекул при очень высоких температурах. При таких температурах максимум кривой распределения резко «сдвигается» в область больших скоростей, и скорости молекул могут даже превысить скорость света. Максвелловское распределение нельзя использовать для анализа систем молекул при очень низких температурах. При таких температурах максимум кривой распределения резко «сдвигается» в область малых скоростей, и кривая сильно сужается. Тогда в рассматриваемом интервале скоростей может оказаться очень мало молекул, следовательно, к такому числу частиц нельзя применять методы теории вероятностей
|
39. Барометрическая формула. Распределение Больцмана.
Больцман получил барометрическую формулу – зависимость давления газа от высоты в потенциальном поле тяжести Земли. Рассмотрим равновесие некоторого объема (цилиндр высотой dh) газа, находящегося на высоте h от поверхности Земли, уровень которой выберем за условный ноль отсчета потенциальной энергии. Так как столбик газа находится в равновесии,
Минимальное число независимых переменных, однозначно определяющих положение тела в пространстве (или минимальное число независимых перемещений тела в пространстве) наз. числом степеней свободы ( i ) тела. Для одноатомной молекулы i = 3 Закон
Больцмана о равномерном распределении
энергии молекул по степеням свободы:
если система молекул находится в
тепловом равновесии при температуре
Т, то средняя кинетическая энергия
молекул равномерно распределена по
степеням свободы, причем на каждую
степень свободы приходится энергия
|



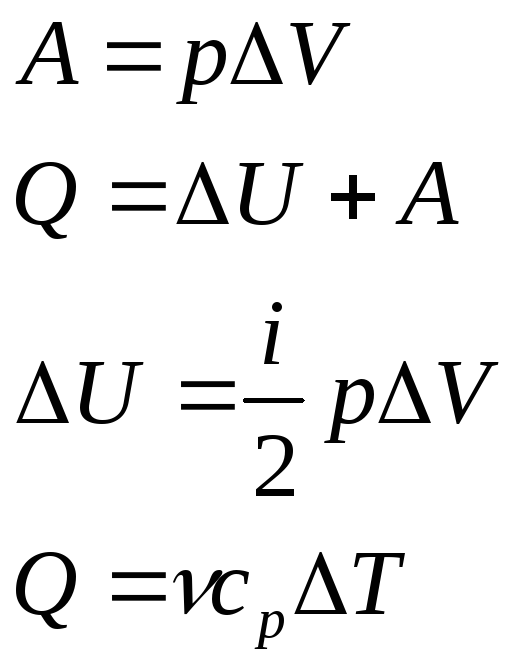





 Тепловая
машина, работающая по циклу Карно,
наз. идеальной тепловой машиной.
Тепловая
машина, работающая по циклу Карно,
наз. идеальной тепловой машиной. 1-2,
3-4 – изотермы, 2-3, 4-1 – адиабаты.
1-2,
3-4 – изотермы, 2-3, 4-1 – адиабаты. Тепловая
машина, работающая по циклу Карно,
наз. идеальной тепловой машиной.
Тепловая
машина, работающая по циклу Карно,
наз. идеальной тепловой машиной.


 Найдем,
при какой скорости наблюдается
максимальное значение функции f(v).
Такую скорость назовем наиболее
вероятной скоростью молекул.
Найдем,
при какой скорости наблюдается
максимальное значение функции f(v).
Такую скорость назовем наиболее
вероятной скоростью молекул.
 Средняя арифметическая скорость
молекул
Средняя арифметическая скорость
молекул Энергия движения молекулы определяется,
в свою очередь, энергией ее поступательного
движения, энергией ее вращения и
энергией колебания атомов в молекуле:
Энергия движения молекулы определяется,
в свою очередь, энергией ее поступательного
движения, энергией ее вращения и
энергией колебания атомов в молекуле: