
Глава 14 пожарная безопасность
14.1. Общие сведения о процессе горения
Горением принято называть быстропротекающую химическую реакцию, сопровождающуюся выделением тепла и излучением света. Для протекания процесса горения необходимым условием является наличие смеси реакционноспособных веществ, содержащей окислитель и горючее. Окислителем обычно служит кислород воздуха» хотя некоторые материалы (например, металлы) могут гореть при взаимодействии с галогенами и в среде углекислого газа; окислителями также могут служить кислородосодержащие жидкие (например азотная кислота, перекись водорода, четырехокись азота) и твердые (например, хлорноватокислый калий, пер-манганаты) вещества.
Горючими, как правило, являются углеродо-водородосодержащие вещества, которые также могут быть в газообразном, жидком или твердом состоянии.
Наличие смеси окислителя с горючим не является, однако, достаточным условием для возникновения горения. Окислитель (например, кислород воздуха) и горючее (например, пары бензина) могут находиться в перемешанном состоянии, никак не проявляя своей способности к горению» Но при появлении какого-либо высокотемпературного источника (искры, открытого пламени) эта смесь сгорает с большой скоростью. Источником зажигания смеси может следить вода (для щелочных металлов), луч света (например, для смесей хлора с окисью углерода или водородом), механический импульс, ударная волна и т.д.
Горение, как следует из определения, сопровождается выделением тепла. Тепловой эффект реакции зависит от разности энергии исходных компонентов и конечных продуктов реакции (рис 14.1). Если баланс энергий положительный, то реакция идет с выделением тепла и называется экзотермической. При отрицательном – реакция может идти только при условии постоянного подвода к реагирующей системе энергии извне, а реакция называется эндотермической. Следовательно, реакции горения относятся к экзотермическим»
Закономерности протекания процесса горения зависят от химической природы реагирующих веществ, состояния и состава горючей смеси, вида источника зажигания. Характерные виды процесса горения представлены в табл. 14.1.
В зависимости от причины возникновения горения различают вынужденное зажигание и самовозгорание. При вынужденном зажигании на горючую смесь действует тепловой импульс, вызывающий ускорение протекания химической реакции. Основными источниками теплового импульса являются открытое пламя, нагретая поверхность, искра, резкое сжатие.
Ускорение химической реакции может возникнуть и в результате протекания химических или микробиологических процессов, способствующих образованию тепла» Явление резкого увеличения скорости химической реакции, приводящее к возникновению горения вещества в отсутствие источника зажигания, называется самовозгоранием (рис.14.2).
Период индукции (время с начала повышения температуры над температурой окружающей среды и до момента достижения температуры самовозгорания) может быть очень велик и зависит от условий накопления тепла. Начавшееся повышение температуры может прекратиться или даже температура может начать падать при изменении условий, влияющих на скорости образования и рассеивания тепла. Начавшиеся в материале реакции окисления могут завершиться при этом лишь процессом самонагревания без перехода к самовозгоранию.
Таким образом, как при вынужденном зажигании, так и при самовозгорании в горючей смеси должны возникнуть условия, при которых скорость тепловыделения должна превысить скорость теплоотвода. Это условие определяет явление самовоспламенения горючей смеси.
Таблица 14.1. Классификация видов процессов горения
|
Признак классификации |
Виды горения |
Необходимые условия |
|
Агрегатное состояние компонентов горючей смеси |
гомогенное |
Окислитель и горючее находятся в газовой или паровой фазе |
|
гетерогенное |
Один из компонентов горючей смеси находится в твердом или жидком состоянии, другой – в газообразном | |
|
Фактор, лимитирующий скорость горения |
кинетическое |
Однородная горючая смесь (например, заранее перемешанные горючий газ с воздухом). Скорость горения определяется только скоростью химической реакции |
|
диффузионное |
Горючее вещество и окислитель не перемешаны и имеют поверхность раздела (например, твердые и жидкие вещества, струи газов и паров, поступающие в воздух). Горение лимитируется скоростью образования горючей смеси (разложения твердого вещества, испарения жидкости, перемешивания газов и т.д.) |
Продолжение Табл. 14.1.
|
Признак классификации |
Виды горения |
Необходимые условия |
|
Скорость распространения пламени |
дефлаграционное |
Передача тепла и, следовательно, распространение пламени по горючей смеси происходит путем молекулярной диффузии, теплопроводности, а также за счет турбулентного движения молей газа (скорость нормального распространения пламени невелика – дециметры в секунду) |
|
взрывное |
Скорость распространения горения по горючей смеси составляет десятки и сотни метров в секунду с образованием ударной волны | |
|
детанационное |
Чрезвычайно быстрое (тысячи м/с) распространение горения, связанное с воспламенением горючей смеси ударной волной |
Тепловая теория самовоспламенения разработана Н.Н.Семеновым и заключается в следующем.
В химическую реакция может вступить не всякая частица горючей смеси, а только так называемая "активная", обладающая достаточным запасом энергии. Взаимодействие (реагирование) частиц произойдет, если энергия соударения не ниже энергии активации реакции.
Доля активных молекул и, следовательно, скорость химической реакции возрастает при увеличении температуры горючей смеси экспоненциально (закон Аррениуса):
![]() (14.1.)
(14.1.)
где k - коэффициент» учитывающий физические условия протекания химической реакции в горючей смеси;
E0 - энергия активации реакции;
R - универсальная газовая постоянная;
Т – температура.
Если на графике, характеризующем закон распределения энергии по атомам и молекулам в гомогенной смеси (рис.14.2), на шкале абсцисс отметить значение» равное энергии активации Е0, то правая "хвостовая" часть кривой будет характеризовать долю реакционноспособных частиц в смеси при заданной температуре Т1. Если температуру смеси увеличить до значения Т2, то соответственно возрастет по экспоненте доля активных молекул и» следовательно, скорость реакции.
Например, в горючей смеси с энергией активации Е0 = 83800 МДж/моль при Т1 = 300 К доля молекул, обладающих энергией не меньшей Е0, составляет
![]() ,
,
а при Т2 = 1000 К
![]() .
.
Следовательно
при повышении температуры от 300 до 1000 К
число активных молекул увеличивается
в е-10
: е-33,3
= 1,65
1010 раза,
тогда как число столкновений при этом
увеличивается лишь в
![]() 1,83 раза, а общая энергия газа - всего
лишь в 3,3 раза.
1,83 раза, а общая энергия газа - всего
лишь в 3,3 раза.
Так как каждый элементарный акт экзотермической химической реакции сопровождается выделением тепла, то скорость тепловыделения в реагирующем объеме V горючей смеси с учетом (14.1.) составит
![]() ,
(14.2)
,
(14.2)
где q - тепловой эффект реакции.
Выделившееся тепло q1 расходуется на нагрев смеси и на потери в окружающую среду. Скорость теплопотерь может быть определена следующим образом
![]() ,
(14.3)
,
(14.3)
где
![]() - коэффициент теплоотдачи;
- коэффициент теплоотдачи;
S - площадь поверхности теплообмена.
Графики функций, представленных выражениями (14.2) и (14.3), показаны на рис. 14.3 и 14.4. Пусть, например, задана горючая смесь, скорость тепловыделения в которой с ростом температуры характеризуется кривой q1 (рис.14.3). Скорость теплопотерь в зависимости от конкретных условий опыта (например, материала стенок сосуда) может изменяться (семейство прямых q2).
Превышение скорости тепло выделения над теплопотерями, соответствующее самовоспламенению горючей смеси, будет происходить, если
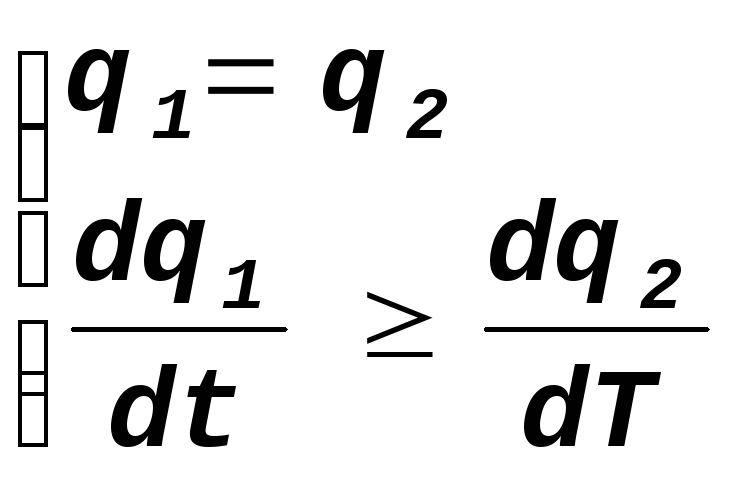 (14.4)
(14.4)
Аналогичный результат получим, рассматривая поведение различных горючих смесей (семейство кривых q1) при постоянных условиях теплоотдачи q2 (риc. 14.4).
Как видно из определения, для возникновения самовоспламенения горючая смесь нуждается в предварительном разогреве до температуры, не меньшей Тсв. Отсюда же следует, что только такой источник зажигания способен воспламенить горючую смесь, температура которого, по крайней мере, не ниже температуры самовоспламенения, а запас тепла достаточен для нагрева локального объема горючей смеси до этой температуры.
Однако, существуют химические реакции, которые не нуждаются для своего развития в предварительном разогреве» При протекании таких реакций исходные вещества превращаются в конечный продукт посредством образования очень активных промежуточных продуктов - атомов и радикалов, легко вступающих в дальнейшие соединения* В результате этих соединений образуется не только конечный продукт, но и некоторое число новых активных частиц, которые вновь вступают в соединения» Такие реакции называют цепными*
Реальные процессы горения имеют, как правило, одновременно признаки теплового и цепного механизма протекания реакции* Зарождение активных центров может иметь тепловой характер, а реагирование возникших активных частиц по цепному механизму приводит к выделению тепла, разогреву горючей смеси и термическому зарождению новых центров.
