
Комплексные соединения
.docЛАБОРАТОРНАЯ РАБОТА 11
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексным называется соединение, в узлах кристаллической решетки которого находятся комплексные ионы, способные к самостоятельному существованию в растворах. Например, K2[HgI4], [Cu(NH3)4]Cl2.
Такие сложные вещества образуются в результате соединения нейтральных молекул без возникновения новых электронных пар:
HgI2 + 2KI = HgI2∙2KI = K2[HgI4],
CuCl2 + 4NH3 = CuCl2∙4NH3 = [Cu(NH3)4]Cl2
Согласно координационной теории Вернера один атом в комплексном ионе (обычно положительно заряженный) выполняет роль центрального атома (комплексообразователя). Вокруг него координируется некоторое число анионов или нейтральных молекул – лигандов, которые вместе с центральным атомом образуют внутреннюю сферу комплексного соединения или комплексный ион. В формулах комплексный ион (координационная сфера) выделяется квадратными скобками. Остальные ионы образуют внешнюю сферу комплексного соединения. Так, в K2[HgI4] Hg2+ - комплексообразователь; ионы I- - лиганды; ионы K+ - внешняя сфера.
Некоторые комплексные соединения не имеют внешней сферы, например: [Pt(NH3)2Cl4], [Co(NH3)3(NO2)3].
Комплексный ион может содержать одновременно разнородные лиганды. В комплексе [Co(NH3)3(H2O)2Cl]2+ лигандами являются молекулы NH3, H2O и ион Cl- .
Число лигандов, окружающих комплексообразователь, называется координационным числом (к.ч.) этого комплексообразователя, например:
в [Ag(NH3)2]Cl к.ч. Ag+ равно 2;
в K2[HgI4] к.ч. Hg+ равно 4;
в [Co(NH3)3(H2O)2Cl]Cl2 к.ч. Co3+ равно 6.
Часто, но не всегда координационное число равно удвоенному заряду комплексообразователя. Координационное число для многих комплексообразователей не является постоянным.
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. Так, в состав иона [Fe(CN)6]x входят комплексообразователь Fe2+ и лиганды – ионы CN-; поэтому x = +2+6(-1) = -4. В ион [Co(NH3)4Cl2]x входят комплексообразователь Co3+ и лиганды – молекулы NH3 (они заряда не имеют) и ионы Cl-, поэтому x=+3+4(0)+2(-1)= +1.
Большинство комплексных соединений являются электролитами и в растворах диссоциируют на комплексные ионы и ионы внешней сферы (первичная диссоциация):
[Cu(NH3)4]Сl2 ↔ [Cu(NH3)4]2+ +2Cl-
K2[Cu(CN)4] ↔ 2K+ + [Cu(CN)4]2-
Комплексные ионы в растворе в той или иной степени обратимо диссоциируют на комплексообразователь и лиганды (вторичная диссоциация):
[Cu(NH3)4]2+ ↔ Cu2+ + 4NH3,
[Cu(CN)4]2- ↔ Cu2+ + 4CN-
Константы равновесия процессов вторичной диссоциации называются константами нестойкости Кн комплексного иона:
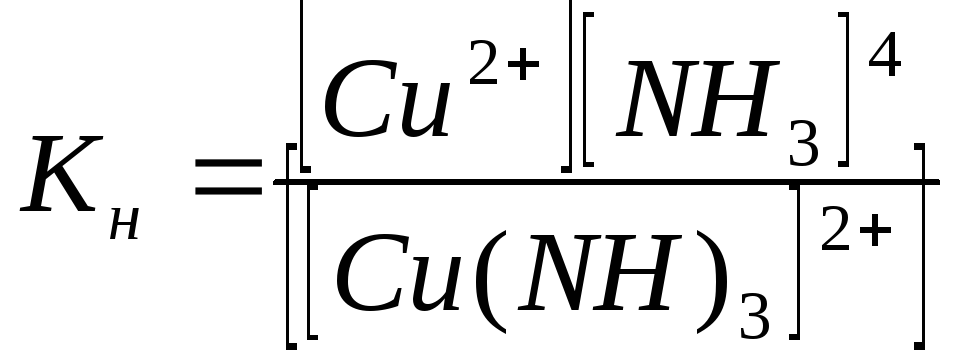
= 2,14∙10-13

= 5,0∙10-28
Величина Кн определяет прочность комплексного иона: чем она меньше, тем более устойчив комплексный ион. Из приведенных данных видно, что комплексный ион [Cu(CN)4]2- значительно прочнее иона [Cu(NH3)4]2+.
Усилить диссоциацию комплексного иона и даже разрушить его можно нагреванием, разбавлением, добавлением веществ, которые с одним из компонентов комплексного иона образуют еще менее диссоциирующие молекулы и ионы. Например, комплексный ион [Ag(NH3)2]+ (Кн=6,8∙10-8) можно разрушить добавлением ионов Ni2+, так как ион Ni2+ образует с молекулами аммиака более прочный комплексный ион [Ni(NH3)6]2+ (Кн=2,0∙10-9):
3[Ag(NH3)2]+ + Ni2+ = [Ni(NH3)6]2+ + 3Ag+
Добавление сильной кислоты к комплексным ионам, содержащим молекулы NH3, приводит к их разрушению. Ионы водорода кислоты с молекулами NH3 образуют более прочные ионы NH4+ :
[Cu(NH3)4]2+ + 4H+ = 4NH4+ + Cu2+
Комплексные соединения, которые в водных растворах почти полностью распадаются на простые ионы и молекулы, называются двойными солями. Так, двойная соль KFe(SO4)2 диссоциируют по уравнению:
KFe(SO4)2=K+ + Fe3+ + 2SO42-
и все ионы, образовавшиеся в растворе, можно обнаружить соответствующими реакциями. Формулы двойных солей записывают без квадратных скобок: NaAl(SO4)2, KMgCl3.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Цель работы – ознакомиться с основными способами получения и некоторыми химическими свойствами комплексных соединений.
Оборудование и материалы: штатив с пробирками.
Реактивы: магний порошок, лакмусовая бумажка, универсальная индикаторная бумага, фильтровальная бумага; растворы: сульфата алюминия, гидрооксида натрия (1-2 н., конц.), сульфата меди, гидроксида аммония конц., железо-аммонийных квасцов NH4Fe(SO4)2, роданида аммония NH4NCS, хлорида бария,хлорида натрия, нитрата серебра, азотной кислоты (1-2 н.), сульфата никеля.
Ход работы
Опыт 1. Получение соединений с комплексным анионом (комплексного соединения алюминия)
В пробирку с 5 каплями раствора Al2(SO4)3 приливать по каплям раствор едкого натра (NaOH). Образующийся осадок Al(OH)3 растворить, прибавляя к осадку избыток щелочи. Составить молекулярные и ионные уравнения реакций образования гидроксида алюминия и тетрагидроксоалюмината натрия. Написать выражение для константы нестойкости комплексного иона.
Опыт 2. Получение соединений с комплексным катионом (аммиаката меди)
К концентрированному раствору сульфата меди CuSO4 (достаточно 5 капель) приливать концентрированный раствор аммиака сначала до образования голубого осадка гидроксосульфата меди, потом до полного его растворения (образования раствора синего цвета). Написать молекулярные и ионные уравнения реакций, соответствующих превращениям:
CuSO4 → (CuОН)2SO4 → [Cu(NH3)4]SO4 + [Cu(NH3)4](ОН)2
Написать выражение для константы нестойкости комплексного иона.
Опыт 3. Отличие двойных солей от комплексных соединений
-
Налить в три пробирки по 5 капель раствора железо-аммонийных квасцов NH4Fe(SO4)2. В одну из них добавить несколько капель роданида аммония NH4NCS; в другую прилить немного раствора BaCl2; в третью добавить концентрированный раствор едкого натра NaOH и слегка подогреть. Наблюдать появление красной окраски в первой пробирке, образование белого осадка во второй и выделение аммиака с характерным запахом в третьей (аммиак также обнаруживается по изменению окраски влажной индикаторной бумажки, поднесенной к отверстию пробирки).
Написать ионные уравнения проведенных реакций. Сделать вывод, какой солью являются квасцы (двойной или комплексной). Составить уравнение электролитической диссоциации железо-аммонийных квасцов.
2. В пробирку с 5 каплями гексацианоферрата (III) калия K3[Fe(CN)6] прибавить несколько капель роданида аммония NH4NCS. Почему не появляется красное окрашивание? Составить уравнение электролитической диссоциации гексацианоферрата (III) калия.
Опыт 4. Разрушение комплексного иона. Образование нового, более прочного комплексного иона
Для получения раствора диамминсеребра [Ag(NH3)2]Cl налить в пробирку с раствором NaCl (1-2 см3) приблизительно 1 см3 раствора AgNO3. Выпавший осадок хлорида серебра растворить в избытке раствора аммиака.
Полученный раствор соли [Ag(NH3)2]Cl разлить в две пробирки. В одну из них прибавить раствор азотной кислоты. Объяснить образование осадка, написать молекулярные и ионные уравнения реакций образования и разрушения комплексного иона.
В другую пробирку добавить раствор NiSO4, снова выпадает белый осадок AgCl. Составить в молекулярной и ионной форме уравнение реакции, имея в виду, что помимо осадка хлорида серебра образуется сульфат гексаамминникеля (II).
Написать выражения констант нестойкости комплексных ионов [Ag(NH3)2]+ и [Ni(NH3)6]2+.
