
- •8. 2. Нуклеозиды.
- •3. Нуклеотиды
- •Все тРнк имеют общие черты как в их первичной структуре, так и в способе складывания полинуклеотидной цепи во вторичную структуру за счет взаимодействий между основаниями нуклеотидных остатков.
- •Функция состоит в переносе аминокислот в рибосомы , к месту синтеза белка.
- •Витамины и ферменты
- •Применение[
- •Гликолиз
- •Окислительное декарбоксилирование пирувата
- •Β-окисление жирных кислот
- •Цикл трикарбоновых кислот
- •Окислительное фосфорилирование[
- •Анаэробное дыхание
- •Общее уравнение дыхания, баланс атф[
- •Энергетический эффект цикла Кребса
Основными частями и структурными компонентами белковой молекулы являются аминокислоты. В состав пищевых продуктов входит 20 аминокислот, из них 8 не синтезируются в организме человека и являются незаменимыми факторами питания. К ним относятся: валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин, лизин. Для детей незаменимой аминокислотой является гистидин. Остальные аминокислоты являются заменимыми, т. е. могут синтезироваться в организме (аланин, аспарагиновая кислота, гликол, глицин, глютаминовая кислота, пролин, серии, тирозин, цистин, цистеин). Потребность в заменимых аминокислотах удовлетворяется в основном за счет синтеза в организме и частично за счет поступления их в составе пищи. Основным критерием в определении биологической ценности и физиологической роли аминокислот является их способность поддерживать рост и синтез белка. Особое значение в этом отношении имеют незаменимые аминокислоты. Исключение из пищевого рациона хотя бы одной из них влечет за собой задержку роста, снижение массы тела и т. д. Значение незаменимых аминокислот не ограничивается их участием в синтезе тканевых белков. Каждая из них, помимо этого, выполняет в организме важные и сложные функции. Лизин относится к наиболее важным незаменимым аминокислотам, он является ростовым фактором. Недостаток его в пище приводит к нарушению процессов кроветворения, снижению количества эритроцитов и содержания в них гемоглобина. Нарушается азотистое равновесие. В зерновых продуктах отмечается недостаточное его содержание. Источники: творог, мясо, рыба. Триптофан является ростовой аминокислотой, связан также с обменом никотиновой кислоты (витамин РР), необходим для ее синтеза в организме. Источники: мясо, рыба, творог, яйца. Метионин является основным поставщиком метильных групп, которые используются для синтеза холина. Метионин является липотропным веществом (предотвращающим жировое перерождение печени), оказывает влияние на обмен жиров и фосфатидов печени, нормализуя ее состояние. Метионин используется в лечебно-профилактическом питании для лиц, работающих с ионизирующими излучениями и с некоторыми промышленными ядами. Источники: творог, белок яйца, треска, судак, баранина, сельдь. Изолейцин — отсутствие его в пище приводит к нарушению азотистого баланса, который означает количественную разницу между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена. Лейцин — недостаток приводит к задержке роста, снижению массы тела, нарушениям в почках и щитовидной железе. Особое значение имеет не только поступление с пищей достаточных количеств каждой из аминокислот, но и их правильное соотношение, приближающееся к соотношению незаменимых аминокислот в белках человеческого тела. Оптимальным соотношением основных незаменимых аминокислот — триптофана, лизина, метионина + цистина — является 1:3:3. При нарушении сбалансированности аминокислотного состава рациона синтез полноценных белков нарушается, что ведет к возникновению в организме патологических изменений. Аминокислотный состав разных белков неодинаков и является важнейшей характеристикой каждого белка, а также критерием его ценности в питании. Формула сбалансированности незаменимых аминокислот (г/сутки) для взрослого человека следующая: триптофан — 1, лейцин — 4—6, изолейцин — 3—4, валин — 3—4, треонин — 2—3, лизин — 3—5, метионин — 2—4, фенилаланин — 2—4.
Как уже отмечалось, аминокислоты являются строительными блоками белков. Каким же образом они связаны в молекуле белка? Представление о наличии в молекуле белка определенных типов связей между аминокислотами дало изучение биуретовой реакции. При добавлении слабых растворов сернокислой меди к биурету NH2-CO-NH-CO-NH2 появляется фиолетовое или красно-фиолетовое окрашивание, обусловленное образованием комплексных соединений меди с биуретом. Биуретовую реакцию дают все без исключения белки. На основании изучения этой реакции в 1888 г. А.Я. Данилевский высказал предположение, что пептидная (кислотно-амидная) группа
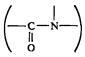 является
основной связью в полипептидном каркасе
белковой молекулы.
Полипептидную
теорию строения белка разработал и
экспериментально обосновал Э. Фишер.
Аминокислотный анализ белков позволил
ему установить, что белки состоят только
из аминокислот (эфирный метод). После
этого он пришел к решению ключевого
вопроса о характере связей отдельных
аминокислот в молекуле белка. Вместо
применявшегося ранее исключительно
аналитического метода исследования
он использовал метод синтеза. Прежде
всего он разработал химический метод
активации аминокислот по карбоксильной
группе, получив хлорангидриды аминокислот.
Последние легко вступали в реакцию с
другими аминокислотами:
является
основной связью в полипептидном каркасе
белковой молекулы.
Полипептидную
теорию строения белка разработал и
экспериментально обосновал Э. Фишер.
Аминокислотный анализ белков позволил
ему установить, что белки состоят только
из аминокислот (эфирный метод). После
этого он пришел к решению ключевого
вопроса о характере связей отдельных
аминокислот в молекуле белка. Вместо
применявшегося ранее исключительно
аналитического метода исследования
он использовал метод синтеза. Прежде
всего он разработал химический метод
активации аминокислот по карбоксильной
группе, получив хлорангидриды аминокислот.
Последние легко вступали в реакцию с
другими аминокислотами:
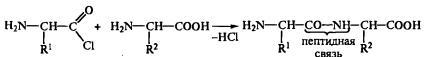 Между
двумя аминокислотами возникла пептидная
связь, а само соединение получило
название дипептид. Полученный хлор-ангидрид
дипептида вновь мог вступать в реакцию
с новой аминокислотой и давать трипептид:
Между
двумя аминокислотами возникла пептидная
связь, а само соединение получило
название дипептид. Полученный хлор-ангидрид
дипептида вновь мог вступать в реакцию
с новой аминокислотой и давать трипептид:
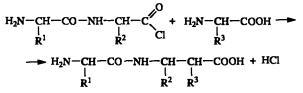
Таким методом синтеза Э. Фишеру удалось получить полипептид, состоящий из 19 аминокислот. Ныне разработаны более изящные методы синтеза полипептидов. Однако в принципе они аналогичны методу Э. Фишера. Заслуживает восхищения интуиция этого ученого. Именно такой путь активации аминокислот имеет место в живой клетке. Итак, белки представляют собой полимеры, построенные из α-аминокислот, общую формулу которых можно записать как NH3+CHRCOO- (в водном растворе при значениях pH, близких к нейтральным). Остатки аминокислот в белках соединены между собой амидными связями между α-амино- и α-карбоксильной группами. Общая структура одной полимерной цепи белковой молекулы может быть представлена в виде

Граница между полипептидами и белками проведена условно. К белкам относят полипептиды с молекулярной массой 6 тысяч и более и числом аминокислотных остатков свыше 50. Такой принцип деления основан на способности к диализу через природные мембраны.
Белковая молекула может состять из одной или нескольких полипептидных цепей. Цепи могут быть соединены между собой ковалентными или нековалентными связями. Белки, состоящие из двух или нескольких полипептидных цепей, не связанных между собой ковалентными связями, называют о л и г о м е р н ы м и. Отдельные полипептидные цепи в таких белках называют п р о т о м е р а м и; функционально активные части белка - с у б ъ е д и н и ц а м и.
Структура белковой молекулы — сложная пространственная структура, обладающая первичным, вторичным, третичным и четвертичным уровнями организации. Особенности структурной организации белковой молекулы определяются первичным уровнем ее организации. Первичная структура белковой молекулы — полипептидная цепь с линейной последовательностью аминокислот, связанных между собой за счет пептидной связи. Первичная структура белка наиболее прочная из всех. В отношении всех свойств, которыми будет обладать белковая молекула, эта структура является определяющей. Все остальные структурные уровни организации образуются в соответствии с особенностями строения первичного уровня по принципу самосборки. Внешние факторы не оказывают влияния на этот процесс. Вторичная структура белковой молекулы — структура белковой молекулы, образующаяся за счет скручивания линейной последовательности аминокислот первичной структуры с образованием спирали, многочисленные витки которой связаны между собой водородными связями. Третичная структура белковой молекулы — структура белковой молекулы, образующаяся за счет наложения одних частей спирали белковой молекулы на другие, формирования между этими частями различного рода связей: водородных ковалентных ионных, дисульфидных (при наличии аминокислоты цистеин), гидрофобных. Третичная структура имеет вид глобулы. При третичном уровне организации белковой молекулы возможность принимать участие в химических реакциях, проявлять химическую активность остается только у тех аминокислотных остатков, которые имеют поверхностное расположение. Четвертичная структура белковой молекулы — структура белковой молекулы, представляющая собой сложную пространственную организацию нескольких полипептидных цепей, связанных между собой за счет различных химических связей. Эти связи аналогичны таковым в третичном уровне организации белковой молекулы. Полипептидные цепи, принимающие участие в образовании четвертичной структуры белковой молекулы, могут быть одинаковыми или иметь различное строение.
4. Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков). Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза. Белки обладают явно выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. С коллоидным состоянием белков связан ряд характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах микроскопии биологических объектов. Молекулы белка не способны проникать через полупроницаемые искусственные мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей, хотя при органических поражениях, например, почек капсула почечного клубочка (Шумлянского-Боумена) становится проницаемой для альбуминов сыворотки крови и последние появляются в моче.
|
Функция |
Примеры и пояснения |
|
Строительная |
Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
|
Транспортная |
Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
|
Регуляторная |
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
|
Защитная |
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
|
Двигательная |
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
|
Сигнальная |
В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
|
Запасающая |
В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
|
Энергетическая |
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
|
Каталитическая |
Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
5.
ПЕПТИДЫ, природные или синтетич. соед., молекулы к-рых построены из остатков a-аминокислот, соединенных между собой пептидными (амидными) связями C(O) NH. Могут содержать в молекуле также неаминокислотную компоненту (напр., остаток углевода). По числу аминокислотных остатков, входящих в молекулы пептидов, различают ди-пептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, наз. олигопептидами, содержащие более 10 аминокислотных остатков полипепти-дами Прир полипептиды с мол. м. более 6 тыс. наз. белками Классификация пептидов. Все пептиды делятся на гомомерные и гетеро-мерные. Гомомерные пептиды при гидролизе образуют только аминокислоты, гетеромерные наряду с аминокислотами соед. др. классов. В зависимости от структуры неаминокислотной компоненты, гетеромерные пептиды делятся на глико-, липо-, нуклео-, фосфопептиды и др. Гомомерные и гетеромерные пептиды могут быть линейными и циклическими. Роль:Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и карбоксипептидаз. Распад коротких пептидов завершается ди- и трипептидами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений.
Вкусовые пептиды Наиболее важными соединениями этой группы являются сладкие и горькие пептиды. В производстве мороженого, кремов в качестве подсластителей или усилителей вкуса используется аспартам. Пептиды горького вкуса образуются при распаде белков в сырах и молоке при участии протеаз молочнокислых бактерий.
Пептиды – нейромедиаторы Нейромедиаторы – это химические соединения, регулирующие передачу нервных импульсов в нервной системе. К ним относятся, например, ацетилхолин, некоторые АК
Пептиды часто являются гормонами
Таблица 3.3 Важнейшие пептидные гормоны
|
Название гормона |
Место образования |
Химическая природа |
Биологическое действие |
|
Соматостатин |
Гипоталамус |
14 АК, лин. |
Регулятор роста |
|
Окситоцин |
Гипофиз |
9 АК, цикл |
Сокращение матки, выделение молока |
|
Вазопрессин |
Гипофиз |
9 АК, цикл |
Повышает давление крови |
|
Антиотезин-П |
Легкие |
Лин. октапептид |
Регулирует кровяное давление |
|
Инсулин |
Поджелудочная железа |
51 АК, 2 цепи полипептида |
Снижает уровень глюкозы в крови |
|
Глюкагон |
Поджелудочная железа |
29 АК, лин. |
Повышает уровень глюкозы в крови |
|
Гастрин |
Слизистая желудка |
17 АК, лин. |
Стимулирует секрецию HC1 |
|
Кальцитонин |
Щитовидная железа |
12 АК, цикл |
Снижает уровень CA++ |
6. Существует несколько классификаций белков. В основе их лежат разные принципы: по степени сложности (простые и сложные); по форме молекул (глобулярные и фибриллярные белки); по растворимости в отдельных растворителях (водорастворимые, растворимые в слабых солевых растворах — альбумины, спирторастворимые — проламины, растворимые в щелочах — глютелины), по выполняемым ими функциям, например запасные белки, скелетные и т. д.
Остановимся несколько подробнее на классификации по степени сложности. По этому принципу белки делят на протеины (простые белки), состоящие только из остатков аминокислот, и протеиды (сложные белки), состоящие из белковой (апобелок) и небелковой частей (простетическая группа).
Протеины — запасные, скелетные, отдельные ферментные белки. По растворимости в отдельных растворителях выделим только главные:
альбумины — белки с относительно небольшой молекулярной массой, хорошо растворимые в воде и в слабых солевых растворах; типичный представитель альбуминов — белок яйца — овальбумин;
глобулины — растворяются в водных растворах солей. Это очень распространенные белки, входят в состав мышечных волокон, крови, молока, они составляют большую часть семян бобовых и масличных культур. Представителем глобулинов животного происхождения является лактоглобулин молока;
проламины — растворяются в 60—80 %-ном растворе этилового, спирта. Это характерные белки семян злаков, например: глиадин — пшеницы и ржи, зеин — кукурузы, авенин — овса, гордеин — ячменя;
глютелины — растворяются только в растворах щелочей. Из них следует выделить оризенин из семян риса и глютенин клейковинных белков пшеницы.
Протеиды — из этой группы сложных белков отметим только следующие:
нуклеопротеиды — кроме белка включают нуклеиновые кислоты. Нуклеиновые кислоты относятся к важнейшим биополимерам, которым принадлежит огромная роль в наследственности;
липопротеиды — содержат кроме белка липиды. Содержатся в протоплазме и мембранах. Принимают участие в формировании клейковинных белков;
фосфопротеиды — кроме белка присутствует фосфорная кислота. Им принадлежит важная роль в питании молодого организма. Пример: казеин — белок молока.
7. НУКЛЕИНОВЫЕ КИСЛОТЫ – биологические полимерные молекулы, хранящие всю информацию об отдельном живом организме, определяющие его рост и развитие, а также наследственные признаки, передаваемые следующему поколению. Нуклеиновые кислоты есть ядрах клеток всех растительных и животных организмов, что определило их название (лат. nucleus – ядро).
В состав входят углерод (С), водород (Н), кислород (О), азот (N) и фосфор (Р). Нуклеиновые кислоты представляют собой линейные нерегулярные полимеры, состоящие из мономеров — нуклеотидов.
Состав полимерной цепи нуклеиновых кислот. Полимерная цепь нуклеиновых кислот собрана из фрагментов фосфорной кислоты Н3РО3 и фрагментов гетероциклических молекул, представляющих собой производные фурана (см. также ХИМИЯ ОРГАНИЧЕСКАЯ). Есть лишь два вида нуклеиновых кислот, каждая построена на основе одного из двух типов таких гетероциклов – рибозы или дезоксирибозы (рис. 1).
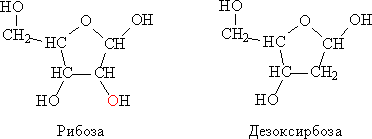
Рис. 1. СТРОЕНИЕ РИБОЗЫ И ДЕЗОКСИРИБОЗЫ.
Название рибоза (от лат. Rib – ребро, скрепка) имеет окончание – оза, что указывает на принадлежность к классу сахаров (например, глюкоза, фруктоза). У второго соединения нет группы ОН (окси-группа), которая в рибозе отмечена красным цветом. В связи с этим втрое соединение называют дезоксирибозой, т.е., рибоза, лишенная окси-группы.
Полимерная цепь, построенная из фрагментов рибозы и фосфорной кислоты, представляет собой основу одной из нуклеиновых кислот – рибонуклеиновой кислоты (РНК). Термин «кислота» в названии этого соединения употреблен потому, что одна из кислотных групп ОН фосфорной кислоты остается незамещенной, что придает всему соединению слабокислый характер. Если вместо рибозы в образовании полимерной цепи участвует дезоксирибоза, то образуется дезоксирибонуклеиновая кислота, для которой повсеместно принято широко известное сокращение ДНК.
8. 2. Нуклеозиды.
Нуклеозиды – это N-гликозиды, образованные нуклеиновыми основаниями и рибозой или дезоксирибозой.
Между аномерным атомом углерода моносахарида и атомом азота в положении 1 пиримидинового цикла или атомом азота в положении 9 пуринового цикла образуется -гликозидная связь.
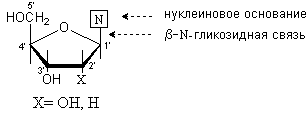
В зависимости от природы моносахаридного остатка нуклеозиды делят на рибонуклеозиды (содержат остаток рибозы) идезоксирибонуклеозиды (содержат остаток дезоксирибозы). Названия нуклеозидов строят на основе тривиальных названий нуклеиновых оснований, добавляя окончание –идин для производных пиримидина и -озин для производных пурина. К названиям дезоксирибонуклеозидов добавляют приставку дезокси-. Исключение составляет нуклеозид, образованный тимином и дезоксирибозой, к которому приставка дезокси- не добавляется, так как тимин образует нуклеозиды с рибозой лишь в очень редких случаях.

Для обозначения нуклеозидов используются однобуквенные обозначения, входящих в их состав нуклеиновых оснований. К обозначениям дезоксирибонуклеозидов ( за исключением тимидина) добавляется буква ”д”.
Наряду с представленными на схеме основными нуклеозидами в составе нуклеиновых кислот встречаются минорные нуклеозиды, содержащие модифицированные нуклеиновые основания (см. выше).
В природе нуклеозиды встречаются также в свободном состоянии, преимущественно в виде нуклеозидных антибиотиков, которые проявляют противоопухолевую активность. Нуклеозиды-антибиотики имеют некоторые отличия от обычных нуклеозидов в строении либо углеводной части, либо гетероциклического основания, что позволяет им выступать в качестве антиметаболитов, чем и объясняется их антибиотическая активность.
Как N-гликозиды, нуклеозиды устойчивы к действию щелочей, но расщепляются под действием кислот с образованием свободного моносахарида и нуклеинового основания. Пуриновые нуклеозиды гидролизуются значительно легче пиримидиновых.
3. Нуклеотиды
Нуклеотиды – это эфиры нуклеозидов и фосфорной кислоты (нуклеозидфосфаты). Сложноэфирную связь с фосфорной кислотой образует ОН группа в положении 5/ или 3/ моносахарида. В зависимости от природы моносахаридного остатка нуклеотиды делят на рибонуклеотиды (структурные элементы РНК) и дезоксирибонуклеотиды (структурные элементы ДНК). Названия нуклеотидов включают название нуклеозида с указанием положения в нем остатка фосфорной кислоты. Сокращенные обзначения нуклеозидов содержат обозначение нуклеозида, остатка моно-, ди- или трифосфорной кислоты, для 3/-производных указывается также положение фосфатной группы.

Нуклеотиды являются мономерными звеньями, из которых построены полимерные цепи нуклеиновых кислот. Некоторые нуклеотиды выполняют роль коферментов и участвуют в обмене веществ.
9. Дезоксирибонуклеи́новая кислота́ (ДНК) — макромолекула (одна из трёх основных, две другие — РНК и белки), обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
Первичная структура представляет собой линейную последовательность дезоксирибонуклеотидов в одной цепочке. В такой форме в природе ДНК не существует, но именно первичная структура (последовательность нуклеотидов) определяет все ее свойства. Вторичная структура – две полинуклеотидовые цепочки, каждая из которых закручена в спираль вправо и обе закручены вправо вокруг одной оси. Две цепочки удерживаются рядом за счет водородных связей между азотистыми основаниями разных цепочек. Азотистые основания, образующие пары по принципу Чаргаффа (а это всегда одно пуриновое и одно пиримидиновое) , называются комплементарными: А = Т; G = С. Адениновый и тимидиновый соединяются двумя водородными связями, а гуаниновый и цитозиновый – тремя.
Третичная структура ДНК и структуры более высокого порядка представляют собой дальнейшую спирализацию и суперспирализацию молекулы ДНК.
10.
Способность клеток поддерживать высокую упорядоченность своей организации зависит от генетической информации, которая сохраняется в форме дезоксирибонуклеиновой кислоты (ДНК). Раскрытие роли ДНК в передаче наследственных свойств представляется одним из основных достижений современной биологии. В 1944 г. О. Эвери доказал, что именно ДНК ответственна за изменение (трансформацию) организмов. Это было показано в экспериментах с двумя формами бактерий (пневмококков). Одна из них обладала способностью образовывать капсулу и вызывать заболевание. Вторая форма не образовывала капсулы и не вызывала заболевания. Оказалось, что после проникновения ДНК, выделенной из вирулентных (вызывающих заболевание) клеток, некоторое количество клеток невирулентной формы образовало капсулу, причем эта способность передавалась по наследству. ДНК—это полимер, мономерами которого являются дезоксирибонуклеотиды. В их состав входят углевод дезоксирибоза, фосфорная кислота и азотистые основания четырех типов: два пуриновых — аденин и гуанин и два пиримидиновых — тимин и цитозин. Приблизительные определения показывают, что молекулярная масса ДНК достигает величины 106—109.
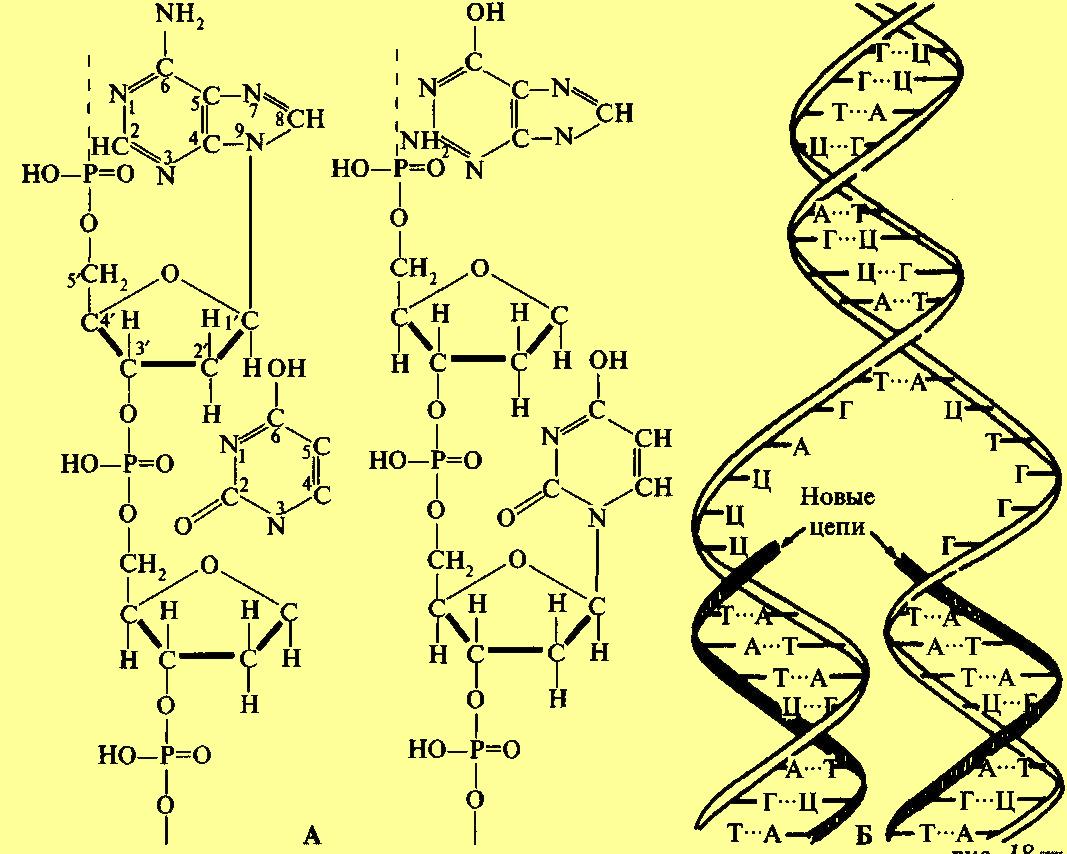
А - часть полинуклеотидной цепи молекулы ДНК;
Б - репликация ДНК (А - аденин, Г - гуанин, Ц - цитозин, Т- тимин)
Основные представления о структуре ДНК были сформулированы в 1953 г. Дж. Уотсоном и Ф. Криком. Молекула ДНК состоит из двух полинуклеотидных цепочек, скрепленных между собой водородными связями. Каркас полинуклеотидных цепочек, входящих в состав ДНК, представляет чередование дезоксирибозы и фосфорной кислоты. Азотистые основания, противостоящие друг другу в полинуклеотидных цепочках, парны: пуриновому основанию соответствует пиримидиновое, аденину — тимин, гуанину — цитозин. Таким образом, две полинуклеотидные цепочки, входящие в состав ДНК, соответственны, или комплементарны, друг другу, число пуриновых оснований равно числу пиримидиновых (правило Чаргаффа). У каждой цепочки молекулы ДНК имеются два конца: один конец заканчивается пятым, а другой — третьим углеродным атомом пентозы (они обозначаются 3' и 5' конец). Цепочки, составляющие молекулы ДНК, антипараллельны, поскольку составляющие их цепи имеют противоположную направленность. В одной цепочке нуклеотиды связаны в направлении 5' 3', а в другой — 3'5'. Полинуклеотидные цепочки имеют общую ось и образуют двойную спираль. Каждый виток спирали включает 10 пар азотистых оснований. Шаг спирали составляет 3,4 нм, ширина спирали — 2 нм, длина спирали — несколько десятков тысяч нанометров. Специфичность ДНК определяется последовательностью азотистых оснований в ее цепочке. Рассмотренная модель позволяет объяснить важнейшее свойство ДНК — способность к самовоспроизведению. Этот процесс называется репликацией или редупликацией. Опыты М. Мезелсона и Ф. Сталя (1958) показали, что самовоспроизведение ДНК происходит полуконсервативным способом. В этих опытах несколько поколений бактерий кишечной палочки (Escherichia coli) выращивали на среде, содержащей меченый азот (15N). Через несколько поколений ДНК, входящая в состав клеток бактерий, содержала этот изотоп. Включение 15N в ДНК повысило ее плотность (тяжелая ДНК). Клетки, содержащие тяжелую ДНК, помещали на среду, включающую 14N. После удвоения клеток, т. е. в первом поколении, вся выделенная ДНК оказалась полутяжелой (одна половина содержала 15N, а другая половина— 14N). На основании этого была создана схема воспроизведения ДНК, согласно которой в определенный момент жизни клетки цепочки ДНК расходится и на каждой материнской, как на матрице, из веществ клетки строится соответственная (комплементарная) дочерняя цепочка.
Образование полинуклеотидных цепочек ДНК происходит из трифосфонуклеотидов. Синтез ДНК идет от 5' к 3' концу и катализируется специальными ферментами. Главнейшие из них ДНК-полимеразы, которые последовательно наращивают цепь ДНК, присоединяя к ней дезоксирибонуклеотидные звенья в направлении 5' — к 3'. Именно ДНК-полимеразы на каждом шаге выбирают нужный мономер из четырех, тот, который комплиментарен мономеру материнской цепи ДНК. Однако для начала работы ДНК-полимераз необходима полинуклеотидная цепь рибонуклеиновой кислоты (РНК), называемая затравка. РНК-затравку синтезирует из рибонуклеотидтрифосфатов фермент ДНК-праймаза. В синтезе принимают участие и другие ферменты. ДНК-хеликазы разрывают цепи ДНК, что дает возможность ДНК-полимеразе осуществлять процесс синтеза. ДНК-топоизомеразы раскручивают цепи ДНК и молекулы дестабилизирующего белка, который не позволяет сомкнуться одиночным цепям ДНК. Фермент ДНК-лигаза осуществляет сшивку двух концов цепочки ДНК. Таким образом, в результате совместного действия многих белков осуществляется процесс репликации ДНК, лежащий в основе размножения и развития организма, передачи наследственных свойств. В ДНК заложена информация о структуре белков, свойственных каждому живому организму. Участок ДНК, содержащий всю информацию о программируемом белке, называют ген. Однако в настоящее время установлено, что информационное содержание ДНК значительно богаче. Кроме структурных генов, кодирующих первичную структуру белка, существуют регуляторные участки, которые не кодируют структуру биополимеров, но необходимы для реализации наследственной информации. ДНК содержит информацию и о структуре молекул РНК. Детальная расшифровка структуры ДНК открывает возможность для глубокого проникновения в суть эволюционного процесса. Степень родства организмов может быть установлена с большой точностью путем анализа фрагментов их нуклеиновых кислот. Эти исследования были начаты под руководством академика А.Н. Белозерского.
11.
Молекулы транспортной РНК (тРНК) играют ключевую роль в экспрессии генов, участвуя в переводе информации, содержащейся в матричных РНК в виде кодонов, на язык аминокислотных остатков белковых цепей.
