
Органическая химия / 4. НУКЛЕИНОВЫЕ_КИСЛОТЫ_И_АЛКАЛОИДЫ
.pdf
2.Группа хинолиновых алкалоидов (хинин)
Воснове этой группы алкалоидов лежит гетероциклическая система хинолин;
5 |
4 |
6 |
3 |
|
|
7 |
2 |
N
8 1
хинолин
3.Группа изохинолиновые, изохинолинфенантреновые алкалоиды
(папаверин, морфин, кодеин)
Воснове этой группы алкалоидов лежит гетероциклическая система изохинолин;
5 4
6 
 3
3
7 |
N 2 |
8 1
изохинолин
4.Группа пуриновых алкалоидов (кофеин, теобромин, теофилин)
Воснове этой группы алкалоидов лежит гетероциклическая система пурин;
6 |
|
|
7 |
|
||
|
|
|
5 |
H |
|
|
|
|
|
N |
|
||
1N |
|
|
|
|||
|
|
|
8 |
|||
|
|
|
||||
|
|
|
|
|
|
|
2 |
|
|
|
|
N |
|
|
N |
4 |
9 |
|||
|
|
|||||
|
|
|
|
|
||
3 |
|
|
|
|
||
пурин
11

5.Группа тропановых алкалоидов (атропин, кокаин)
Воснове этой группы алкалоидов лежит гетероциклическая система тропин;
7 |
1 |
|
|
2 |
|
|
|
||
|
|
|
|
|
|
N |
|
CH3 |
3 |
|
|
|||
6 |
|
|
|
4 |
5 |
|
|
||
|
|
|
||
|
|
|
|
тропин Для выделения алкалоидов используется очистка извлечений, основанная на
различной растворимости свободных оснований алкалоидов и их солей, очистка извлечений хроматографическими методами.
Поскольку все алкалоиды обладают различными физико-химическими свойствами, единой схемы разделений не существует. Описано большое количество методов и их модификаций, позволяющих разделить сумму алкалоидов на отдельные компоненты. Поэтому используется разделение суммы алкалоидов на основании их различной растворимости в органических растворителях, разделение суммы алкалоидов по различной силе основности,
разделение суммы алкалоидов хроматографическими методами (хроматография на колонке, бумажная хроматография).
Для обнаружения алкалоидов в растительном сырье чаще всего используют общие осадочные реакции и хроматографию. Кроме того, учитывают их растворимость в кислотах, образование осадков, рН раствора. С целью идентификации алкалоидов проводят специфические (цветные) реакции,
микрокристаллогические реакции, хроматографический, спектроскопический,
люминисцентный анализы и т.д.
В основе качественных реакций на алкалоиды лежит способность их образовывать нерастворимые и окрашенные продукты. Соответственно качественные общеалкалоидные реакции подразделяются на реакции осаждения и окрашивания. В данные реакции вступают алкалоиды всех групп, поэтому такие реакции называются общеалкалоидными.
Общеалкалоидные осадительные реакции - это реакции солеобразования с различными кислотами и тяжелыми металлами.
12
Общеалкалоидные осадительные реакции
|
Состав реактива |
Название реактива |
Аналитический эффект |
|||
|
|
|
|
|
|
|
1. |
Раствор |
йода в |
йодиде |
Вагнера, Люголя |
Осадок бурого цвета |
|
калия |
|
|
|
|
|
|
2. |
Раствор |
йодида |
ртути в |
Майера |
Осадок белого или слегка |
|
йодиде калия |
|
|
желтого цвета |
|
||
3. |
Раствор |
йодида |
висмута |
Драгендорфа |
Кристаллический |
осадок |
в йодиде калия |
|
|
оранжево-красного цвета |
|||
4. |
Фосфорномолибденовая |
Зонненштейна |
Аморфный осадок |
желтого |
||
кислота |
|
|
|
цвета, который изменяется в |
||
|
|
|
|
|
синий или зелѐный |
|
5. |
Фосфорновольфрамовая |
Шейблера |
Осадок белого цвета |
|
||
кислота |
|
|
|
|
|
|
6. Раствор танина |
|
— |
Осадок белого или |
желтого |
||
|
|
|
|
|
цвета |
|
7. |
Раствор пикриновой |
— |
Осадок желтого цвета |
|||
кислоты |
|
|
|
|
|
|
Реакции осаждения позволяют установить наличие алкалоидов даже при незначительном их содержании.
Общеалкалоидные реакции окрашивания основаны на реакциях следующего типа:
а) реакциях дегидратации (кодеин при нагревании с конц. Н2SO4 дает сине-
фиолетовое окрашивание),
б) реакциях окисления (морфин с конц. HNO3 образует оранжевое,
переходящее в желтое окрашивание),
в) реакциях конденсации (папаверин с раствором формалина в Н2SO4 дает винно-красное окрашивание, затем желтое, переходящее в оранжевое окрашивание).
Хроматографический анализ (хроматография на бумаге и в тонком слое сорбента) является важнейшим аналитическим методом в фитохимическом анализе.
УФ-, ИК-, ЯМР-Н1, масс-спектры особенно широко используются при установлении структуры алкалоидов, так как, интерпретация спектров позволяет
13

установить наличие или отсутствие сопряжѐнных двойных связей и различных функциональных групп.
Кроме общеалкалоидных реакций окрашивания и осаждения, которые характерны для большинства алкалоидов, индивидуальные представители имеют специфические качественные реакции, такие реакции называются частными. Эти реакции зависят от химической структуры молекул алкалоидов и входящих в неѐ функциональные группы.
§1 Алкалоиды группы пиридина и пиперидина.
Группа пиридина и пиперидина объединяет достаточно большое количество алкалоидов. Наиболее простыми по строению являются:
* |
* |
|
N |
N |
|
|
|
|
CH3 |
|
H |
N |
N |
пиперидин |
|
||
пиридин N-метипирролидин |
|
|
пиридин |
|
|
Никотин |
Анабазин |
|
В основание алкалоидов никотина и анабазина лежат две гетероциклических системы: никотин состоит из пиридина связанного с N-метилпирролидином,
анабазин содержит гетероциклы пиридин и пиперидин.
Гетероциклы пирролидин и пиперидин являются насыщенными гетероциклами, поэтому гетероатомы азота этих гетероциклов близки по своей природе к атомам азота в алифатических аминах. Атомы азота алифатических аминов обладают более высокими основными свойствами, следовательно,
протонироваться в первую очередь будут они, а не атомы азота пиридинового ядра.
Этот факт отражается в реакциях с кислотами, например:
N |
+ HCl |
+ |
Cl |
+ HCl |
|
+ |
|
|
N |
|
|
N |
2Cl |
||
CH3 |
|
H |
CH3 |
|
+ |
H CH3 |
|
|
|
|
|
|
|||
N |
|
N |
|
|
N |
|
|
H
14

Взаимодействие с пикриновой кислотой приводит к образованию соответствующих пикратов, осадков желтого цвета (осадительные общеалкалоидные реакции).
|
OH |
|
|
O |
|
|
|
|
|
N + O2N |
NO2 |
+ |
O2N |
NO2 |
CH3 |
H |
N |
CH3 |
|
|
|
|
|
|
N |
N |
|
|
|
|
|
|
|
|
|
NO2 |
|
|
NO2 |
|
|
|
|
|
|
|
пикрат никотина |
|
|
Важна реакция окисления никотина до соответствующей никотиновой кислоты, которая является провитаминным веществом.
|
|
[O] |
COOH |
COOH |
|
N |
+ |
|
|
|
|
CH2 + NH2 CH3 |
||
|
CH3 |
|
||
N |
|
N |
COOH |
|
|
|
пиридинкарбоновая кислота (никотиновая кислота)
В молекулах никотина и анабазина имеется асимметрический атом углерода
(атом углерода, связанный с четырьмя различными заместителями, он отмечен звездочкой), следовательно, молекулы обладают оптической активностью.
§2 Алкалоиды группы хинолина.
Хинин относится к группе хинолиновых алкалоидов. Данный алкалоид был выделен из коры хинного дерева. В хинной коре содержание хинина колеблется от 2% до 15%. Препарат хинина гидрохлорид использовался как противомалярийное средство. В молекуле хинина содержатся две гетероциклических системы:
а) ароматический гетероцикл хинолин,
б) насыщенный гетероцикл – хинуклидин.
15
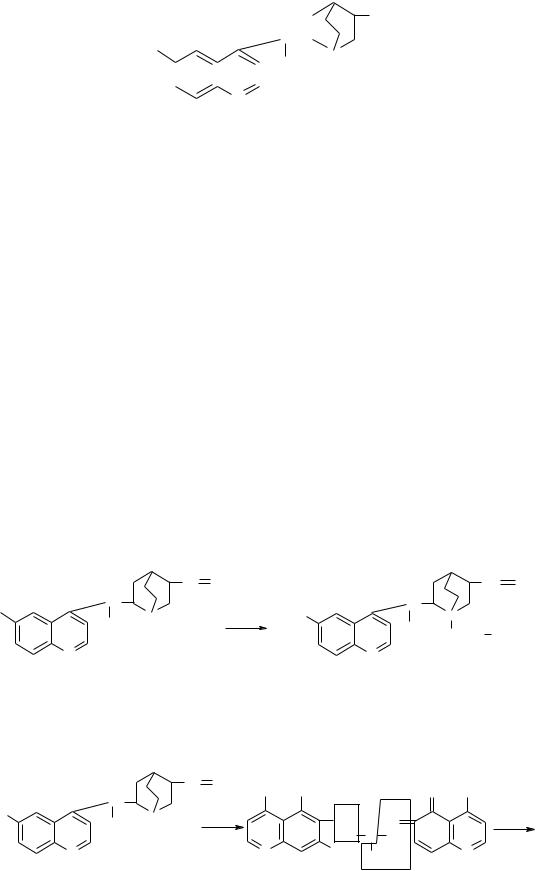
Следовательно, хинин является двухкислотным основанием.
Хинин
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
|
|
* |
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
CH |
|
* |
|
|
|
|
|
|
||
CH3 |
O |
OH |
N |
||||||||||||||
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
Хинуклидин |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Хинолин |
|
|
|
|
|
|
|
|
|
|
|||
Кроме двух гетероциклических систем структура хинина содержит |
|||||||||||||||||
следующие функциональные группы: |
|
|
|
|
|
|
|
|
|
|
|||||||
1.метоксильную группу в положении 6 гетероцикла хинолина
2.вторичный спиртовый гидроксил,
3.двойную связь в боковой цепи ядра хинуклидина
Химические свойства хинина складываются из свойств перечисленных функциональных групп и гетероциклических систем.
Наличие двух гетероатомов азота определяет основные свойства молекулы.
Атом азота хинуклидинового ядра имеет природу третичного азота, поэтому обладает более высокими основными свойствами, чем гетероциклический азот хинолинового ядра. Взаимодействие с эквимолярным количеством хлороводородной кислоты приводит к протонированию атома азота хинуклидинового ядра.
|
|
CH CH2 |
|
|
|
|
CH CH2 |
|
CH3O |
CH |
N |
|
|
CH O |
CH |
+ |
|
OH |
+HCl |
|
OH |
N |
|
|||
|
|
|
3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
Cl |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
В фармации в качестве частной реакции на хинин используется |
||||||||
таллейохинная проба. |
|
|
|
|
|
|
|
|
|
|
CH |
CH2 |
R |
OH |
O |
|
R |
|
|
|
|
|
||||
CH3O |
CH |
N |
|
|
|
|
|
|
OH |
Br2 |
|
OH |
O |
|
|
||
|
|
|
|
|
H |
N H |
|
|
N |
|
|
|
N |
OH |
H |
|
N |
|
|
|
|
|
|
|
|
|
16

R |
OH |
O R |
|
N |
|
N |
OH |
N |
Реакцию проводят взаимодействием с бромной водой, которая окисляет хинолиновый фрагмент. Далее добавляют аммиак, что приводит к образованию таллейохина. Аналитическим эффектом реакции является окрашивание раствора в изумрудно-зеленый цвет.
Молекула хинина хиральна вследствие нахождения в ней четырех асимметрических атомов углерода, следовательно, хинин обладает оптической активностью.
§3 Алкалоиды группы изохинолина, изохинолинфенантрена.
К группе изохинолиновых алкалоидов относится папаверин, который является производным бензилизохинолина. Впервые папаверин был выделен из опия, в настоящее время для медицинских целей его получают синтетическим путѐм. Как и все алкалоиды, он проявляет основные свойства, что используется для получения лекарственного препарата папаверина гидрохлорида.
H3C |
|
O |
|
|
H C |
|
O |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H3C |
|
O |
|
HCl |
|
H3C |
|
O |
|
NH |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
CH |
2 |
|
|
|
|
|
|
Cl- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
O |
|
CH |
3 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CH3 |
|
|
|
|
|
|
|
O |
|
CH |
3 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Папаверин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
(6,7-диметокси-1-(3',4'-диметоксибензил)-изохинолин) |
|
Папаверина гидрохлорид |
|
|
||||||||||||||||||||||||
Папаверин содержит |
четыре метоксильной группы, |
|
поэтому при |
|||||||||||||||||||||||||
взаимодействии его с йодоводородной кислотой образуется четыре моля
йодистого метила.
17

CH3O |
|
HO |
|
N |
|
N |
|
CH3O |
|
HO |
|
CH2 |
+ 4HI |
CH2 |
|
- 4CH3I |
|||
|
|
||
|
OCH3 |
OH |
|
OCH |
|
OH |
|
3 |
|
||
|
|
Папаверин при сплавлении со щелочью образует два продукта:
CH3O |
|
|
|
|
|
|
N |
|
|
CH3 |
|
CH3O |
|
|
|
|
|
|
|
CH O |
|
|
|
|
|
NaOH(сплав) |
3 |
|
|
|
CH2 |
N |
+ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
CH3O |
OCH |
3 |
|
|
|
|
|
|
|
|
OCH3 |
|
OCH3 |
|
|
|
|
|
|
|
|
OCH3 |
|
|
|
|
Полученные 6,7-диметоксиизохинолин и 3,4-диметокситолуол свидетельствует о строение молекулы папаверина.
Морфин и кодеин относятся к производным фенантренизохинолина.
HO |
|
H3C |
O |
|
|
|
|
||
O |
* |
* N CH3 |
O |
|
|
|
|||
* |
N CH |
3 |
||
|
|
|
|
|
HO * |
|
|
HO |
|
|
|
|
|
|
морфин |
|
кодеин |
|
|
|
|
|
|
|
Молекула морфина отличается от молекулы кодеина функциональной группой в ароматическом ядре, метилирование фенольного гидроксила морфина приводит к кодеину.
18

HO |
H3C |
O |
|
|
|
O |
CH I; NaOH |
O |
3 |
|
|
N |
-Na I |
N CH3 |
CH3 |
|
|
HO |
|
HO |
|
|
Наличие фенольного гидроксила придаѐт морфину свойства фенолов, что
используется в фарманализе:
1)с FeCl3,
2)в реакции азосочетания
Образование кислотного азокрасителя.
|
|
N N |
SO3H |
HO |
|
HO |
|
|
N N+ |
SO H Cl- |
|
|
|
3 |
|
O |
|
O |
|
N CH3 |
-HCl |
N |
CH3 |
HO |
|
HO |
|
В фармацевтическом анализе применяется реакция отличия морфина и кодеина, взаимодействием с раствором FeCl3. Морфин окрашивает раствор в сине-
фиолетовый цвет, так как содержит фенольный гидроксил и может образовывать комплексные соединения.
Оба алкалоида вступают в реакции солеобразования по гетероатомам азота и обесцвечивают бромную воду, что говорит о наличии двойной связи.
Полное ацилирование морфина приводит к образованию героина
19

|
|
O |
|
|
H3C |
C |
|
HO |
|
O |
|
|
|
||
|
O |
|
|
|
2 H3C C |
O |
|
O |
Cl |
||
|
|
||
|
N CH3 2HCl |
N CH3 |
|
|
|
||
HO |
|
O |
|
H3C |
C |
||
|
|||
|
|
O |
В молекулах морфина и кодеина имеются четыре асимметрических атома углерода.
§4 Алкалоиды группы пурина.
Алкалоиды группы пурина, важнейшими из которых являются теофиллин,
теобромин и кофеин, широко распространены в природе. Они содержатся в различных видах чая, кофе и бобах какао.
В основе этой группы алкалоидов лежит карбонильное производное пурина, которое называется ксантин. Для ксантина вследствие наличия гидроксильных групп, характерна кето-енольная таутомерия.
Ксантин
2,6-дигидроксипурин
|
|
OH |
|
O |
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
N |
|
|
|
N |
|
HN |
N |
|
|
|
|
|||
|
|
|
|
||
|
|
|
|
|
|
HO |
|
N |
N |
O N |
N |
|
|
||||
|
|
|
|
H |
|
енольная форма |
кетонная форма |
||||
В медицине ксантин не применяется, но его метилированные производные являются лекарственными веществами. Фармакологическое действие пуриновых алкалоидов заключается в стимуляции ЦНС и сердца. Кофеин используется в медицине, как тонизирующее средство. Теобромин и теофиллин входят в различные антигипертонические и антиастматические препараты.
20
