
- •1) Ковалентные связи
- •1.1 Ковалентные пептидные связи
- •1.2 Ковалентные связи -s-s-.
- •2.1 Водородные связи внутри полипептидной цепи.
- •2.3 Водородные связи между боковой группой и полипептидной цепью.
- •4) Электростатические взаимодействия между ионными центрами боковых групп.
- •4) Ван- дер- ваальсовы силы
- •1. Электрохимические свойства белков
- •2. Гидрофильность белков
- •3. Осаждение белков
- •4. Денатурация белков
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ
Последовательность аминокислот, ковалентно связанных между собой в полипептиде, представляет собой первичную структуру белка.
В 1888 г. А. Я. Данилевским высказано предположение, что пептидная (кислотно-амидная) группа
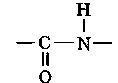
является основной связью в полипептидном каркасе белковой молекулы.
Полипептидную теорию строения белка разработал и экспериментально обосновал Э. Фишер. Работами, проведенными им в 1902— 1919 гг. (Нобелевская премия 1921 г.), доказано, что основным типом связи в молекуле белка является пептидная связь.
Название пептидов складывается из названия аминокислот, входящих в состав пептида. Причем те аминокислоты, которые реагируют активированной карбоксильной группой, меняют окончание в своем названии на "ил"; так, дипептид, состоящий из глицина и аланина, называется глицил-аланин; трипептид, содержащий глицин, аланин, лизин, называется глицил-аланил-лизин. Концевая аминокислота, в которой карбоксильная группа остается незатронутой в пептидах, не меняет своего названия.
Аминокислотный остаток, находящийся на том конце цепи, где имеется свободная аминогруппа, называется аминоконцевым, или N-концевым, остатком, а остаток на другом конце, несущем свободную карбоксильную группу, — карбоксиконцевым, или С-концевым, остатком. Название пептида складывается из названия аминокислот, начиная с N -концевого остатка.
Полипептидная теория удачно объясняла многие физико-химические и биологические свойства белков. Она четко ответила на вопрос, почему в природе существует огромное количество белков с их самыми разнообразными физико-химическими свойствами и биологическими функциями. Возьмем, к примеру, две аминокислоты: глицин и аланин; из них можно получить дипептид глицил-аланин:
![]()
а также другой дипептид аланил-глицин:
![]()
С![]() ледует
особо подчеркнуть, что данные изомеры
имеютразличные
физико-химические свойства, обусловленные
последовательностью
аминокислот.
Из трех аминокислот (глицина, аланина,
лизина) можно получить в результате
различных сочетаний аминокислот в их
последовательности следующие
трипептиды:
ледует
особо подчеркнуть, что данные изомеры
имеютразличные
физико-химические свойства, обусловленные
последовательностью
аминокислот.
Из трех аминокислот (глицина, аланина,
лизина) можно получить в результате
различных сочетаний аминокислот в их
последовательности следующие
трипептиды:
Как видно, различные сочетания трех аминокислот (1 2 3 = 6) дают уже 6 трипептидов, имеющих также различные физико-химические свойства.
Учитывая, что в химическом строении белков принимают участие 20 типов аминокислот, легко определить, сколько изомеров с различными свойствами может из них образовываться. Из 20 аминокислот можно получить астрономическое число изомеров, равное примерно 2,4·1018, и все они имеют различные физико-химические свойства. Но ведь полипептид, состоящий из 20 аминокислот, является коротким, с молекулярной массой около 2600. Однако сочетание из 20 аминокислот не является предельным. При синтезе белка многие из них в молекуле могут многократно повторять ся. В связи с этим возрастает и число полипептидных изомеров, которое может возникнуть в результате различных сочетаний всех (в том числе и многократно повторяющихся) аминокислот. Если взять, например, белок с молекулярной массой 34000, в котором 12 различных аминокислот представлены в различных соотношениях, то получится 10300 различных изомеров. Если теперь допустить, что белок построен из 20 различных аминокислот в разных соотношениях, то число возможных последовательностей будет намного больше. Если бы существовало только по одной молекуле каждого из этих возможных изомеров таких белков, то общая масса всех этих молекул значительно превышала бы массу Земли.
Таким образом, 20 белковых аминокислот обладают практически неограниченными возможностями в синтезе огромного количества разнообразных белков. Они представляют собой благодатный строительный материал в эволюционном развитии живой материи на нашей планете. В то же время наличие в белках самых различных химических группировок — аминных, карбоксильных, имидазольных, бензольных, гидроксильных, сульфгидрильных, индольных обусловливает также огромное разнообразие реакционных возможностей белковых молекул.
Пептидная связь характеризуется следующими свойствами:
1. Четыре атома пептидной связи лежат в одной плоскости, т.е. для пептидной связи характерна компланарность.
2. Атомы О и Н пептидной связи имеют трансориентацию.
3. Длина С-N-связи в пептидной связи, равная 0,13 нм, имеет промежуточное значение между длиной двойной ковалентной связи (0,12нм) и одинарной ковалентной связи (0,15 нм). Следовательно, связь С-N имеет частично характер двойной связи (л-связи), из чего следует, что вращение вокруг оси С-N затруднено.
ВТОРИЧНАЯ, ТРЕТИЧНАЯ И ЧЕТВЕРТИЧНАЯ СТРУКТУРЫ БЕЛКОВ
Физиологические функции белка в огромной мере определяются не только его первичной структурой, но и его пространственной структурой, а именно вторичной, третичной и четвертичной структурами.
Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счет системы водородных связей, т.е. конформацию белковой молекулы.
Различают две формы вторичной структуры: спиральную, возникающую в пределах одной полипептидной цепи, и слоисто-складчатую – между смежными полипептидными цепями.
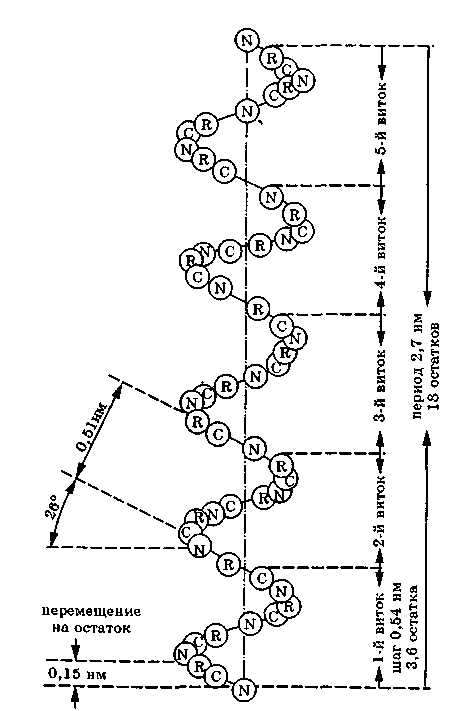
а-Спираль. Эта конформация представляет собой спираль, образованную единственной цепью и имеющую направление вращения по ходу часовой стрелки.
а -Спираль имеет шаг 0,54 нм и диаметр 1,05 нм. На каждый виток а -спи-рали приходится в среднем 3,6 аминокислотных остатков. Один аминокислотный остаток занимает 0,15 нм длины спирали.
Между атомами водорода в пептидной группировке и карбонильным кислородом четвертой от нее аминокислоты возникают внутримолекулярные водородные связи. Эти связи появляются после формирования спирали и закрепляют ее.
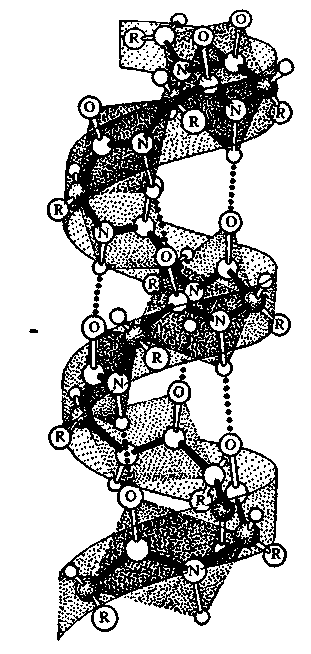
Складчатая β-структура
 Слоисто-складчатая
структура известна также под названием
β-структуры, или β-складчатого листа.
Она имеет слегка изогнутую конфигурацию
у β -углеродного атома полипептидной
цепи и формируется с помощью
межцепочечных водородных связей.
Слоисто-складчатая
структура известна также под названием
β-структуры, или β-складчатого листа.
Она имеет слегка изогнутую конфигурацию
у β -углеродного атома полипептидной
цепи и формируется с помощью
межцепочечных водородных связей.
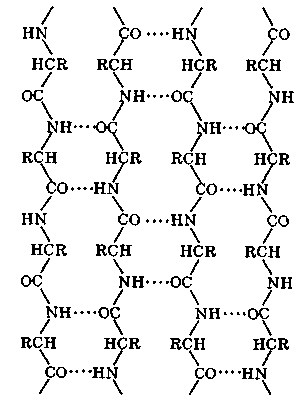
β -складчатые листы могут быть образованы параллельными (N-концы направлены в одну сторону) и антипараллельными (N -концы направлены в разные стороны) полипептидными цепями. Возможны смешанные параллельные и антипараллельные β -складчатые листы.
Складчатые структуры наблюдаются очень часто. Они были обнаружены во многих структурных белках (коллагене, кератине, фиброине шелка). У глобулярных белков эти структуры составляют 15 % и более. Возможны переходы от α-структур к β-структурам и обратно вследствие перестройки водородных связей между вытянутыми фрагментами полипептидной цепи.
Совокупность α -спиралей и β -структур является важным критерием, по которому можно судить о степени упорядоченности структуры белковой молекулы, стабильности белков при действии физико-химических факторов сред.
Третичная структура белка формируется способом складывания вторичной структуры. Например, свиваясь в клубок, спирали образуют глобулы.
Именно такую форму имеют белки, выполняющие роль биологических катализаторов и регуляторов, а также белки, имеющие транспортные функции.
Полярные гидрофильные группы в глобуле расположены на ее внешней поверхности, а неполярные гидрофобные группы обращены внутрь глобулы. Благодаря этому наружная поверхность белка гидратируется, что повышает растворимость белка и обусловливает возможность его участия в биохимических реакциях, которые в физиологических условиях протекают в водной среде.
Располагаясь рядом, спирали образуют нитевидные структуры, называемые фибриллами. Фибриллярные белки являются основным строительным материалом волос, кожи и мышечных тканей.
Третичная структура белка стабилизируется главным образом связями между боковыми группами аминокислотных остатков: дисульфидные и водородные связи, диполярные взаимодействия, силы ван-дер-ваальсова притяжения, электростатические эффекты.
Четвертичная структура белка формируется как ансамбль двух или более полипептидных цепей, каждая из которых имеет свою первичную, вторичную и третичную структуры и называется субъединицей. Субъединицы могут быть либо одинаковыми по составу и строению, либо различными. Несколько таких субъединиц могут объединяться с образованием в результате совместной упаковки четвертичной структуры.
Четвертичная структура белка не менее важна, поскольку некоторые белки выполняют свои биологические функции, находясь не в виде одинарной полипептидной цепи, а в виде конгломерата (ансамбля) двух или более цепей (гемоглобин состоит из 4 субъединиц, α-амилаза из 2 субъединиц).
Природа и типы связей, участвующих в формировании структуры белка
Рассмотрим взаимодействия, которые определяют способность белков принимать и удерживать ту или иную высокоорганизованную в пространственном отношении форму.
1) Ковалентные связи
1.1 Ковалентные пептидные связи
Первичная структура представляет собой совокупность ковалентных (пептидных) связей. Они образуют энергетический остов молекулы белка и действуют вдоль пептидной цепи. Ковалентные связи характеризуются наибольшей электронной плотностью между двумя связывающими атомами, поэтому энергия связи велика, порядка 140—400 кДж/моль.
1.2 Ковалентные связи -s-s-.
Они обусловливают изменение направления полипептидной цепи, скрепляют ее отдельные участки. Эти связи возникают между двумя молекулами цистеина, находящимися на различных участках цепи, за счет отрыва водорода от сульфгидрильных групп. Хотя под действием дисульфидных связей и уменьшается степень упорядоченности вторичной структуры, наличие этих связей укрепляет структуру оставшихся α-спиралей и β-складок и делает ее более стабильной к воздействию таких физико-химических факторов среды, как температура и рН.
Если цистеиновые фрагменты содержатся в различных полипептидных цепях, образующийся цистеиновый мостик связывает эти цепи.
Водородные связи
В формировании вторичной структуры белка принимают участие водородные связи. По своей природе эти связи являются электростатическими. Водородная связь возникает между электроотрицательными атомами и осуществляется через атом водорода. Такой тип связи атом водорода образует значительно легче, чем любой другой атом, так как его малые размеры позволяют ему беспрепятственно приближаться к взаимодействующим электроотрицательным атомам. Энергия водородной связи невелика: в сухих белках колеблется от 15 до 40 кДж/моль, т.е. она в 10—60 раз слабее, чем ковалентная связь; к тому же энергия водородной связи сильно уменьшается в полярных средах. В водных растворах она колеблется в пределах 6—12 кДж/моль. Однако в формировании вторичной структуры белка принимает участие довольно большое количество водородных связей; между ними возникает так называемый кооперативный эффект действия, заключающийся в том, что суммарный эффект их совместного действия значительно выше суммы эффектов действия водородных связей порознь. Таким образом, водородные связи обеспечивают достаточную стабильность и упорядоченность в структуре белковой молекулы.
2.1 Водородные связи внутри полипептидной цепи.
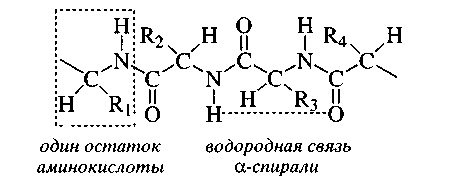
Водородные связи между полипептидными цепями.
Наличие амидных функций во фрагментах аминокислот предопределяет их способность к образованию сильных водородных связей и между соседними полипептидными цепями.
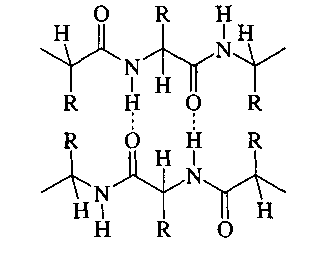
Именно такие водородные связи в первую очередь считаются ответственными за формирование вторичной структуры белков.
2.3 Водородные связи между боковой группой и полипептидной цепью.
В формировании третичной структуры белка принимают участие и водородные связи. Они возникают, например, между гидроксильной группой серина и имидазольным кольцом гистидина, между гидроксильной группой тирозина и заряженной карбоксильной группой аспарагиновой или глутаминовой аминокислот. В качестве примера на рис. 27.1 показано Н-связывание между гидроксигруппой фрагмента тирозина и карбонильной группой полипептидной цепи.
3) Гидрофобные взаимодействия между боковыми группами.
При укладке в глобулу гибкая полипептидная цепь будет стремиться принять более энергетически выгодную форму. В результате образования между диполями воды водородных связей неполярные группы радикалов будут вытесняться из сферы действия водной среды и контактировать друг с другом. В свою очередь, этот контакт будет способствовать развитию ван-дер-ваальсовых сил. В результате таких взаимодействий водной среды и полипептидной цепи неполярные группы радикалов образуют внутреннюю часть белковой глобулы (гидрофобное ядро), а ионные и полярные группы радикалов располагаются снаружи этого ядра.
Хотя энергия гидрофобного взаимодействия невелика и колеблется в пределах 1—6 кДж/моль, надо иметь в виду, что неполярные группы в белках составляют от трети до половины всех остатков. Вполне очевидно, что выигрыш свободной энергии при образовании гидрофобного ядра может быть вполне достаточным, чтобы стабилизировать белковую глобулу.
