
Оксосоединения: альдегиды и кетоны
К классу оксосоединений относятся органические вещества, содержащие группу >С=О, называемую карбонильной группой или карбонилом.
Если две валентности атома углерода карбонила заняты алкильными радикалами, оксосоединения называются кетонами:
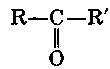
Если две валентности атома углерода карбонила заняты алкильным радикалом и атомом водорода, оксосоединения называются альдегидами.
![]()
Кетоны и альдегиды называют также карбонильными соединениями.
Реакции альдегидов и кетонов весьма похожи, что и позволяет рассматривать их в общем классе оксосоединений. Общая формула гомологического ряда наиболее распространенных предельных алифатических альдегидов и кетонов одинакова: СnН2пО.
1. Номенклатура
а) Тривиальные названия альдегидов очень распространены, они связаны с тривиальными наименованиями кислот с тем же углеродным скелетом, в которые альдегиды легко переходят при окислении: муравьиный альдегид (формальдегид), уксусный альдегид (ацетальдегид), пропионовый, масляный, валериановый и т. д.
По номенклатуре ИЮПАК наличие альдегидной группы обозначается суффиксом -ал (-алъ):
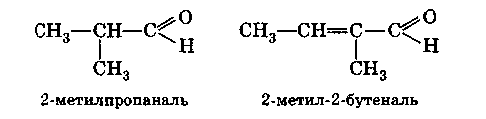
Если альдегидная группа не входит в главную цепь из-за наличия старших групп, то она обозначается префиксом формил:
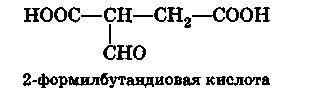
б)Названия простых кетонов обычно составляются из названий радикалов, связанных с карбонильной группой, и слова кетон:
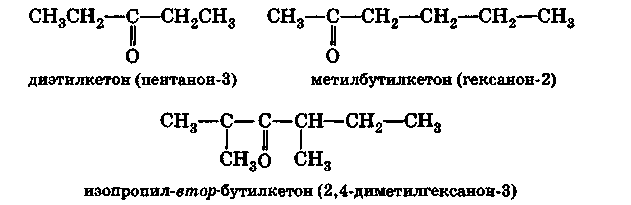
Для названий более сложных кетонов используют суффикс -он (ИЮПАК):
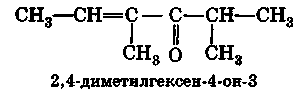
При наличии более старшей группы кетонная группа обозначается префиксом оксо-:
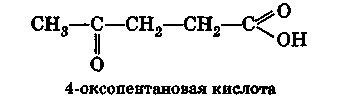
2. Физические свойства
В молекуле любого альдегида или кетона в связи с большей электроотрицательностью атома кислорода по сравнению с углеродным атомом подвижные электроны π-связи в группе >С=0 сдвинуты в сторону атома кислорода. Этот сдвиг вызывает появление избыточной электронной плотности на атоме кислорода (δ-) и соответственное уменьшение электронной плотности на карбонильном атоме углерода (δ+), что вызывает в свою очередь смещение σ-электронов соседних углерод-углеродных связей:
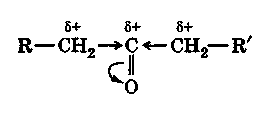
Таким образом, альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Практически все химические реакции оксосоединений обусловлены таким распределением электронной плотности в молекуле.
Двойная связь С=0 является одновременно и более реак-ционноспособной и более прочной, чем связь С=С. Так, энергия связи С=О равна 750 кДж/моль, что заметно больше, чем удвоенная энергия связи С—О, равная 360 • 2 = 720 кДж/моль. В ряду связей С=С и С—С обратное соотношение. Энергия связи С=С (612 кДж/моль) заметно меньше, чем удвоенная энергия связи С—С (339 • 2 = 678 кДж/моль). Повышенная реакционная способность связи С=О по сравнению с С=С определяется различием в электроотрицательности атомов О и С. Высокая степень поляризации связи С=О и приводит к легкому присоединению к ней полярных соединений или ионов.
Так как в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода, их молекулы не ассоциированы и температуры кипения их значительно ниже, чем соответствующих спиртов. В целом температура кипения кетонов немного выше, чем изомерных им альдегидов. Разветвление цепи вызывает закономерное понижение температуры кипения. Низшие члены ряда — ацетон, формальдегид, ацетальдегид — растворимы в воде, высшие альдегиды и кетоны хорошо растворимы в большинстве обычных органических растворителей (спирты, эфир и т. п.). Низшие альдегиды имеют резкий запах, у альдегидов с С3—С6 весьма неприятный запах, высшие альдегиды обладают цветочными запахами и даже применяются в парфюмерии.
