
attachments_21-10-2012_19-29-50 / Лабораторный практикум по химии. Часть 1
.pdfЛ. Н. Круглова, И. М. Зырянова, А. Ю. Муканов
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ХИМИИ Часть I
Омск 2007

УДК 546
Лабораторный практикум по химии. Часть I: Методические указания к выполнению лабораторных работ по химии. / Л. Н. Круглова, И. М. Зырянова, А. Ю. Муканов. Омский государственный университет путей сообщения. Омск, 2007. 36 с.
Методические указания включают в себя одну лабораторнопрактическую работу «Строение атома и периодическая система элементов» и четыре лабораторные работы по темам «Комплексные соединения», «Скорость химических реакций и химическое равновесие», «Определение временной жесткости воды» и «Электролитическая диссоциация и гидролиз солей». В данных работах изложены краткие теоретические сведения и дано описание методик проведения каждой лабораторной работы и практического занятия.
Указания составлены в соответствии с программой по химии для нехимических вузов и предназначены для студентов дневной и заочной формы обучения.
Библиогр.: 10 назв. Табл. 3. Черт. 2.
Рецензенты: доктор хим. наук А. С. Фисюк
Омский государственный университет путей сообщения, 2007
СОДЕРЖАНИЕ
Введение ……………………………………………………………4
Правила работы в лаборатории химии…………5
Лабораторно-практическое занятие 1. Строение атома и периодическая система элементов………..6
1.1.Теоретическая часть……….6
1.2.Контрольные вопросы………13
1.3.Контрольные задания………13
Лабораторная работа 2. Комплексные соединения………14
2.1.Теоретическая часть………14
2.2.Экспериментальная часть…………18
2.3.Контрольные вопросы…………..19
2.4.Контрольные задания…………….20
Лабораторная работа 3. Скорость химических реакций и химическое равновесие……………..20
3.1.Теоретическая часть…………..20
3.2.Экспериментальная часть………….27
3.3.Контрольные вопросы………29
3.4.Контрольные задания………….29
Лабораторная работа 4. Определение временной жесткости воды……..30
4.1.Теоретическая часть……….41
4.2.Экспериментальная часть……….32
4.3.Контрольные вопросы………32
4.4.Контрольные задания………..32 Лабораторная работа 5. Гидролиз солей………33
5.1.Теоретическая часть…………33
5.2.Экспериментальная часть……….34
5.3.Контрольные вопросы………..35
5.4.Контрольные задания………..36 Библиографический список……..36
3
ВВЕДЕНИЕ
Предлагаемые методические указания разработаны в соответствии с программой курса «Общая химия» на основе ранее изданных [9, 10] и включают в себя описание лабораторно-практических работ по основным разделам общей и неорганической химии.
При их составлении был учтен опыт проведения лабораторных работ со студентами, внесены методические указания и дополнения.
Методические указания состоят из двух частей. В первую включена лабораторно-практическая работа «Строение атома и периодическая система элементов» и лабораторные работы «Комплексные соединения», «Скорость химических реакций и химическое равновесие», «Определение временной жесткости воды» и «Электролитическая диссоциация и гидролиз солей». Во вторую часть включены лабораторные работы «Окислительновосстановительные реакции», «Гальванические элементы, коррозия металлов» и «Электролиз».
Последовательность расположения теоретического материала и его объем способствует самостоятельному изучению теоретического материала студентами. Объем методического материала, приведенного в экспериментальной части каждой лабораторной работы, достаточен для самостоятельного выполнения лабораторных работ студентами.
Выполнение каждой лабораторной работы должно быть представлено как самостоятельное научное исследование с постановкой задачи, с ее теоретическим обоснованием, экспериментальной проверкой высказанного суждения, выводом из проделанной работы.
Авторы выражают искреннюю признательность рецензентам за замечания и пожелания при рецензировании, способствующие улучшению методических указаний.
4
ПРАВИЛА РАБОТЫ В ЛАБОРАТОРИИ ХИМИИ
Перед тем как приступать к занятиям в химической лаборатории студент обязан ознакомиться с настоящими правилами техники безопасности, и оставить роспись в журнале по технике безопасности о прохождении инструктажа.
Для осознанного выполнения лабораторной работы, студент должен подготовиться к ней заранее. Ему необходимо изучить соответствующий теоретический материал и описание выполняемой работы по настоящим методическим указаниям. Выполнять каждый опыт необходимо только после полного уяснения каждой операции. При выполнении опыта следует строго соблюдать последовательность его стадий.
При работе необходимо содержать рабочее место в чистоте. Случайно пролитую жидкость или просыпанное твердое вещество необходимо удалить влажной тряпкой, а затем насухо вытереть стол. Обрывки бумаги, осколки стекла, остатки металлов запрещается бросать в водопроводные раковины, их следует выбрасывать в мусорное ведро.
При нагревании растворов посуду следует располагать так, чтобы капли случайно выброшенной жидкости не попали на Вас или на соседей. Нельзя брать реактивы и капельные пипетки из чужих реактивных штативов, так как это не только нарушает порядок работы, но и может стать причиной загрязнения реактивов.
За 5 минут до окончания занятия студент должен привести в порядок рабочее место и вымыть всю лабораторную посуду, использованную при проведении опытов.
Для отражения проделанной работы следует оформить отчет (выполняется в общей тетради). На обложке лабораторного журнала необходимо поставить номер группы и фамилию студента. Страницы журнала должны иметь поля шириной 2-3 см.
В отчете по лабораторной работе рекомендуется следующий порядок записей: наименование работы и дата ее проведения; цель работы; название каждого опыта; условия его проведения; результат опыта или наблюдения (время, температура, образование осадка или газа, изменение окраски раствора и др.); рисунок или схема прибора; уравнения реакций с коэффициентами (если это окислительно-восстановительная реакция, то должен быть составлен
5
электронный баланс); сводные таблицы результатов и графики; вывод. В конце лабораторного отчета необходимо письменно дать ответы на контрольные вопросы и выполнить контрольные задания, помещенные в конце каждой лабораторной работы.
По окончанию лабораторной работы студент должен представить лабораторный журнал преподавателю для проверки и подписи, ответить на теоретические вопросы по данной теме, а также выполнить контрольные задания.
Лабораторно-практическое занятие 1
СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Цель работы: изучить электронную структуру атомов элементов и порядок заполнения атомных орбиталей. Уяснить явления возбужденного состояния атома и образования ионов.
1.1.Теоретическая часть
1.1.1.Строение атома
Атом – наименьшая частица химического элемента, обладающая его химическими свойствами, состоящая из положительно заряженного ядра, образованного протонами и нейтронами, и электронов.
Протон (р) обладает положительным единичным атомным зарядом (+1) и единичной атомной массой, нейтрон (n) электронейтральная частица по массе практически совпадает с протоном, электрон (е-) обладает отрицательным единичным зарядом и значительно меньшей массой чем протон (более чем в
1800 раз).
Положительный заряд ядра атома определяется числом протонов и совпадает с порядковым номером элемента в периодической системе элементов Д. И. Менделеева. В электронейтральном атоме число электронов совпадает с числом протонов. Масса атома в основном сосредоточена в ядре (поскольку масса электрона ничтожно мала) и складывается из масс протонов и нейтронов. Число протонов в ядре указывается индексом в нижнем левом углу, а атомная масса в верхнем левом углу от символа элемента, например:
6
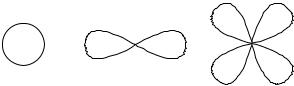
20983 Bi - 83 протона, 83 электрона, 209-83=126 нейтронов
Изотопы – элементы, у которых в ядре одинаковое количество протонов (одинаковый порядковый номер), но разное количество нейтронов и, следовательно, разная атомная масса. По химическим свойствам изотопы полностью совпадают, например:
23592 U и 23892 U, |
11H и 21H |
(1.1) |
Изобары – атомы разных элементов, имеющие одинаковую атомную массу. По химическим свойствам изобары отличаются друг от друга, например:
7030 Zn и 7032 Ge, |
4018 Ar и 2040 Ca |
(1.2) |
1.1.2.Квантовые числа
1.1.2.1.Главное квантовое число
Главное квантовое число (n) определят номер энергетического уровня (размер электронного облака), на котором могут находиться электроны. Главное квантовое число имеет только целочисленные значения и изменяется от 1 до бесконечности. Электрон, находясь на самом нижнем энергетическом уровне (n=1), обладает минимальной энергией.
1.1.2.2. Орбитальное квантовое число
Орбитальное квантовое число (l) определяет форму электронного облака. Формы электронных облаков:
(1.3)
s-орбиталь p-орбиталь |
d-орбиталь |
Для каждого |
|
|
энергетического уровня (n) орбитальное квантовое число может принимать значения от 0 до n-1. Т.е. для первого уровня (n = 1) l может принимать только одно значение l = 0; для n = 2 два значения l = 0,1; для n = 3 три значения l = 0,1,2; и т.д. Поскольку энергии электронных облаков разной
7
формы отличаются, то орбитальное квантовое число определяет энергию и тип подуровня. Наряду с числовым обозначением орбитального квантового числа приняты и буквенные обозначения: s (l = 0), p (l = 1), d (l = 2), f (l = 3), и т.д.
1.1.2.3. Магнитное квантовое число
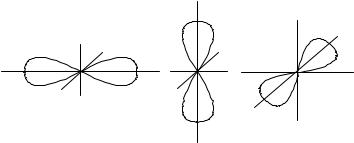
Магнитное квантовое число (ml) определяет расположение орбитали в пространстве. Число возможных положений орбиталей в пространстве зависит от формы орбитали, поэтому число значений, которое может принимать магнитное квантовое число, зависит от значения орбитального квантового числа. Для орбитального квантового числа равного l значения магнитного квантового числа могут быть - l, - l+1, …, 0, …, l-1, l, т.е. общее число значений ml (число возможных положений орбитали в пространстве) равно 2l+1. Например, для s-орбитали (l = 0) ml может иметь только одно значение ml = 0, т.е. s-орбиталь в пространстве имеет одно расположение. Для p-орбитали (l = 1) ml = –1, 0, +1, т.е. р-обриталь в пространстве можно расположить тремя способами – по трем осям координат. Для d-орбитали (l = 2) значения магнитного квантового числа ml = –2, –1, 0, +1, +2 – пять возможных положений в пространстве, и т.д.
|
y |
|
|
x |
(1.4) |
|
|
|
для р-орбитали (l=1) |
|
z |
|
|
|
ml = -1 |
ml = 0 |
ml = +1 |
1.1.2.4. Спиновое квантовое число
Спиновое квантовое число (ms) определяет момент вращения электрона вокруг собственной оси. Это векторная величина, имеющая только два значения: +1/2 и –1/2.
8

1.1.3.Правила заполнения орбиталей электронами
Вразличных атомах присутствует строго определенное количество электронов, определяемое зарядом ядра, и не ограниченный набор орбиталей на которых они могут располагаться. Электроны на этих орбиталях располагаются не случайным образом, а по определенным правилам. При написании электронного строения атома приняты следующие обозначения: электрон обозначают стрелкой ↑ или ↓; если стрелка направлена вверх, то спиновое квантовое число равно +1/2, если вниз, то –1/2; орбиталь обозначается  .
.
1.1.3.1. Принцип Паули
Принцип Паули – в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Следствия из принципа Паули:
1.на одной орбитали могут находиться только два электрона, причем с противоположными спинами;
2.на одном подуровне может находиться 2(2l+1) электронов (где l – орбитальное квантовое число соответствующее данному подуровню);
3.на одном уровне может находиться 2n2 электронов (где n – номер энергетического уровня).
1.1.3.2. Принцип минимальной энергии
При заполнении орбиталей электронами в первую очередь заполняются орбитали с минимальной энергией (расположенные ближе к ядру), поскольку это соответствует наиболее устойчивому состоянию электрона.
1.1.3.3. Правило Хунда (Гунда)
Правило Хунда – в пределах одного подуровня электроны стремятся расположиться на орбиталях таким образом, чтобы суммарный спин всех электронов на подуровне был максимальным. Например, если на 3d-подуровне расположено шесть электронов, то может существовать несколько вариантов их расположения:
9
1) |
… |
↑↓ |
↑↓ |
↑↓ |
|
|
; |
2) |
… |
↑↓ |
↑↓ |
↑ |
↑ |
|
; |
3) |
… |
↑↓ |
↑ |
↑ |
↑ |
↑ |
. |
(1.5) |
|||
|
|
|
|
3d6 |
|
|
|
|
|
|
3d6 |
|
|
|
|
|
|
3d6 |
|
|
|||||||
Из приведенных вариантов правильным является третий т.к. сумма значений спиновых квантовых чисел всех электронов в данном случае максимальна: Σms(3) = 5 (+1/2)+1 (–1/2) = 2, (Σms(1) = 3 (+1/2)+3 (–1/2) = 0,
Σms(2) = 4 (+1/2)+2 (–1/2) = 1), что соответствует правилу Хунда.
1.1.3.4. Правило Клечковского
Заполнение электронами атомных орбиталей высших уровней можно определить по правилу Клечковского – заполнение атомных орбиталей происходит в порядке увеличения значения суммы главного и орбитального квантовых чисел (n+l), при равенстве сумм n+l для двух орбиталей в первую очередь заполняется орбиталь с наименьшим значением главного квантового числа. Последовательность заполнения орбиталей электронами согласно правилу Клечковского следующая:
число электронов на уровне тип подуровня
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
главное квантовое число обозначение орбитали
Пример: электронное строение селена 34Se:
электронная формула: 34Se 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4s4;
сокращенная электронная формула: 34Se [18Ar] 4s2 3d10 4s4; электронно-графическая формула:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
↑↓ |
↑ |
|
↑ |
|
|
|
|
|
|
|
|
|
|
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
||||
|
|
|
|
|
|
|
|
|
|
↑↓ |
|
|||||||||
|
|
|
|
|
|
|
↑↓ |
↑↓ |
↑↓ |
|
4p |
4 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
↑↓ |
|
|
|
2 |
|
3d |
|
|
|
|||||
|
|
|
↑↓ |
↑↓ |
↑↓ |
|
|
6 |
|
4s |
|
|
|
|
|
|
|
|
|
|
34Se |
↑↓ |
↑↓ |
|
|
|
3s2 |
|
3p |
|
|
|
|
|
|
|
|
|
|
|
|
|
2p6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
2 2s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сокращенная электронно-графическая формула:
|
|
|
|
|
|
|
|
↑↓ |
↑ |
↑ |
|
|
|
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
||||||
|
|
|
||||||||||
34Se [18Ar] |
↑↓ |
|
|
|
|
|
|
|
4p4 |
|
(1.8) |
|
|
|
10 |
|
|
|
|
|
|||||
|
4s2 |
|
3d |
|
|
|
|
|||||
(1.6)
(1.7)
10
