Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
Волгоградский государственный архитектурно-строительный университет
Кафедра общей и прикладной химии
альдегиды и кетоны
Методические указания к лабораторной работе
по курсу «Органическая химия»
для студентов дневной и заочной формы обучения
Волгоград 2012
УДК 547.1-316(076.5)
Альдегиды и кетоны : методические указания к лабораторной работе по курсу «Органическая химия» для студентов дневной и заочной формы обучения / сост. В.А. Андронова, И.А. Куликова, Г.В. Чичерина ; ВолгГАСУ. – Волгоград, 2012. – 17 с.
Рассмотрены альдегиды и кетоны, их строение, химические свойства. Даны указания по выполнению лабораторного практикума.
Для студентов специальностей ИЗОС, ЗОС б, ПСК.
Библиогр. 3 назв.
1. Основные теоретические сведения
Общие сведения, классификация и номенклатура альдегидов и кетонов
Альдегиды и кетоны - это производные углеводородов, в которых содержится карбонильная группа или оксо- группа.
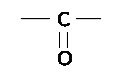
Если карбонильная группа связана с одним радикалом и водородом, то это соединение альдегид.

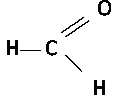
Исключение составляет муравьиный альдегид:
Соединения, в которых карбонильная группа соединена с двумя углеводородными радикалами называется кетонами.
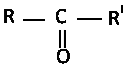
Названия альдегидов по тривиальной номенклатуре производят от названий соответствующих кислот, в которые они переходят при окислении

пропионовый альдегид пропионовая кислота
Согласно систематической номенклатуре к названию соответствующих алканов добавляют суффикс –аль,нумерацию углеводородной цепи начинают от альдегидной группы.
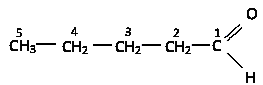
пентаналь
По рациональной номенклатуре альдегиды сложного изостроения рассматривают как производные уксусного альдегида:
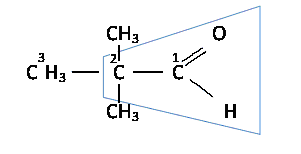
триметилуксусный альдегид (рациональное название)
2,2-диметилпропаналь (систематическое название)
Кетоны по рациональной номенклатуре называют в следующей последовательности: перечисляют радикалы, связанные с карбонильной группой и добавляют слово кетон.
По систематической номенклатуре к названию предельного углеводорода добавляют суффикс –он с указанием места карбонильной группы. Нумерацию цепи начинают с того конца, где ближе карбонил.
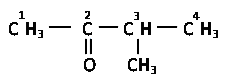
метилизопропилкетон (рациональное название)
3-метилбутанон-2 (систематическое название)
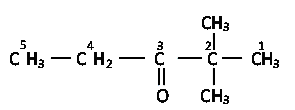
этилтретбутилкетон (рациональное название)
2,2 –диметилпентанон – 3 (систематическое название)
Химические свойства альдегидов и кетонов
Альдегиды и кетоны - реакционноспособные соединения, вступающие в многочисленные химические реакции. Высокая химическая активность альдегидов и кетонов определяется карбонильной группой – одной из наиболее активных функциональных групп.
Атом углерода карбонильной группы, также как и в этиленовых углеводородах, находится в состоянии sp2 – гибридизации атомных орбиталей, валентный угол связи составляет 120°.
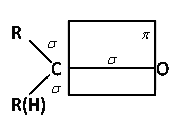
Двойная связь карбонильной группы состоит из одной σ-связи и одной π-связи. Но в отличие от обычной двойной С—С связи, двойная связь в карбонильной группе сильно поляризована ввиду разности электроотрицательностей атомов углерода и кислорода (относительная электроотрицательность кислорода 3,5 единицы, а углерода 2,5 единицы). В результате происходит смещение π-электронной плотности в сторону кислорода:
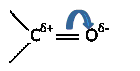
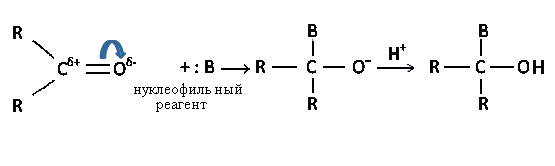
Такая поляризация двойной связи определяет значительный электрический момент диполя карбонильной группы, который равен 9*10-30 Кл*м или 2,7 Дебая. Все это является причиной высокой реакционной способности альдегидов и кетонов, которая проявляется, главным образом, в реакциях нуклеофильного присоединения*(AdN). В процессе реакции углерод карбонильной группы проявляет электрофильный**, а кислород – нуклеофильный характер.
анион оксипроизводное
______________________________________________________________
*нуклеофильный (в переводе с латинского) любящий положительное
** электрофильный – любящий отрицательное
Атом углерода карбонильной группы взаимодействует с нуклеофильным реагентом.
Двойная связь разрывается с образованием аниона, который взаимодействует с катионом (или протоном водорода), давая оксисоединение. Примером реакций присоединения, протекающих по AdN механизму, являются взаимодействие оксосоединений с синильной кислотой (HCN), спиртами, гидросульфитом натрия (NaHSO3), магнийорганическими соединениями, аммиаком.
Реакционная способность карбонильной группы зависит от объема заместителей около углерода. С увеличением этого объема реакционная способность понижается. Поэтому альдегиды, у которых карбонильная группа связана с одним радикалом и водородом, более реакционноспособны, чем кетоны.
Реакции присоединения
а) Присоединение синильной кислоты НСN

б) Присоединение гидросульфита натрия NaHSO3
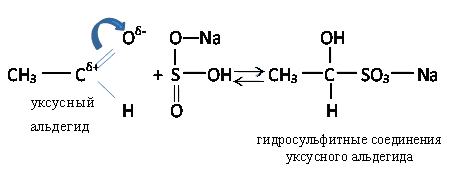
Из кетонов в эту реакцию вступают только метилкетоны. Гидросульфитные соединения легко разлагаются при нагревании с разбавленными кислотами с образованием в чистом виде альдегидов или кетонов. Этой реакцией пользуются для выделения, количественного определения или очистки альдегидов и кетонов.
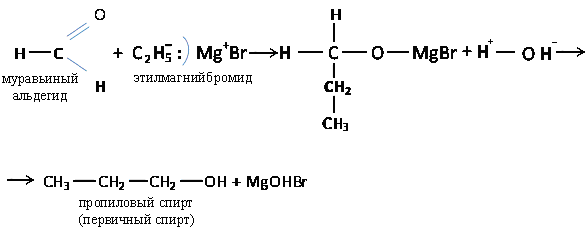
в) Присоединение магнийорганических соединений (реактив Гриньяра)
Реактив Гриньяра: Rδ-—Mgδ+—Br
Связь С—Mg поляризована, при этом образуется отрицательный заряд на атоме углерода. Углерод проявляет нуклеофильный характер.
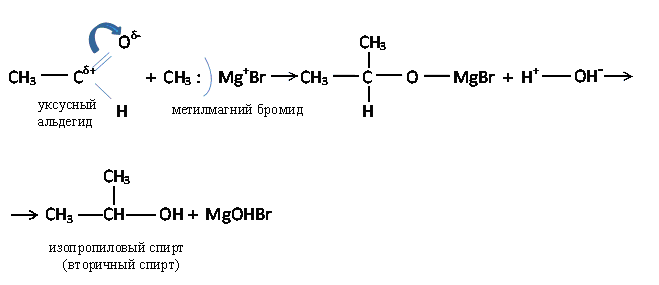
Органический анион CH3-, уходящий вместе с электронной парой от магний-бромида - это мощный нуклеофильный реагент. При разложении магний-органического соединения водой образуются I, II или III-е спирты.
Первичный спирт образуется с муравьиным альдегидом, а третичный – с кетоном.

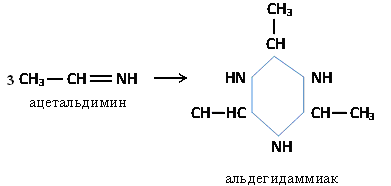
г) Присоединение аммиака
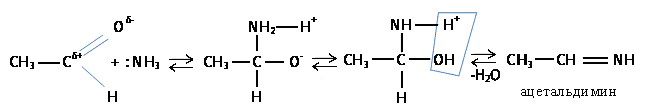
п олученный
альдимин легко циклизуется с образованием
альдегидаммиака:
олученный
альдимин легко циклизуется с образованием
альдегидаммиака:
д) Присоединение спиртов
При взаимодействии альдегидов с избытком спирта образуются ацетали, с недостатком спирта полуацетали. Их можно рассматривать как простые эфиры, образованные гидратной формой альдегида. Гидратная форма альдегида содержит две гидроксильные группы у одного атома углерода
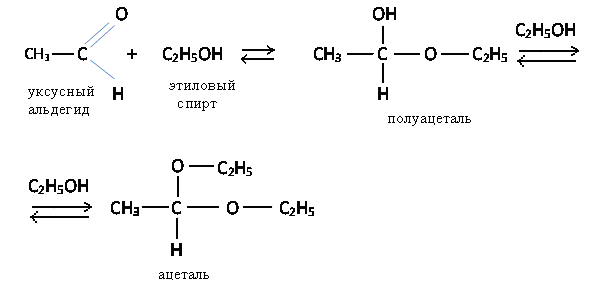
реакция протекает при небольшом нагревании, в присутствии следов минеральной кислоты. Кетоны в этих условиях не вступают в реакцию.
е) Присоединение водорода

Реакции замещения
В этих реакциях происходит замещение атома кислорода карбонильной группы на другие атомы или группы атомов.
а) Альдегиды и кетоны обменивают кислород на галогены
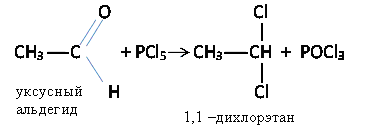
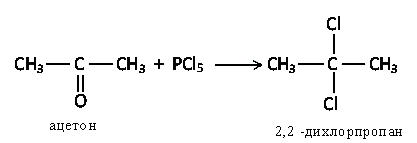
б) Взаимодействие с гидроксиламином
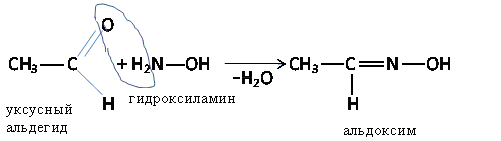

В реакции применяется солянокислый гидроксиламин NH2—OH*HCl. Выделяющаяся при реакции соляная кислота может быть оттитрована, что используется для количественного определения альдегидов и кетонов.
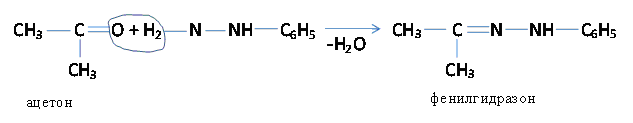
в) Взаимодействие альдегидов и кетонов с гидразином с образованием гидразонов


г )
Альдегиды и кетоны взаимодействуют с
фенилгидразином
—NH—NH2
)
Альдегиды и кетоны взаимодействуют с
фенилгидразином
—NH—NH2
При этом образующиеся продукты (фенилгидразоны) -
кристаллические вещства с характерной температурой
плавления, что позволяет использовать эту реакцию для
выделения, очистки и разделения альдегидов и кетонов.
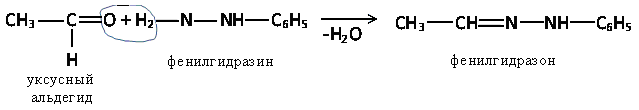
Реакции окисления
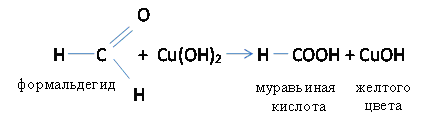
а) Альдегиды легко окисляются даже при действии слабых окислителей с образованием одноосновных карбоновых кислот с тем же числом углеродных атомов.
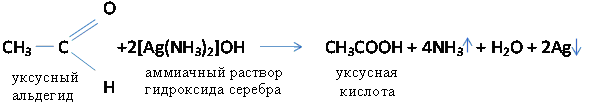
Серебро тонким слоем покрывает стенки пробирки – реакция серебряного зеркала. Эту реакцию используют для изготовления зеркал, елочных игрушек. При нагревании альдегидов в щелочном растворе солей двухвалентной меди, образуются соединения одновалентной меди.
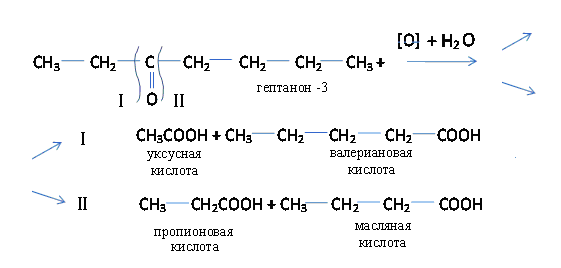
б) Окисление кетонов протекает с трудом. Взаимодействие с сильными окислителями при нагревании сопровождается разрывом углеводородной цепи про обеим сторонам карбонильной группы. При окислении несимметричного кетона образуется смесь из четырех кислот (правило Вагнера – Попова).
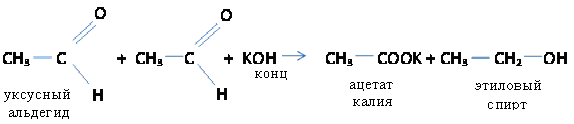
в) Реакция Канницаро.
Молекула альдегида в присутствии концентрированных щелочей может окисляться за счет другой молекулы альдегида, которая при этом восстанавливается до спиртов (реакция диспропорционирования)
Реакции полимеризации
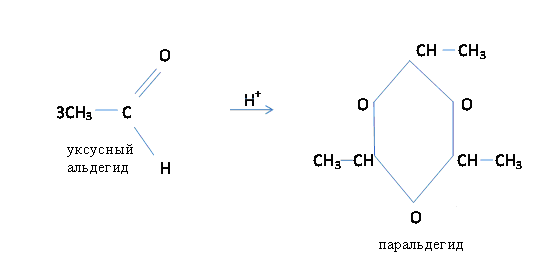
Такие реакции характерны только для альдегидов. Под влиянием минеральных кислот альдегиды способны полимеризоваться с образованием циклических продуктов или линейных полимеров. При этом уксусный альдегид образует циклический триммер – паральдегид, а муравьиный – линейный полимер – параформ.

Реакции, связанные с подвижностью атомов водорода в α-положении (реакции конденсации)
Атомы водорода в молекулах альдегидов и кетонов, находящиеся в α-положении к карбонильной группе, обладают большой подвижностью (протонизированы) вследствие снижения электронной плотности у углерода карбонильной группы.

Водород в виде протона, отрываясь, переходит к кислороду карбонильной группы другой молекулы альдегида (или кетона), а оставшийся анион соединяется с атомом углерода карбонильной группы. В результате образуется альдоль (оксиальдегид).
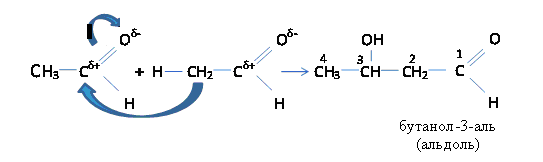
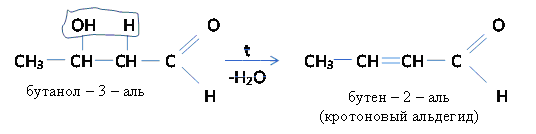
Эта реакция называется альдольной конденсацией (по А.П. Бородину). При нагревании происходит отщепление воды от альдоля и образуется ненасыщенный альдегид.