
|
СОДЕРЖАНИЕ |
СТР |
|
Список сокращений |
5 |
|
ВВЕДЕНИЕ |
7 |
|
ВОЗБУДИТЕЛИ ТУБЕРКУЛЁЗА И ИХ ИЗМЕНЧИВОСТЬ |
11 |
|
Строение клеточной стенки микобактерий |
25 |
|
Особенности капсулы микобактерий |
31 |
|
Культуральные, биохимические и генетические исследования микобактерий |
41 |
|
Антигенные свойства углеводсодержащих фракций, выделяемых из микобактерий |
59 |
|
ПАТОГЕНЕЗ И КЛИНИЧЕСКИЕ ПРИЗНАКИ ТУБЕРКУЛЁЗА |
89 |
|
Механизмы передачи микобактерий и особенности патогенеза при туберкулёзе |
89 |
|
ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ОРГАНИЗМЕ ЖИВОТНЫХ ПРИ ТУБЕРКУЛЁЗЕ |
103 |
|
ЭПИЗООТОЛОГИЯ ТУБЕРКУЛЁЗА крупного рогатого скота |
125 |
|
Эпизоотический процесс при туберкулёзе животных |
125 |
|
Дикие животные как резервуар возбудителя туберкулеза |
135 |
|
Развитие эпизоотической ситуации по туберкулезу |
142 |
|
История эпидемии туберкулеза |
142 |
|
Эпизоотическая ситуация по туберкулезу животных в Европе и мире на рубеже XIX – XX веков |
123 |
|
Распространение туберкулеза крупного рогатого скота в 20-30-е годы ХХ века |
152 |
|
Особенности эпизоотической ситуации по туберкулезу крупного рогатого скота в России |
157 |
|
Динамика эпизоотической ситуации в Российской Федерации |
161 |
|
Эпизоотическая ситуация по туберкулезу на Украине |
164 |
|
ДИАГНОСТИКА ТУБЕРКУЛЁЗА |
181 |
|
Идентификация микобактерий |
186 |
|
Значение аллергической диагностической пробы для выявления инфицированных и больных животных |
192 |
|
Механизмы развития аллергических реакций при туберкулезе |
177 |
|
Другие непрямые методы диагностики туберкулеза |
182 |
|
ИММУНИТЕТ И СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА |
195 |
|
Механизмы защиты организма при внедрении МБТ |
195 |
|
Особенности иммунитета при развитии туберкулёзной инфекции |
198 |
|
Разработка противотуберкулёзных вакцин и их классификация |
207 |
|
Стратегия создания новых вакцин |
210 |
|
Вакцинопрофилактика |
232 |
|
Разработка иммуностимуляторов для повышения протективных свойств вакцины БЦЖ |
233 |
|
Опыт по изучению безвредности и аллергенных свойств иммуностимуляторов и вакцины БЦЖ |
235 |
|
Изучение иммуногенных и протективных свойств иммуностимуляторов и вакцины БЦЖ |
237 |
|
Разработка противотуберкулезного комплексного препарата на основе белковых субстанций микобактерий туберкулеза |
241 |
|
Определение безвредности и аллергенных свойств препарата ПКП‑2 |
242 |
|
Изучение иммуногенных и протективных свойств противотуберкулезного препарата ПКП‑2 |
244 |
|
Разработка противотуберкулезного молекулярно-субъединичного комплексного препарата ПКП‑3 |
247 |
|
Изучение безвредности и аллергенных свойств препарата ПКП‑3 |
251 |
|
Изучение иммуногенных и протективных свойств препарата ПКП-3 на крупном рогатом скоте |
268 |
|
КОНТРОЛЬ ЭПИЗООТИЧЕСКОГО ПРОЦЕССА ПРИ ТУБЕРКУЛЕЗЕ КРУПНОГО РОГАТОГО СКОТА |
287 |
|
Оздоровление неблагополучных по туберкулёзу крупного рогатого скота хозяйств |
296 |
|
Оздоровление неблагополучных по туберкулезу хозяйств при применении препарата ПКП-3 |
299 |
|
Результаты оздоровления КСП «Заповит Ленина» Зачепиловского района Харьковской области |
299 |
|
Результаты оздоровления ЗАО «Лычкове» Магдалиновского района Днепропетровской области |
303 |
|
Некоторые данные оздоровления КСП «Славутич» и «Шевченко» Верхнеднепровского района Днепропетровской области |
305 |
|
ЗАКЛЮЧЕНИЕ |
313 |
Список сокращений
БЦЖ – живая ослабленная вакцина M.bovis(«BCG» –BacteriumCalmett–Guerin)
КАМ – комплекс атипичных микобактерий
MTBC – микобактериальный туберкулезный комплекс
МБТ – микобактерии туберкулёзного типа
MAIS–Micobacteriumavium–intracellulare–scrofulaceum
ТЕ – туберкулиновая единица
ППД – сухой очищенный туберкулин
MTBC– микобактериальный туберкулезный комплекс
ETZ– электрон просвечиваемая зона
ПЦР – полимеразная цепная реакция
ИФА – иммуноферментный анализ
РСК – реакция связывания комплемента
АДП – аллергическая диагностическая проба
ПОЛ – перекисное окисление липидов
ГЗТ – гиперчувствительность замедленного типа
Th, Th1, Th2, Th3 – T-хелперы
ВВЕДЕНИЕ
Туберкулез приносит несчастья человечеству с незапамятных времен. Последние молекулярно-генетические исследования показали, что возраст предшественников микобактерий туберкулеза составляет примерно 3 млн. лет. Различные виды микобактерий являются облигатными патогенами и объединены в так называемый микобактериальный туберкулезный комплекс (MTBC), который включает в себя семь близких видов: M. tuberculosis, M. bovis, М. africanum, М. microti, М. pinnipedii, М. caprae, М. canetti. Хотя все члены MTBC имеют различные фенотипические свойства и круг хозяев, в тоже время они генетически близки, например структура генома M. tuberculosis и M. bovis отличается менее, чем на 0,05%.
M. bovis в первую очередь поражает крупный рогатый скот, но также может привести к заболеванию других млекопитающих, включая человека. Эти очень адаптированые и "успешные" патогены имеют всемирное распространение и в ряде стран туберкулез, вызываемый этим видом микобактерий, остается одним из основных инфекционных заболеваний, приносящих значительные экономические убытки. Возбудитель патогенен для крупного рогатого скота и других домашних (коз, овец, и верблюдов), а также диких (барсук, опоссум, олени) животных.
Туберкулез крупного рогатого скота негативно сказывается на прибыльности и рентабельности животноводческой отрасли и торговли, и может приводить к снижению как здоровья животных, так и генетического потенциала высокопродуктивных пород. Это заболевание также остается и важной медико-социальной проблемой. Несмотря на систематический контроль стад относительно наличия циркуляци возбудителя путем внутрикожной аллергической пробы, пастеризацию молока, проверку качества мяса, наблюдение за состоянием здоровья животных, а в некоторых странах и их вакцинацию БЦЖ, может произойти попадание M. bovis в организм человека, что до сих пор остается фактором риска, хотя некоторые исследователи считают, что в современных условиях его степень снижается.
К факторам риска при туберкулезе крупного рогатого скота также можно отнести управленческие (движение животных, условия содержания и кормления и др.), дикую фауну (наличие диких и синанттропных животных-резервуаров возбудителя), а также другие факторы окружающей среды.
Результаты целенаправленных и разносторонних исследований туберкулеза крупного рогатого скота, продолжающиеся около 150 лет, иллюстрируют сложность взаимодействия в системе «хозяин–возбудитель–окружающая среда», так называемой «эписистеме» заболевания. Выяснение закономерностей эволюции эписистемы на популяционном, организменном, органном и клеточном уровнях является ключевым в изучении экологии возбудителя заболевания, основывается на системном подходе и имеет важное значение для всеобъемлющего понимания причин развития болезни, устойчивости макроорганизма, вирулентности возбудителя, и, в значительной мере, разработки средств контроля заболевания, в том числе и специфической профилактики.
В мировой литературе имеется значительное число монографических работ, обзоров и оригинальных статей, посвященных туберкулезу, но монографии, содержащие обобщенные классические и современные аспекты этого заболевания у крупного рогатого скота, а также общебиологические закономерности развития туберкулеза у других видов животных и человека, в Российской Федерации и Украине в последние годы не издавались.
Главная цель настоящего издания – обобщить представления о фундаментальных достижениях в изучении туберкулеза крупного рогатого скота, более подробно изложить данные об этиологии микобактериальной инфекции, патогенетических основах ее возникновения и развития, особенностях иммунитета и вакцинопрофилактики, а также эпизоотологических закономерностях распространения заболевания в пространстве и времени, в том числе на основе результатов собственных исследований. Значительное внимание уделено характеристике методов диагностики инфекции, а также управлению эпизоотическим процессом в соответствии с современными технологиями выявления и удаления из эпизоотической цепи источников ее возбудителя.
Надеемся, что эта монографическая работа будет полезна для научных работников и практиков ветеринарной медицины, студентов, всех, кто занимается решением проблем туберкулеза человека и животных.
Будем искренне благодарны коллегам за объективную оценку этого труда, всем, кто выскажет свои замечания и пожелания, которые будут учтены в нашей дальнейшей работе, посвященной такой многовековой проблеме как туберкулез животных.
Выражаем искреннюю и глубокую благодарность за оказание методической и практической помощи при подготовке материалов монографии академикуНААН и РАН В.А. Бусолу, научному консультанту, директору Национального научного центра «Институт экспериментальной и клинической ветеринарной медицины» академикуНААН и РАСХН Б. Т. Стегнию, академику НААН Г.А. Красникову, члену-корреспонденту НААН А.И. Завгороднему, а также всем сотрудникам ННЦ «ИЭКВМ» (г. Харьков»), профессору Конраду Захсе (институт Лефлера, г. Йена Германия), принимавших участие в научных исследованиях, результаты которых освещены в данном издании.
ВОЗБУДИТЕЛИ ТУБЕРКУЛЁЗА И ИХ ИЗМЕНЧИВОСТЬ
Исторические документы и материалы свидетельствуют о повсеместном распространении туберкулёза в далёком прошлом. По данным Р.Т. Сосова (1974) еще за 9-12 тысяч лет до появления на земле человека имело место заболевание туберкулезом животных. Об этом свидетельствует туберкулезное поражение костей у крокодила, выявленное при раскопках слоев мезозойской эры (юрский период) [31]. Наиболее древняя находка, указывающая на заболевания туберкулёзом людей, принадлежит Бартельсу. В 1904 году при обследовании найденного вблизи Гейдельберга скелета человека, жившего в каменном веке (приблизительно за 5000 лет до н. э.), установлены туберкулёзные поражения нескольких грудных позвонков с образованием горба. Изменения в позвоночнике, а также поражения крупных суставов конечностей со свищами, обнаруживали на мумифицированных трупах египтян, живших в 2000–2750 гг. до н. э. Кислотоустойчивые микобактерии были выделены из мумий, обнаруженных в Перу и относящихся к 700 г. н. э. [44]. О туберкулезе писали Гален, Авицена. Эти данные свидетельствуют о том, что история туберкулеза зарождалась в условиях развития животного мира и человеческого общества.
После того как врачи получили возможность вскрывать трупы, был обнаружен основной признак туберкулёза – образование в пораженных тканях специфических узелков (туберкулов). Сильвей де ла Бос в ХVII веке описал туберкуломы, а Бойль в 1809 г. проследил их развитие от начала образования до стадии творожистого распада. Лаенек в 1819 г. написал классическое произведение, названное им «Туберкулёз». В 1843 г. Клинке заразил кролика материалом от больного человека, а Виллемин в 1865 г. подтвердил заразность туберкулёза в опытах на морских свинках и кроликах, после этого туберкулёз был отнесен к инфекционным заболеваниям.
После открытия немецким ученым Р. Кохом в 1882 году возбудителя туберкулёза, русские ученые И. И. Мечников, Н. Ф. Гамалея, О. Буйвод, Г. А. Захарьин, В. Л. Яхнис, М. М. Цехновицер, П. П. Вишневский, В. Н. Матвеев, А. И. Каграманов, М. К. Юсковец внесли свою лепту в изучение этого заболевания [32].
Вскоре были обнаружены и другие кислотоустойчивые микобактерии, но их эпидемиологическое и эпизоотическое значение было проигнорировано, пока не были выяснены их патогенные свойства. Эти микобактерии были обозначены как атипичные.
На протяжении веков заболевания, вызываемые микобактериями туберкулеза, были и остаются наиболее серьёзной проблемой как гуманной, так и ветеринарной медицине. Необходимо отметить, что более 1,5 млрд. людей, т.е. почти 30% мирового населения, инфицированы этим микробом. В настоящее время туберкулёз остается основной причиной смерти от инфекционных заболеваний (5–10 млн. умерших ежегодно). МБТ являются причиной 7 % всех смертей от заболеваний, вторичных по отношению к инфекционным заболеваниям, и 26 % смертей от всех инфекционных заболеваний, которые можно предупредить [5]. Кроме того, микобактерии туберкулеза могут быстро адаптироваться к меняющимся условиям и внутри, так и вне хозяина [54]
Микобактерии туберкулеза (МБТ) – факультативные внутриклеточные паразиты. МБТ относятся к семейству бактерий Mycobacteriacae, порядкуActinomycetalis, родуMycobacterium.
Этимологически слово «микобактерия» происходит из греческих слов myces– гриб иbacterium,bactron– палочка, прутик. Компонент названия «гриб» обусловлен тенденцией этих микроорганизмов образовывать нитчатые и ветвящиеся формы, похожие на плесень [38].
Патогенными для человека и животных являются: Mycobacterium tuberculosis, M. bovis, M. avium, M. lepre, M. africanum, M. paratuberculosis, потенциально патогенными – M. intracellulare, M. scrofulaceum, M. xenopi, M. ulcerans, M. kansasii, M. murinum, M. fortuitum, M. chelonei. Остальные виды оказывают сенсибилизирующее действие на сельскохозяйственных животных и при массовом заражении обладают незначительными патогенными свойствами.
У человека и животных заболевания, сходные с туберкулёзом,вызывают также микобактерии комплекса MAIS (M. avium–intracellulare–scrofulaceum).
В род Mycobacteriumвходят свыше 30 самостоятельных видов бактерий. Кроме того, 11 видов не классифицированы. В целом микобактерии принято делить на 3 группы:
1. Патогенные микобактерии
2. Атипичные микобактерии
3. Кислотоустойчивые сапрофиты.
Патогенные микобактерии включают следующие виды: микобактерии туберкулёза человеческого вида, микобактерии туберкулёза бычьего вида, микобактерии туберкулёза птичьего вида и M. africanum.
Из указанных патогенных микобактерий М. avium относят к третьей группе атипичных микобактерий, хотя они являются типичным возбудителем туберкулёза птиц и патогенны для свиней и животных некоторых других видов.
Атипичные микобактерии в соответствии со схемой Раньона разделены на четыре группы в зависимости от хромогенеза на свету или вне зависимости от влияния света.
К первой группе относятся фотохромогенные, «желтые» или канзасские микобактерии, впервые выделенные в США. Представителями этой группы являются М. kansasii, M. marinum и др. При длительном выращивании с доступом света культуры могут становиться оранжевыми или кирпично-красными. Они патогенны для хомяков и белых мышей при внутривенном и внутрибрюшинном заражении. Культуры дают рост при 37°С через 7–12 дней, а при комнатной температуре через 3–4 недели.
Ко второй группе отнесены скотохромогенные микобактерии, имеющие оранжево-желтую окраску, независимо от того – выращивались они на свету или в темноте. К этой группе относятся М. scrofulaceum, М. gordonae, М. flavescens, М. aque. Они не патогенны для лабораторных животных. Выделяются при исследовании промывных вод желудка и бронхов и из пораженных лимфатических узлов. При 22°C растут с образованием в темноте желто-оранжево-красного пигмента.
К третьей группе относятся нефотохромогенные, непигментированные микобактерии или имеющие желто-розовую окраску. К этой группе отнесены М. avium, M. intracellulare (M. batley), M. qastri, M. triviale, M. terrae, M. xenofri и др. Микобактерии этой группы могут расти на простых питательных средах как при комнатной температуре, так и при 45°C.
Неспецифические (парааллергические) реакции на туберкулин часто обусловлены инфицированием животных некоторыми атипичными нефотохромогенными микобактериями. Патогенность установлена для свиней, кур, а для крупного рогатого скота остается невыясненной.
Четвертую группу атипичных микобактерий, так называемых сапрофитов быстрорастущих, непигментированных составляют М. phlei, M.fortuitum (M. minettiet, M. giae), M. smegmatis, M. vaccae, M. chelonei и др.
Микобактерии этой группы дают рост при 20°C в течение 3–5 дней, кислоустойчивы, непатогенны для морских свинок, они растут и при 37°C, но не растут при 45°C. Среди микобактерий этой группы имеются как пигментообразующиe, так и не имеющие такого свойства.
Атипичные микобактерии широко распространены в природе и являются сапрофитами. Однако, попадая в организм животных, они способны размножаться, особенно при ослаблении иммунной системы. У людей атипичные микобактерии вызывают патологоанатомические изменения, которые не отличаются от туберкулёзных.
О происхождении атипичных микобактерий единого мнения нет. Одни авторы утверждают, что это самостоятельный вид, другие, что произошедший от типичных микобактерий, а третьи – из сапрофитных.
В последние годы появилось очень много работ о филогенетическом единстве возбудителей туберкулёза бычьего и человеческого видов. Так, при изучении 40 штаммов микобактерий (10 штаммов человеческого вида, 11 штаммов M. africanum, 13 штаммов M. bovis и 6 штаммов M. microti) с помощью 88 различных тестов не удалось дифференцировать M. bovis от человеческого вида. Эти данные позволяют рассматривать M. africanum как вариант M. bovis. Также было показано, что M. microti филогенетически тесно связаны с M. bovis и дифференцируются от бычьего вида лишь по способности продуцировать ниацин, а также по наличию никотинамидазной и пиразинамидной активности. Это позволяет сделать вывод, что M. bovis и M. tuberculosis humanus являются подвидами одного вида M. tuberculosis.
В. Ф. Романенко с соавт. [29] путем экспериментальных исследований установили, что при длительном пребывании в организме не свойственного хозяина типично патогенные МБТ с устойчиво сложившимися биологическими признаками теряют ряд исходных свойств и постепенно приобретают новые, включая и видовые, характерные для возбудителя туберкулёза, специфического для животных, через организм которых они пассировались. M. tuberculosis, M. bovis и M. avium сенсибилизируют организм не свойственного им хозяина, обуславливая высокий титр специфических антител, постепенно адаптируясь, вызывают заболевания, сопровождающиеся характерными патологическими изменениями и даже развитием генерализованной формы туберкулёза. По заключению авторов, все три вида микобактерий: M. tuberculosis, M. bovis и M. avium – производные единого возбудителя, возникшие в результате длительного эволюционного процесса и их адаптации к определенному виду животных, птице или человеку.
А. С. Донченко и В. Г. Мерман [10] сообщают о паразитировании возбудителя туберкулёза человеческого вида в организме крупного рогатого скота – авторами из патологоанатомического материала внутренних органов 281 животного выделено 13 культур M. tuberculosis. Итальянскими учеными из пораженных лимфатических узлов от больных туберкулёзом свиней выделен возбудитель туберкулёза бычьего вида, что свидетельствует о межвидовой патогенности M. bovis и его полиморфизме.
Изложенные литературные данные дают возможность предполагать, что видовая дифференциация МБТ не закончена. Способность всех видов микобактерий сенсибилизировать невидоспецифические организмы и приобретать свойства того вида микобактерий, в организме которого они паразитируют, указывает на филогенетическое единство всех патогенных микобактерий. Все вышеизложенное позволяет сделать вывод, что в настоящее время без применения специфических средств защиты животных от патогенных микобактерий оздоровить и удерживать благополучие животноводства относительно этой инфекции весьма затруднительно.
По сравнению с микобактериями туберкулёза, атипичные микобактерии обладают пониженной кислото-, щелочеустойчивостью, что приводит их к гибели при обработке патматериала классическими методами с использованием серной кислоты или едкого натра. Поэтому важную роль при выделении атипичных микобактерий из патматериала будет играть использование более щадящих средств для подавления посторонней микрофлоры. Необходимо отметить, что в настоящее время под влиянием различных причин, в том числе лекарственных препаратов, произошли изменения биологических характеристик микобактерий. В частности, они проявляются в полиморфизме и появлении дефектных по клеточной стенке микобактерий, а также безоболочечных L-форм.
Нуклеотидный состав микобактерий колеблется в широких пределах, что свидетельствует о значительной гентической гетерогенности рода Mycobacterium, отмечаются также и штаммовые различия.
Так, Slosarec [79] при исследовании 16 штаммов M. avium, обнаружил значительные расхождения в составе их нуклеиновых кислот, а Sikorska с соавт. [80], изучив 5 различных штаммов «M. bovis-8», установили, что в их нуклеотидной последовательности количество пар гуанин+цитозин (ГЦ) колебалось от 62,7 до 67,4 %.
И. Н. Блохина с соавт. [4], анализируя данные литературы по нуклеотидному составу ДНК различных видов бактерий, также указывают на гетерогенность рода Mycobacterium, а Ю. Е. Брудная [7] также на трудность дифференциации возбудителя туберкулёза, имеющих 62,0–70,3 % ГЦ, от условно-патогенных (64,1–70,9 % ГЦ) и сапрофитных видов (64,7–73,0 % ГЦ) микобактерий.
Различия в степени генетического полиморфизма штаммов МБТ хорошо освещены в работах M. W. Borgdorff, N. Nagelkerke, D. Van Soolingen et al. [49], D. L. Cohn, R. J. Obrien [57], V. N. Stepashina et al. [82].
И. Г. Шемякин [42] на основании анализа генетического полиморфизма полевых форм штаммов M. tuberculosis, выделенных в разных регионах РФ, сделал вывод, что это свидетельствует о эндогенно реактивированном воздействии защитных сил организма.
Микобактерии туберкулёза (рис. 1) – тонкие палочки длиной от 0,5 до 0,8 микрона, неподвижные, спор не образуют, спирто-, щелоче-, кислото- и антиформиноустойчивые. Кислотоустойчивость микобактерий используется для дифференциации их от других некислотоустойчивых бактерий. Туберкулёзная палочка содержит жировоск и поэтому плохо воспринимает краски, но будучи окрашенной при нагревании карболфуксином лучше удерживает эту краску, чем другие микроорганизмы.
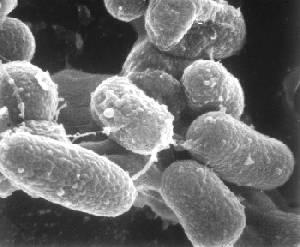
Рис. 1. Внешний вид микобактерий в сканирующем микроскопе
При обработке мазков слабым раствором серной кислоты туберкулёзные бактерии окрашиваются фуксином в красный цвет, а другие микробы обесцвечиваются – метод окраски по Циль–Нильсену (рис. 2).
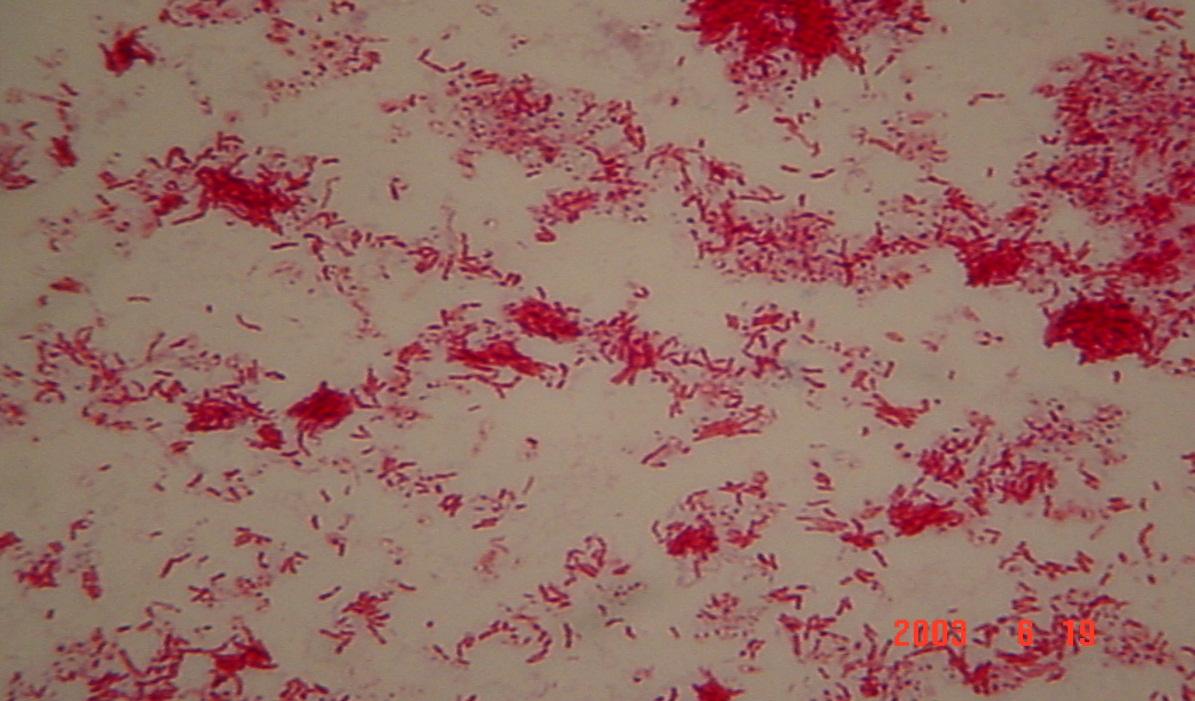
Рис. 2. Микобактерии туберкулёза (окраска по Циль-Нильсену)
У крупного рогатого скота с туберкулёзным поражением лёгких в 1 грамме мокроты может быть до 11 тысяч туберкулёзных бактерий, а больная корова способна выделять в сутки с фекалиями в среднем 35–40 млн. микобактерий, при кашле животные выбрасывают капельки мокроты на расстояние до 2 метров, в каждой из которых может содержаться до 250 микобактерий.
В среднем в 1,0 мг полувлажной (слегка отжатой между стерильными листками фильтровальной бумаги) культуры микобактерий содержится около 40 млн. микробных клеток.
Для ориентировочного определения вирулентности культур рекомендуется вводить под кожу паха морским свинкам от 0,00001 мг. Культура высокойвирулентности вызывает гибель морских свинок от введения 0,00001 мг через 3–4 месяца, от 0,001 мг – через 2 месяца, а слабовирулентная – от 0,001 мг через 5–6 месяцев.
Для ослабленных микобактерий следует применять более высокие дозы заражения в пределах 0,1–1,0 мг.
Морфологической особенностью микобактерий туберкулёза является наличие зернистости, т. н. зерен Муха. Количество зерен колеблется в пределах от 2 до 12. Они играют важную роль в сложном цикле развития и размножения микобактерий. Кроме того, микобактерии могут размножаться путем поперечного деления (рис. 3) [43].
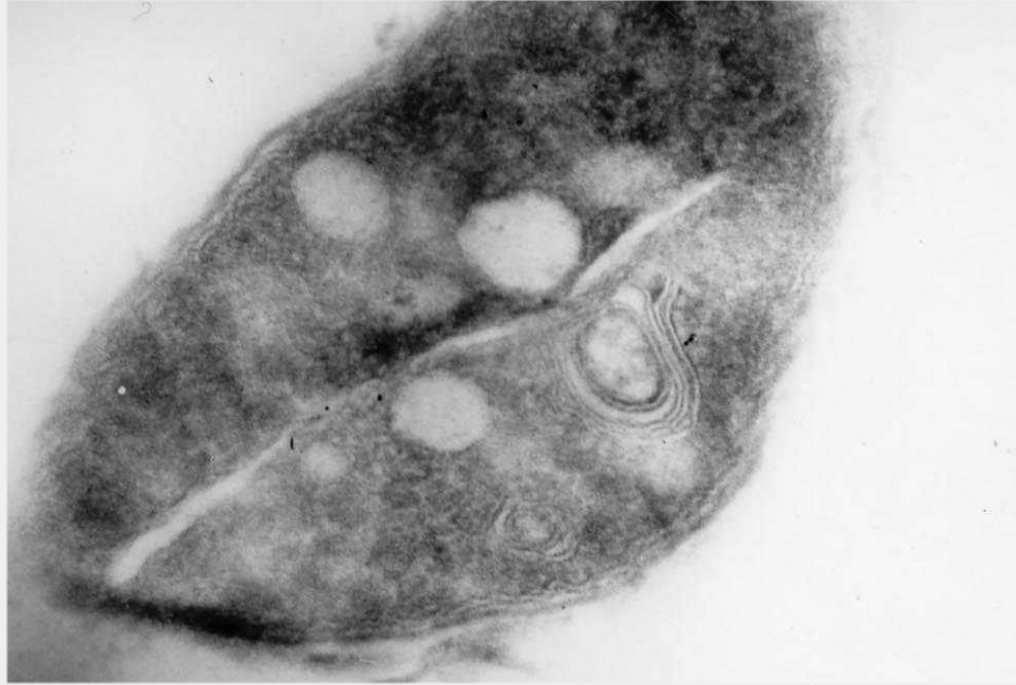
Рис. 3. Деление клетки M. bovis (срез под электронным микроскопом)
Оптимальной температурой роста микобактерий являются: 37–38°C для человеческого вида, 38–39°C – для бычьего вида и 39–41°C – для птичьего.
Микобактерии туберкулёза устойчивы к высушиванию, гниению и низким температурам. Они могут переносить температуру жидкого азота и гелия (–199°C, –260°C), замораживание до – 76°C. В молоке и сливках при – 8°C сохраняются до 120 дней, в навозе 2–12 месяцев, в сточных водах – до 15 месяцев. Прямые солнечные лучи убивают их за 1–2 часа. Во влажном состоянии гибель микобактерий наступает при 55°C – через 4 часа, при 70°C – через 10 минут, при 90°C – через 1 мин и при 100°C – моментально.
Клетки микобактерий туберкулёза совершенно не смачиваются водой. Гидрофобность с одной стороны придает клетке устойчивость к действию различных растворенных в воде токсических веществ, а с другой стороны затрудняет обмен клетки с окружающей средой, поступление питательных веществ и замедляет в целом рост микобактерий. Поэтому в наших исследованиях по выделению и выращиванию микобактерий туберкулёза на плотных средах с успехом использовано добавление поверхностноактивной синтетической и питательной среды Курской биофабрики с 5–7% сыворотки крупного рогатого скота или кролика и 5–10% картофельного экстракта.
Некоторые актиномицеты и микобактерии имеют усложненную структуру оболочки. Все эти микроорганизмы являются грамположительными и относятся к фирмакутным.
Из микобактериальной оболочки кроме капсулы выделены 4 компонента:
1) основа оболочки, образованная муреином, ковалентно связанным с миколатом арабиногалактона;
2) свободные липиды, т.е. липиды, которые могут быть удалены нейтральными растворителями;
3) пептиды, которые могут быть удалены при обработке оболочек протеазами. Сюда относится частично глутаминовая кислота;
4) глюкан, присутствующий в оболочке некоторых штаммов микобактерий.
Характерным компонентом оболочки микобактерий являются миколовые кислоты, представляющие собой разветвленные гидрокислоты.
Миколовые кислоты играют решающую роль в кислотоустойчивости микобактерий, которая заключается еще в способности бактерий удерживать краску при обработке кислотой. Метод соответствующей окраски предполагает использование красок, обладающих сродством к липидам. Поэтому при использовании фуксина и ряда других красителей в раствор добавляют фенол, придающий окраске гидрофобность. Микобактерии туберкулёза теряют кислотоустойчивость после обработки горячей разведенной соляной кислотой. Кислотоустойчивость (кислотоупорность) – важный диагностический признак микобактерий, который является своего рода их родовым признаком.
У сапрофитных микобактерий наличие миколовой кислоты определяет способность их к использованию гидрофобных субстратов. Кислотоустойчивость сапрофитных микобактерий может изменяться в зависимости от возраста культуры, углеводородного состава питательной среды, что связано с увеличением в этих условиях содержания в оболочках миколовых кислот.
С миколовой кислотой связано и наличие в микобактериях так называемого корд-фактора, свойственного только микобактериям.. При высеве бактерий на жидкие питательные среды он обеспечивает сближение клеток, которые выстраиваются в виде кос, жгутов (кордов) (рис. 4.) [36].
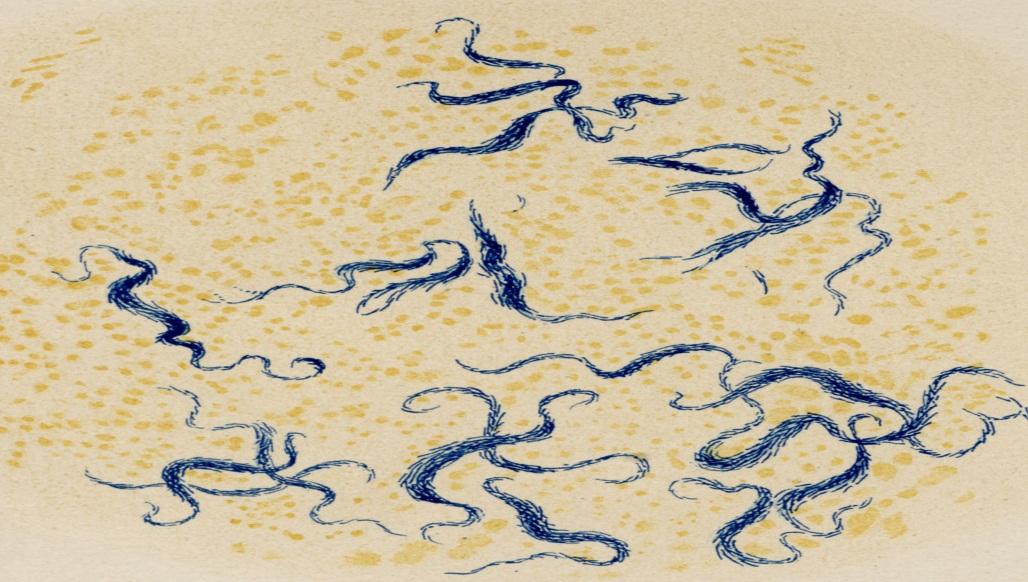
Рис. 4. Для возбудителя туберкулёза характерен полиморфизм (нитевидные, ветвистые, зернистые и другие формы) (рисунок Р. Коха)
Химически корд-фактор представляет собой производное миколовой кислоты - 6,6-димиколат трегалозы и обусловлен наличием проксимального циклопропана в α-миколовых кислотах [51]. В литературе имеются данные [17, 21, 69], что микобактерии туберкулеза с низкими вирулентными свойствами имеют незначительное количество корд-фактора. Так, А.А. Ткаченко и соавт. (2012) [34], установили, что микобактерии исходной культуры быстрорастущего штамма M. bovis при выращивании на плотных яичных средах с рН 6,6 и 7,0-7,2 на 15-20-е сутки формировали четко выраженные «косы» и «тяжи», на 35-40-е сутки – рост колоний усиливался. При проведении последовательных культуральных пассажей наблюдалось снижение способности формировать характерные микроколонии. Так, если средняя ширина «кос» исходной культуры была 15 мкм, то после 60-го пассажа этот показатель составлял 10 мкм. При этом снижалась и патогенность культур – морские свинки после заражения ними гибли на 41-44-е сутки и 59-68-е сутки соответственно. Изучаемые показатели, которые характеризуют интенсивность проявления корд-фактора вакцинногоштамма BCG, были низкими – наблюдаются скопления клеток, лишь напоминающие косички с шириной 2-3 мкм. [46].
Корд-фактор характерен также и для атипичных микобактерий, хотя его проявления менее выражены, чем у патогенных штаммов. Так, М. phlei,M.vaccaиM.xenopiпри культивировании образуют микроколонии в виде «кос» и «жгутов», но их ширина составляет 40 мкм, 2-5 мкм и 5 мкм соответственно.
В ряде литературных источников [21, 34, 69] констатируется, что образование жгутов при выращивании микобактерий, связанное с корд-фактором, является подтверждением патогенности бактерий. Однако исследованиямиBrambilla C. и соавт., (2012),[51] проведенных с помощью сканирующей электронной микроскопии было показано образование жгутов с образованием истинных связок при выращивании микобактерий, не относящихся к туберкулезным: Mycobacterium brumae и Mycobacterium fallax.
Строение клеточной стенки микобактерий
Обобщая обширные литературные данные о клеточной стенке микобактерий можно констатировать, что она – самая сложная по сравнению с оболочкой клеток остальных прокариот. Так, если грамотрицательные бактерии имеют две мембраны, клеточная стенка микобактерий состоит из нескольких слоев, часть из которых содержит сахара и имеет относительно постоянный состав. Наружные слои состоят из липидов, в основном миколовых кислот и их производных и характеризуются вариабельностью химического состава. При классической электронной микроскопии эти слои, как правило, не видны (электроннопрорсвечиваемый слой, зона низкой плотности). Каркас клеточной стенки составляют пептидогликаны (электронноплотный слой) и связанные с ними арабиногалактаны (полисахаридная строма), к которым крепятся миколовые кислоты и их производные. Миколовые кислоты присутствуют в клеточной стенке также в виде сульфолипидов и корд-фактора. Кроме того, в состав клеточной стенки входит липоарабиноманнан(LAM), который крепится на плазматической мембране, пронизывает всю клеточную стенку и выходит на ее поверхность. Биологическая роль конечных фрагментов липоарабиноманнана, в основном его маннозных радикалов, состоит в подавлении активации Т-лимфоцитов и лейкоцитов крови, что приводи к нарушению иммунного ответа на микобактерии[36].
Было также установлено, что около 10–15% массы оболочек микобактерий составляют пептиды, не входящие в состав муреина, хотя ковалентно связаны с ним и могут быть разрушены протеолитическими ферментами.
У вирулентных микобактерий в оболочке содержится полиглутаминовая кислота, составляющая несколько процентов от массы оболочек. Оболочка микобактерий имеет толщину 20–40 мкм и состоит из 3 и более слоев, выявляемых на срезах бактерий. Распределение различных компонентов оболочки в этих слоях до конца не установлено, но поверхность клеток гидрофобна.
Существование внешней двухслойной мембраны микобактерий было постулировано уже давно, но с помощью электронной микроскопии ультратонких срезов этого нельзя было непосредственно наблюдать. B. Zuberи соавт. (2008)[61] использоваликрио-электронную микроскопию с образованием стекловидного льда (CEMOVIS) для подробного ультраструктурного анализа трех видов бактерий подотряда Corynebacterineae, а именно, Mycobacterium bovis БЦЖ, Mycobacterium smegmatis и Corynebacterium glutamicum. При этом было установлено, что миколовые кислоты связаны с комплексом пептидогликаны-арабиногалактаны микобактерий нековалентны и имеют важное значение для формирования внешней мембраны. Кроме того, в зернистом слое и зоне низкой плотности проявляется периплазматическое пространство. На основании этих исследований авторы предлагают модель организации липидов в наружной мембране (рис. 5) и подчеркивают, что она должна служить ориентиром для будущих исследований, направленных на определение связи структуры клеточной оболочки микобактерий и ее функции.

Рис. 5. Модель–«молния» углеводородных цепей липидов клеточной стенки (в маштабе) микроорганизмов подотрядаCorynebacterineae у – микобактерий (А) и коринебактерий (В). (Черный цвет –миколовые кислоты; темно-синий – фосфолипиды (16 - до 18-углерод-длинные цепи); темно-серый – комплекс пептидогликанов-арабиногалактанов, светло-голубой – гликопептидолипиды, светло-серый – порин, оранжевый – трегалозодимиколат, красный – трегалозомономиколат) [61].
Оболочка микобактерий обладает высокой биологической активностью, в т.ч. адъювантной. Miyauchi M, и соавт. (2011) [46] установили иммуностимулирующее и ададьювантное действие арабиномиколовых кислот, выделенных из клеточной стенки микобактерий BCG путем кислотного гидролиза. Было показано, что они содержат такие фракции как моно-арабинозы миколат, пента-арабинозы тетрамиколат и гекса-арабинозы тетрамиколат. Введение мышам арабиномиколовых кислот индуцировало фактор некроза опухоли (ФНО-α) на уровне, сравнимом с BCG, а также повышало реакцию гиперчувствительности замедленного типа на опухолевые клетки.
Широко известен и используется полный адъювант Фрейнда, состоящий из убитых клеток микобактерий (обычно БЦЖ), добавленных к неполному адъюванту. Последний представляет собой суспензию минерального масла в воде, содержащий антиген. Добавление клеток микобактерий значительно усиливает эффект адъюванта. Введение клеток БЦЖ в маслянной эмульсии придает животным неспецифическую устойчивость к инфекции, в т.ч. к заражению неродственными микобактериями. Этот эффект отчасти зависит от присутствия «корд-фактора». Подобной активностью не обладает ни одна биологическая субстанция.
В последнее время установлено, что клетки микобактерий туберкулёза, их фрагменты и компоненты, в т.ч. «корд-фактор», обладают антиопухолевой активностью, что связано частично с цитотоксичностью, проявляющейся на уровне митохондрий.
В то же время остается до конца не выясненным вопрос о устойчивости микобактерий к высоким температурам, сопряженный с проблемой безопасности применения туберкулина. Так, В. В Власенко (1998) ) [9] и А.П. Лысенко и соавт. (2007) [13] учитывая результаты изучения термической устойчивости возбудителя туберкулеза путем посева на авторскую питательную среду ВКГ автоклавированных препаратов и туберкулинов, а также исследовании свойств полученных культур микобактерий приходят к следующим выводам:
– автоклавирование при 120 С инактивирует патогенные формы возбудителя туберкулеза, но не предотвращает образование жизнеспособных защитных форм микобактерий типа спор;
– инкубирование автоклавированных препаратов возбудителя туберкулеза в симуляторе роста ВКГ и посев на питательную среду ВКГ обеспечивают прорастание адаптивных форм, имеющих общие антигены и участки ДНК с бактериальной формой возбудителя;
– изоляты, выделенные из образцов туберкулинов способны персистировать в организме морских свинок и в ряде случаев вызывать ГЧЗТ к туберкулину и частично восстанавливать кислотоустойчивость.
Однако возможность восстановления патогенности этими адаптивными формами возбудителя туберкулеза установлена не была.
Оценивая публикации об особенностях устойчивости возбудителей туберкулеза к антимикобактериальным факторам физической и химической природы приходим к выводу, что каждая научная статья вносит свою лепту в познание до сего времени таких «непознанных» биологических свойств как сохранение вида в постоянно меняющейся биологической и абиотической среде. Среди них экспериментальные работы вышеназванных авторов о термической устойчивости микобактерий, по нашему мнению, относятся к побуждающим активизацию фундаментальных исследований по проблеме туберкулеза человека и животных.
Появление этих и предыдущих публикаций вышеназванных авторов о воссоздании живых M. bovis после автоклавирования при 120 С в течении 30 мин., а также туберкулинов различных производителей вызвало всплеск дискуссий, подобно тем, которые были в конце XIX–начале ХХ столетий после сообщений в 1891 годуStrausи Cameliaо способности автоклавированных микобактерий вызывать у животных «некротуберкулез» иCranher,Ledoux-Lebard(1901 г.), – о способности высушенной культуры возбудителя туберкулеза сохранять жизнеспособность после пребывания в среде при температуре 100 С.
Далеко не научной критикой, при отсутствии дискуссии и теоретических доводов, в свое время было встречено сообщение Г.М. Бошьяна (1949) о возможности выращивания микобактерий на питательной среде после посева туберкулина [6].
Большинство не согласных с данными этих авторов высказывали свое мнение, как правило, кулуарно, обходя научные и «печатные» трибуны. Среди тех, кто вступил в публичную дискуссию с авторами ХХIвека, был профессор, академик Национальной академии аграрных наук Украины Бусол В.А. в статье «Суд над туберкулином» [8] привел доводы не столько о неспособности M. bovis расти после автоклавирования, сколько о невозможности сохранять такое свойство как вирулентность, а также другие видовые свойства возбудителя инфекции.
В публикациях отсутствовали теоретические доказательства способности болезнетворных микобактерий сохранять вид, а также генотипичные и фенотипичные свойства после воздействия температур выше 100 С0, что может быть связано с отсутствием исследований в этом направлении на молекулярном уровне. В преддверии выхода названных публикаций бытовала еще классическая биология, в которой, как утверждает А. Хорст (1982), преобладали абстрактные представления о «жизненных» процессах. В молекулярной биологии понятие «жизненного» процесса в макро– и микроорганизме заменяется обычными физико-химическими представлениями. Это позволяет формировать новый методический подход при изучении проблем патогенеза болезней заразной и незаразной патологии и распознать развитие патологии в системной биологической цепочке: геном–клетка–организм. В связи с этим автор отмечает, что генетический код, репликация ДНК, процессы транскрипции и трансляции достаточно сложны и заключают в себе столько возможностей их нарушения и только постоянная аутокоррекция способна препятствовать этому. Что касается механизмов репарации нуклеиновых кислот, то они так же важны, как и механизмы репликации и трансляции. Поэтому понимание этих и других процессов изменения в структуре ДНК может существенно расширить наши знания о действии на микроорганизмы высоких температур [40].
Учитывая вышесказанное, для более глубокого понимания биологии M. bovis и механизмов его устойчивости к различным факторам, в т.ч. и высокотемпературным, необходимы новые методические подходы, базирующиеся на молекулярных механизмах, особенно изменчивости и устойчивости ДНК.
Особенности капсулы микобактерий
По данными литературы [69; 70; 73; 78] все микобактерии обладают очень своеобразной капсулой из молекул жирных кислот, структура и функция которых до конца не изучена. Эта оболочка позволяет микобактериям выдерживать весьма суровые условия окружающей среды и выживать внутри клеток иммунной системы человека и животных (макрофагов), где все другие микробы погибают, будучи растворены с помощью ферментов. Помимо этого, капсула микобактерий кислотооустойчива и не пропускает обычные антибиотики.
При исследовании с помощью электронного микроскопа динамики фагоцитоза микобактерий туберкулеза человека, крупного рогатого скота и других патогенных микобактерий было обнаружено формирование электрон-просвечиваемой зоны (electron transparentzone, ETZ) (рис. 6).
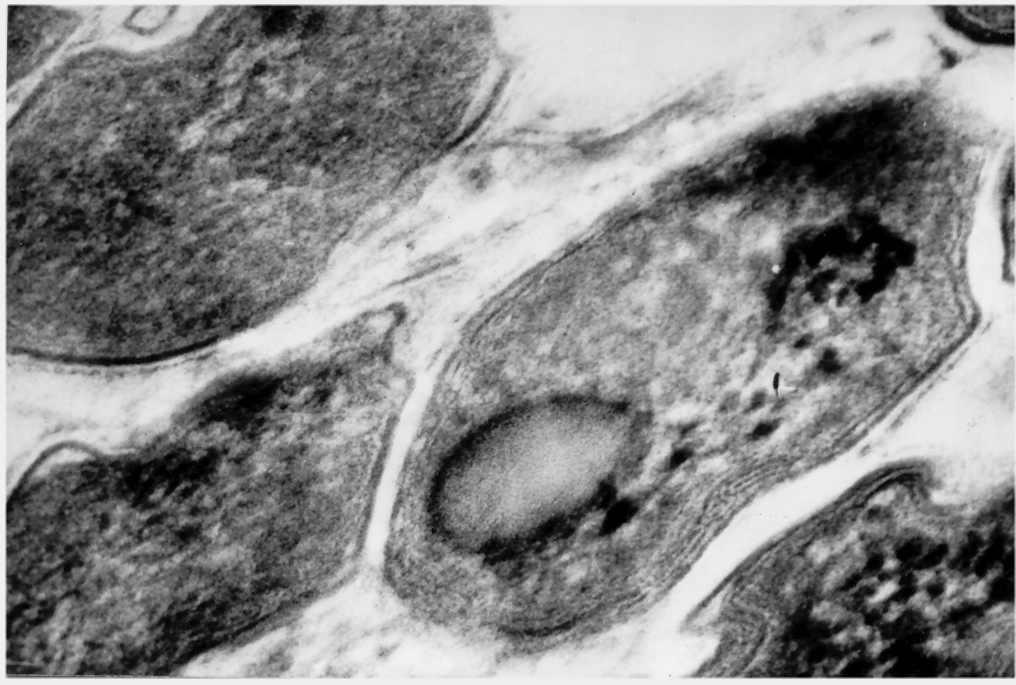
Рис. 6. Вид колонии микобактерий (срез) под электронным микроскопом (Mycobacterium bovis) с видимой капсулярной и электрон-просвечиваемой зоной (ETZ)
Многие авторы связывают наличие ETZс резистентностью микобактерий к ферментам фагоцитов, что обуславливается архитектоникой клеточной стенки. В ранних исследованиях этого феномена высказывалось предположение, [78], что сульфатиды и полиглутаминовая кислота клеточной стенки микобактерий туберкулеза могут быть вовлечены в феномен торможения слияния между фагосомами и лизосомами. В то же время у М. leprae и М. lepraemurium, у которых такого торможения не наблюдалось, было установлено наличие широкой ETZ, которая состоит из мукоидов. Этот слой должен препятствовать диффузии лизосомальных ферментов внутрь фагосом. Поскольку ETZ не существует в микобактерии до фагоцитоза, была поставлена задача увидеть, когда и как она формируется внутри макрофагов. При сравнении динамики образования ETZ в М. leprae и М.aviun, которые оба содержат мукоиды, фагоцитированных макрофагами клеток костного мозга мыши, было установлено, что у М.aviunETZ появились в пределах от 1 до 2 часов после фагоцитоза. Это напоминало образование своего рода«опухоли»тонкого электронного прозрачного слоя клеточной стенки бактерий, которая наблюдалась в участках, где внешний слой полисахарида начинал исчезать. После 3-х часов инкубации этот слой полностью отсутствовал и все бактерии были окутаны густой ETZ. В М. leprae ETZ также формируется в течение одного часа после поглощения макрофагом.
Было также выявлено, что ETZ формируется также быстро в макрофагах, инфицированных инактивированными клетками M. aviumили М. leprae Это показывает, что для образования такой зоны не требуется активного участия бактерий. ETZ значительно уменьшает распространение лизосомальных ферментов на бактерии у обоих видов, причем в М. leprae это оказалось особенно выраженным, поскольку, несмотря на присутствие кислой фосфатазы во многих фагосомах, ни количество бактерий в макрофагах, ни состояние их деградации не изменялись в течение 3,5 месяцев культивирования макрофагов [78].
При проведении количественной оценки частоты проявлення ETZ в разное время после заражения макрофагов бактериями из гладких и прозрачных (smooth transparent (SmT)) колоний M. аviumнаблюдается более выраженная прозрачная зона и большее количество неповрежденных бактерий, чем при фагоцитировании бактерий из гладких куполообразных и непрозрачных (smooth domed-opaque (SmD)). При инфицировании макрофагов инактивированными УФ- или гамма-лучами, H2O2, теплом или глутаральдегидом ETZ была обнаружена у около 50% МБТ, тогда как для живых бактерий этот показатель составил 80-85% В отличие от живых бактерий, для которых процент частоты ETZ оставался стабильными на протяжении инкубационного периода, частота проявления ETZ для убитых бактерий снизилась с течением времени. При проведении сравнительной оценки проявления ETZ на микобактерииях туберкулеза штамма H37 Rv установлено, что несмотря на очень низкую частоту проявления ETZ (8-15%), доля интактных бактерий была идентична уровню с M. аvium, в отличие от трех быстро растущих непатогенных видов (M. smegmatis, М.phlei и М. fallax), которые характеризовались низкой частотой появления ETZ после фагоцитоза и быстрой деградацией. [69]
Необходимо отметить, что значительный массив исследований относительно капсулы микобактерий был проведен на возбудителе проказы – M. leprae – отдаленной родственницей палочки Коха, а установленные данные о структуре ее капсулы совпадают с таковыми у микобактерий туберкулеза.
В исследованиях M. E. Klegerman и соавт. (1996) [70] клеточная стенка микобактерий была визуализирована методом просвечивающей электронной микроскопии (ПЭМ) тонких срезов. Было установлено наличие внутреннего плотного слоя, который авторы связывают с пептидогликанами, также электронно-прозрачного арабиногалактанмиколатного слоя и электронно-плотного наружного слоя. ПЭM тонких срезов M. bovis БЦЖ, подштамма Tice, показало наличие бислоя, каждый из которых имеет ширину 2-4 нм. Ширина промежуточного электронно-прозрачного слоя варьировала от 1 до 250 нм, и представляет собой аморфную оболочку, которая состоит из водорастворимых нейтральных α-глюканов, которые составляют около 12% сухого веса клетки.
Применение к микобактериям новых микроскопических методов позволило увидеть толстую оболочку в образцах стерильных культур. Также было продемонстрировано, что обширная ETZ сходна с ETZ внутри фагосом и видна вокруг in vitro выращенных культур M. tuberculosis и M. avium, в отличие от непатогенных видов (M. smegmatis и M. aurum). Так, Paul T.RиBeveridge T. J. (1994) [74] с использованием техники замораживания-замещения исследовали архитектуру клеточной стенки медленно растущих микобактерий, M. kansasii, при росте в пробирке и установили, что большинство бактерий имело окружающее их электронно-полупрозрачное пространство или электронно-прозрачные зоны [ETZ], окружающих большинство клеток, как описано в более ранней работеYamamoto T. и соавт. (1958) [84].
При этом было выявлено по крайней мере два морфотипа микобактерий. Клетки первого имели относительно тонкий ETZ(11 ± 2,3 до 3,5 ± 3,1 нм), равномерно окружающий неизмененные клетки, содержащаяся в них цитоплазма заполнена хорошо окрашенными рибосомами, и ДНК-нуклеоиды распределены по всей клетке. Второй морфотип состоял из незначительного числа микроорганизмов, которые имели искаженную форму и были окружены гораздо более толстым (от 59 ±2,6 до 198±2,5 нм) ETZ в области клетки, которая, казалось, была втянута из места, которую она первоначально занимала [73]
Авторы также подтверждают липидную природу ETZ – исходя из того, что клетки были лишены ETZ после обработки нейтральными растворителями липидов (ацетон или этанол). Кроме того, при тонкослойной хроматографии полученных этанольных и ацетонных экстрактов был определен липидный компонент, который соответствовал конкретным фенольным гликолипидам М. kansasii. Полученные данные свидетельсьвуют, что метод замораживания-замещения в электронной микроскопии – надежный способ сохранения и индикации липидных полимеров, содержащихся в клеточной стенке микобактерий.
В противовес этому методу, при обработке клеток обычным способом для электронного микроскопирования, просвечивающий внешний слой сплющивается из-за обезвоживания и виден только тёмный верхний слой, отделённый от пептидогликанового электрон-просвечиваемым слоем. Этот артефакт объясняет, почему описание капсул микобактерий до не пор ограничено наличием плазматической мембраны и клеточной стенки. Техника замораживающего замещения исключает сокращение гидратированных структур, которые обычно образуются во время приготовления материала для электронного микроскопа, что минимизирует процесс экстракции растворимых липидов с помощью сочетания ультраскоростного замораживания и мягкой химической фиксации. Применение такого метода усиливает химические связи и стабилизирует клеточные структуры, что проявляется в более точном изображении морфологии микобактериальной капсулы. Некоторые микобактерии, обработанные таким путём, показывают обширное просвечивание наружного слоя, в котором виден слабо окрашенный тонкий слой [59]
В более поздних исследованиях, как указывает Brennan PJ(2003) [53] только применение ядерного магнитного резонанса,масс-спектрального анализа и определение генома микобактерий туберкулеза привели к глубокому пониманию не только структуры клеточной стенки микобактерий, но и основ их генетики и биосинтеза. По его представлению, архитектуру клеточной стенки составляет массивное «ядро», которое состоит из пептидогликана ковалентно связаного через линкер блока (L-Rha-D-GlcNAc-П) с линейным галактофураном, который в свою очередь, прикреплен к ряду сильно разветвленных нитей арабинофурана, которые в свою очередь прикреплены к миколиновым кислотам. Миколиновые кислоты ориентированы перпендикулярно к плоскости мембраны и обеспечивают действительно специальный липидный барьер, ответственный за многие физиологические и патогенные свойства микобактерий туберкулеза. Внедренными внутрь этой липидной среды являются липиды, которые интересовали исследователей на протяжении пяти десятилетий: корд-фактор, димиколилтрегалоза, сульфолипиды, фосфатидилинозитолы маннозидов и т.д. Также имеются данные о том, что миколиновые кислоты признаются CD1-ограниченными Т-клетками, что антиген 85, один из самых мощных защитных антигенов микобактерий туберкулеза, является миколилтрансферазой и липоарабиноманнан (LAM), взаимодействуя с короткими маннозоолигосахаридами, участвует в фагоцитозе микобактерий туберкулеза. В настоящее время исследования направлены на определение роли миколиновых кислот в "сигнализации" заражения, в патогенезе, а также в иммунном ответе, иногда по частям, а иногда и в организованном порядке.
Выявлению путей биосинтеза всех этих «экзотических» молекул (миколиновых кислот, микоцеростатов, LAM и полипренилфосфатов) способствует определение генома микобактерий туберкулеза. Например, известно, что синтез всего ядра будет инициироваться на декапрениле-P с синтезом линкерной единицы, что сопровождается наращиванием галактановых и арабинановых цепочек, пока этот интермедиат транспортируется через цитоплазматические мембраны. Последними шагами в этих событиях является прикрепление миколовых кислот и связывание пептидогликана [53].
Srinivasan V., и соавт (2012) [81] с помощью просвечивающей электронной микроскопии, исследовали участие трех слоев клеточной стенки (наружного гликопептидолипидного (ОL), среднего (ETL), содержащего арабиногалактан-миколовую кислоту и внутреннего – пептидогликанового (PGL) в формировании перегородки роста и сужения при делении быстрорастущих видов сапрофитных микобактерий (М. smegmatis) и медленно растущих видов патогенных микобактерий (М. xenopi и М.tuberculosis). Ими было установлено, что у M. smegmatis и M. xenopi при полном перегораживании сначала происходит свежий синтез PGL перегородки (S-PGL) и ETL перегородки (S-ETL) из PGL (E-PGL). Слои S-ETL и ETL (E-ETL) несоприкасаются между собой в связи с наличием E-PGL между ними. E-PGL исчезает, и S-ETL соединяется с E-ETL, когда GPL начинает расти и инвагинировать в S-ETL.
В тоже время у M. tuberculosis, S-PGL и S-ETL растут от E-PGL и E-ETL, соответственно, без разделения между E-ETL и S-ETL по E-PGL. Последующий рост и инвагинация GPL в S-ETL из раздела перегородки инициирует и завершает сужение перегородки. На рис. 7 представлена модель последовательного формирования полного микобактериального перегораживания, предложенная исходя из полученных результатов исследования, при котором формирование полной перегородки сопровождается ее сужением.
Авторы делают вывод, что защита места разделения перегородки наружным слоем до завершения процесса может придать эволюционное преимущество микобактериям. Это, вероятно, связано с двумя условиями. Во-первых, в отличие от E. coli и В.subtilis, которые растут и делятся примерно 20 минут, микобактерии растут медленно – М. xenopi делится один раз в 24 часа, микобактерия туберкулеза – один раз в 18 часов в естественных условиях, М. leprae делится один раз в 13,5 дней. Даже у так называемого "быстрорастущего" вида как М. smegmatis одно деление занимает около 3 часов. Во-вторых, патогенным видам, таким, как М. xenopi, M. ulcerans, М. leprae иM. tuberculosis, непатогенным экологическим видам, таким, как М. smegmatis, необходимы определенные потенции для формирования поляризации дочерних клеток, чтобы выжить в неблагоприятных условиях, в организме хозяина или в окружающей среде. Таким образом, покрытие области перегораживания наружным слоем и удерживание двух дочерних клеток друг с другом родительскими слоями клеточной оболочки, возможно, дает необходимые силы формирующимся полярным регионам дочерних клеток и защищает их от неблагоприятных условий окружающей среды в течение длительного периода перегораживания и деления клетки.

Рис. 7. Модель для формирования перегородки разделов и сужение в М. smegmatis и М. xenopi, и микобактерии туберкулеза. (А- С) М. smegmatis и М. xenopi. (A) S-ETL и S-PGL растет, соединяясь с E-PGL, которая отделяет S-ETL от E-ETL. (B) – завершение формирования перегородки раздела созданными S-ETL и S-PGL. Показано продолжающееся наличие E-PGL, которое отделяет S-ETL от E-ETL.ОLначинает расти и инвагинировать в S-ETL для формирования сужения. (C) Прогрессирование роста и инвагинации OL в S-ETL. (D - G) – M. tuberculosis. (D) S-ETL и S-PGL растут непрерывно с E-ETL и E-PGL, соответственно. В отличие от процесса в М. smegmatis и М. xenopi, E-PGL между S-ETL и E-ETL нет. (F) Завершение формирования перегородки раздела. (G) OL начинает расти и инвагинировать в S-ETL для формирования сужения бактериальной клетки [81].
Культуральные, биохимические и генетические исследования микобактерий
Как уже указывалось, изменения при туберкулёзе характеризуются образованием в органах и тканях гранулем (туберкул). При послеубойной диагностике туберкулёза у млекопитающих подвергают осмотру заглоточные, подчелюстные, бронхиальные, средостенные, брыжеечные, надвыменные лимфатические узлы, лёгкие, печень, селезенку, молочную железу, плевру, брюшину, кишечник и другие органы и ткани, а у птиц печень, селезенку, лёгкие, трубчатую кость.
При заражении крупного рогатого скота микобактериями туберкулёза человеческого и птичьего видов классические патологоанатомические изменения характерные для туберкулезной инфекции обнаруживают редко.
Для бактериологического исследования в лабораторию направляют от млекопитающих – заглоточные, подчелюстные, бронхиальные, средостенные лимфатические узлы и кусочки органов со сходными с туберкулезоподобными изменениями. Пробы для гистологического исследования фиксируют 10% раствором формальдегида, а для бактериологического консервируют 30% раствором глицерина. Пробы хранят в лаборатории до окончания исследований.
Кусочки органов и тканей, отмытые от консервирующей жидкости, промывают в стерильной дистиллированной водой или физиологическим раствором, измельчают, растирают в ступке со стерильным песком или стеклом и заливают 5–10% раствором серной или щавелевой кислоты в соотношении 1:4 на 10–30 минут. Затем кислоту удаляют, гомогенная масса промывается в течение 5–10 минут физиологическим раствором и используется для приготовления мазков и посева на питательные среды.
Существенным фактором, повышающим частоту обнаружения микобактерий, являются культуральные методы с учетом сохранения жизнеспособности микобактерий. Для подавления роста неспецифической микрофлоры помимо серной кислоты и едкого натрия изучается возможность использования катионо- и анионоактивных детергентов – лауросепта, хлоргексидинглюконикума, трехзамещенного фосфата натрия. В наших исследованиях хорошие результаты получены при обработке патматериала 3–5% лимонной кислотой с 3–5% перекисью водорода и последующей нейтрализации аммиаком. Применение лимонной кислоты обеспечивает щадящее действие на микобактерии, а после нейтрализации ее аммиаком образуется питательный субстрат для разных видов возбудителя туберкулёза.
В исследованиях, проведенных CornerL.A., и соавт., (2011) [58] в качестве средств деконтаминации посторонней микрофлоры были использованs2% гидроксид натрия (NaOH), 0,75% и 0,075% гексадецилпиридиния хлорид и 0,5% бензалкония хлорид (в конечной концентрации). В тоже время авторы делают вывод об определенном токсическом влиянии вышеперечисленных деконтаминантов наM.bovis, поскольку при проведении этой процедуры увеличилось минимальное время инкубации, необходимое для обнаружения положительных культур по сравнению с обработкой стерильной дистиллированной водой.
Рост микобактерий туберкулёза бычьего вида чаще обнаруживают через 20–60 дней, человеческого – на 20–30 день и птичьего – на 10–20 день, а атипичных микобактерий в разные сроки.
Микобактерии туберкулёза всех трех видов не образуют пигмента и растут на яичных средах без салицилата натрия: бычьего и человеческого вида – при 37–38°С, птичьего – 37–38°Cи 45°С.
Атипичные микобактерии могут давать пигментированные и непигментированные колонии, расти при разных температурах и на простых средах. Атипичные микобактерии первой группы по классификации Райнона в нашей стране редко встречаются.
Биологические исследования (биопроба) применяют для обнаружения возбудителя болезни и определения его видовой принадлежности. Для биопробы используют морских свинок, кроликов и кур. Этот метод дает положительные результаты у морских свинок при наличии в инъецируемом материале 5–10 микобактерий туберкулёза. Биопробы от патматериала млекопитающих проводят на двух морских свинках, а от птиц – на 2 курах. Для определения вида возбудителя туберкулёза заражают двух морских свинок и двух кроликов, а если необходимо, то и двух кур. Биопробу проводят на животных и курах не реагирующих на туберкулин.
Суспензию патматериала вводят подкожно морским свинкам в области паха в дозе 1–2 мл, курам – в подкрыльцовую вену. Через 30–40 дней морских свинок и кур исследуют туберкулиновой пробой.
Принадлежность возбудителя туберкулёза к тому или иному виду определяют по следующим данным:
при генерализованном туберкулёзе у морских свинок и кроликов – бычий вид;
при отсутствии поражений или наличии единичных типичных очагов в лёгких у кроликов и генерализованного процесса у морских свинок – человеческий вид;
при наличии поражений у кур и септического процесса у кроликов – птичий вид.
Очень важным биохимическим тестом при дифференциации и типировании микобактерий человеческого и бычьего видов является нитратредуктазная проба (рис. 8).
|
| |||
|
M.bovis |
M.africanum |
M.microti |
BCG M. tuberculosis |
Рис. 8. Тест нитратредуктазный NO3+ 2H+ + 2e- NO2+ H2O
Для выращивания микобактерий туберкулёза используют такие классические яичные среды (рис. 9) Петраньяни, Гельберга и Левенштейна – Йенсена. Для приготовления питательных сред используют только свежие куриные яйца, цельное молоко, очищенный мелко нарезанный картофель, 7,5 мл двухпроцентного раствора малахитовой зелени на 300 мл среды.
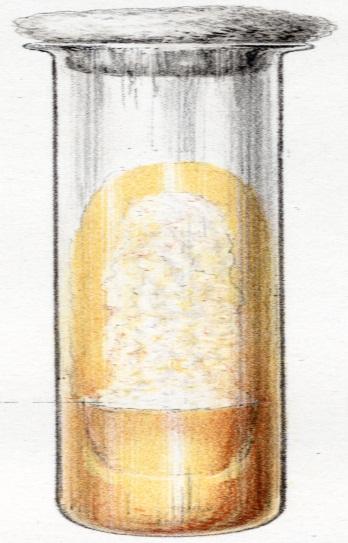
Рис. 9. Рост культуры M.bovis на яичной питательной среде
На протяжении всего периода изучения туберкулеза значительный массив научных исследований был посвящен усовершенствованию питательных сред для выделения и выращивания микобактерий.
Частота выделения микобактерий из биоматериала, так же как из проб, взятых из объектов внешней среды, зависит от двух факторов: способа предпосевной обработки исследуемого материала и качества питательной среды, используемых для посевов. Предпосевная обработка исследуемого материала основана на том, что ввиду строения клеточной оболочки микобактерий устойчивы к воздействию кислот, щелочей, спиртов и многих других антибактериальных веществ, которые губительно действуют на банальную (сопутствующую) микрофлору, и частично оказывают негативное влияние на микобактерии. В практике бактериологических лабораторий в этих целях используют растворы щавелевой (метод Гона – Левенштейна – Сумоши), серной (метод А.П. Аликаевой) кислот, едкого натра (метод флотации О.В. Мартма) хлоргексидина биглюконикума и др. К недостаткам вышеперечисленных методов следует отнести, губительное в некоторой степени действие кислот и щелочей на микобактерии, в результате чего уменьшается число жизнеспособных клеток, соответственно снижается эффективность их выделения из исследуемого материала [23]. Рядом авторов установлено, что обработка биологического материала 1% раствором этония в течении 30 мин. имеет ряд преимуществ перед другими способами, используемыми в целях предпосевной подготовки биоматериала, обеспечивает повышение выделения культур и сокращение сроков постановки диагноза.
Выбор питательных сред для культивирования МБТ и накопления бактериальной массы основывался на химическом составе микроорганизма, исходя из того, что МБТ для своего роста и размножения нуждаются в источниках углерода, азота и минеральных веществ.
Главным источником углерода для МБТ является глицерин, наилучшим источником азота – аммонийные соединения (аспарагин). Для питания МТБ необходимы ионы магния, калия, железа, серы, фосфатионы.
Все указанные ингредиенты применяются для конструирования плотных и жидких питательных сред.
Для первичной генерации микобактерий пригодны кровяной агар, жидкая среда Сотона, плотные яичные питательные среды Левенштейна-Йенсена, а также среды Гельберга, Финн-2, Петраньяни, Мордовской, а для поддержания культур – картофельная среда А. Д. Павловского. В литературе описано также использование для выделения и накопления микобактерий туберкулеза среды Middlebrookв разных модификациях, средыStonebrink, которая отличается от среды Левенштейна-Йенсена тем, что глицерин заменен на 0,5% пирувата натрия. В качестве селективной для получения культурыM.tuberculosisпредложена средаStonebrink, которая содержит полимиксин, амфотерицин, карбенициллин и триметоприм (TBMediumwithPACT) [75].
Существует также «транспортная среда для возбудителя туберкулёза» (Сафонова, Аникин, Голышевская, 1993) [30] предназначенная для сохранения и потенциирования жизнеспособности возбудителя туберкулёза при длительном хранении и транспортировке. Среда дополнительно содержит калий янтарнокислый, нуклеиновую кислоту, калий гетероауксин. Применение этой среды по данным авторов сокращает затраты времени на одну манипуляцию посева.
Для накопления бактериальной массы применяются синтетические жидкие питательные среды Сотона и Курской биологической фабрики. В обе эти среды в качестве азотосодержащего вещества входит аспарагин. Ф. И. Осташко (1954) [24] в составе среды заменил аспарагин на яблочную кислоту и получил среду с высокими элективными свойствами. А. А. Евглевским (1968) [15] были разработаны и апробированы две синтетические питательные среды: одна с лимонной кислотой без аспарагина и вторая с лимонной кислотой, аспарагином и сернокислым цинком под названием «среда Курской биологической фабрики». Эти среды выгодно отличались от предыдущих аналогов увеличением накопления бактериальной массы в 3 раза и перспективой широкого использования не только в жидком состоянии, но и в качестве минеральной основы для агаризованной среды, а также для централизованного обеспечения лабораторных учреждений путем выпуска её в концентрированном состоянии.
Попытки повысить ростовые качества среды были предприняты Н. Н. Исамовым и Э. У. Умеровым (1986) [20]. Ими для накопления биомассы микобактерий в состав среды дополнительно внесли DL-метионин, а в качестве соли натрия – натрий лимоннокислый. Кроме этого среда содержала калий фосфорнокислый однозамещенный, натрий фосфорнокислый двузамещенный, магнезию сернокислую, железо лимоннокислое аммиачное, L-аспарагин, глицерин, 10 % раствор твина – 80,5 % водный раствор сывороточного бычьего альбумина, соль натрия и дистиллированную воду.
Т. Т. Попеску [27] с целью повышения выхода биомассы включил в состав среды натрий гидроцитрат пятиводный, а соли железа заменил на железоаммиачные квасцы и в качестве стимулятора роста добавил 2-аминоглютаровую кислоту. В состав питательной среды для культивирования микобактерий входили: магний сернокислый, калий фосфорнокислый однозамещенный, натрий лимоннокислый, соль железа. С помощью этой среды автору удалось повысить выход бактериальной массы штамма БЦЖ до 198 мг и эпизоотического штамма – до 218 мг (сухого вещества).
Е. А. Асташовой с соавт. [3] была предложена полужидкая питательная среда для накопления и идентификации бактериальных и L‑форм микобактерий. В её состав входят: L-аспарагин, лимоннокислый натрий, сернокислый магний, лимоннокислое аммиачное железо, фосфорнокислый однозамещенный калий, фосфорнокислый двузамещенный натрий, глицерин, индикатор бромтимоловый синий, сыворотка крови крупного рогатого скота.
Учеными ЦНИИТ и Казахского НИВИ разработана питательная среда для получения сферопластов микобактерий туберкулёза. Она содержит: фосфорнокислый двузамещенный натрий, сернокислый магний, сахарозу, дистиллированную воду а также 20 % раствора хлоргексидина глюконата в качестве лизирующего агента, что обеспечивает ускорение получения сферопластов при сохранении продуктивности среды [14]. Недостатком вышеперечисленных сред является длительный период накопления биомассы и низкий её выход – 7,0–9,0±1,0 г/дм3.
Позднее А. А. Евглевский (1999) [16] предложил синтетическую питательную среду с элективными свойствами, позволяющими достичь выхода бактериальной массы до 13,0 г/дм3за 55 суток культивирования. Концентрат этой среды включает органическую кислоту, соль органической кислоты аммония, сернокислые железо и магний, глицерин и двузамещенный фосфорнокислый калий.
В качестве источника органической кислоты автором предложена лимонная кислота, а в качестве соли органической кислоты – аммония цитрат, сернокислый цинк и аспарагин. Концентрат растворяется дистиллированной водой и рН доводится до 7,5±0,5. Эта среда, по данным автора, позволяет получить выход биомассы до 12,8±0,1 г/дм3.
В процессе дальнейшего усовершенствования синтетической питательной среды с целью повышения выхода целевого продукта – культуры микобактерий, нами в состав существующей среды с гликоколом были добавлены сернокислый цинк и лимонная кислота, что дало возможность повысить выход бактериальной массы до 13,6±0,2 г/дм3. В состав этой среды входили мас.%: гликокол – 6,0±2,0; лимонная кислота – 4,0±1,0; аммоний лимоннокислый – 3,0±1,0; кальций фосфорнокислый двузамещённый – 5,0±0,5; магний сернокислый семиводный – 0,5±0,1; цинк сернокислый – 0,2±0,05; железо лимоннокислое аммиачное – 0,05±0,001; глицерин – до 50,0±5,0 и вода дистиллированная до 1000,0.
Технология приготовления не отличалась по степени сложности от предыдущей среды, но давала возможность не только увеличить выход биомассы, но и сократить сроки культивирования до 50–55 суток.
Представленная разработка даёт возможность не только ускорить процесс получения большого количества бактериальной массы, но и способствует усовершенствованию получения аллергенов и протеинов на более перспективных питательных средах.
Нами, с целью быстрого накопления биомассы и получения ещё более высокого уровня выхода бактериальной массы, была разработана синтетическая питательная среда для выращивания микобактерий. В её состав входят в качестве источника соли органической кислоты – лимоннокислый аммоний, отличающаяся от вышеперечисленных образцов сред тем, что аспарагин в ней был заменен на гликокол.
Для оптимального роста и накопления бактериальной массы нами было сконструировано три варианта среды, куда входили следующие ингредиенты в количественном соотношении мас.%:
1. Гликокол – 5,0, аммоний лимоннокислый – 3,0, калий фосфорнокислый двузамещенный – 4,5, магний сернокислый семиводный – 3,0, железо лимоннокислое аммиачное – 0,05, глицерин – 50,0, воды дистиллированной – до 930,0 (минимальная).
2. Гликокол – 5,5, аммоний лимоннокислый – 3,5, калий фосфорнокислый двузамещенный – 4,5, магний сернокислый семиводный – 3,5, железо лимоннокислое аммиачное – 0,05, глицерин – 55,0, воды дистиллированной – до 920,0 (оптимальный).
3. Гликокол – 6,0, аммоний лимоннокислый – 4,0, калий фосфорнокислый двузамещенный – 5,0, магний сернокислый семиводный – 4,0, железо лимоннокислое аммиачное – 0,06, глицерин – 60,0, воды дистиллированной – до 920,0 (максимальная).
Во всех вариантах рН доводили до 7,2±0,2. Кроме этого нами было приготовлено дополнительно шесть вариантов питательных сред, отличающихся рН от вышеперечисленных образцов. В первом варианте рН равнялась 6,3, втором – 6,5, третьем – 6,8, четвертом – 7,0, пятом – 7,2 и шестом – 7,5.
Все девять вариантов питательных сред готовили таким образом. Навески железа лимоннокислого аммиачного растворяли в горячей дистиллированной воде на пламени горелки. Навески других солей растворяли в теплой дистиллированной воде в указанной выше последовательности. После этого добавляли глицерин и тщательно перемешивали в колбе до полного растворения солей. Полученные солевые растворы подщелачивали в первых трёх вариантах до 7,2, а в остальных до указанных выше величин рН и подвергали стерилизации путём автоклавирования при температуре 120°С в течение 30 минут. Солевые растворы хранили при температуре 4°С.
Изучение ростовых свойств приготовленных питательных сред проводили путём высева культуральной плёнки референтных штаммов Vallae, БЦЖ и эпизоотического «Крушинский» на 10 флаконах каждого варианта среды. В качестве контроля служила питательная среда Сотона.
Посевы на опытных и контрольных средах помещали в термостат при температуре 37±0,5°С.
Учёт роста культур на опытных и контрольных средах проводили через каждые 3–7 суток в течение 55 и 60 суток.
В результате сравнительного изучения ростовых свойств приготовленных образцов питательных сред установлено, что поверхность жидкой питательной среды на 7 (оптимально) и 12 (максимально) сутки после посева референтных штаммов покрывалась культуральной шероховатой плёнкой.
На контрольной среде Сотона только на 10 сутки роста культуральная пленка (Vallae и эпизоотического штамма) покрывала 1/3часть поверхности питательной среды, а уже на 12 сутки роста на среде с гликоколом вся поверхность жидкой питательной среды была покрыта культуральной пленкой.
Также было изучено влияние рН среды на её ростовые качества. На среде с рН=6,5 рост всех трёх культур микобактерий, взятых для данного опыта (Vallae, БЦЖ, «Крушинский»), появился через 7 суток в виде шероховатой плёнки, занимающей 1/3часть поверхности питательной среды. При рН=6,8 за тот же промежуток времени до аналогичного показателя вырос только штамм Vallae.
Через 55 и 60 суток после посева культур микобактерий по 5 флаконов каждого варианта синтетической питательной среды было подвергнуто термической обработке. После отделения бактериальной массы от культурального фильтрата, определяли выход бактериальной массы, предварительно высушив её в термостате.
Сведения о выходе бактериальной массы на предлагаемой питательной среде с рН=6,5 в сравнении со средой Сотона приведены в табл. 1. Из неё видно, что самыми высокими ростовыми качествами обладает среда с гликоколом в следующих соотношениях компонентов мас.%: гликокола – 5,5, аммония лимоннокислого – 3,5, калия фосфорнокислого двузамещенного – 4,5, магния сернокислого семиводного – 3,5, железа лимоннокислого аммиачного – 0,05, глицерина – 55,0 с с рН=6,5, которая давала выход бактериальной массы до 13,0±0,1 г/дм3сухого вещества, что в 1,3 раза больше, чем в прототипе (среда Сотона), где выход биомассы составил 9,2 г/дм3.
Для сравнения нужно отметить, что известные жидкие питательные среды Курской биологической фабрики (Евглевский, 1968) [15] с лимонной кислотой без аспарагина и с лимонной кислотой, аспарагином и сернокислым цинком, характеризуются достаточно высокими элективными свойствами и дают выход бактериальной массы до 10,0±1,0 г/дм3.
Таблица 1. Выход бактериальной массы на жидкой питательной средедля выращивания микобактерий с гликоколом
|
Штамм микобактерий |
Количество бактериальной массы, г/дм3(сухого вещества) | |||
|
Среда при содержании мас.% |
Среда Сотона (контроль) | |||
|
Минимальная |
Оптимальная |
Максимальная | ||
|
Vallae |
11,9 |
13,1 |
12,8 |
8,9 |
|
«Крушинский» |
12,2 |
13,0 |
12,9 |
9,2 |
|
БЦЖ |
11,6 |
13,0 |
12,6 |
7,0 |
Полученные результаты по увеличению ростовых качеств питательной среды за счёт сдвига рН в кислую сторону к рН=6,5 А.А. Ткаченко (2000) [33] связывает с тем, что естественная среда для размножения микобактерий туберкулёза в лимфатических узлах макроорганизма имеет именно такой уровень рН. Интересным является установленный этим же исследователем факт повышения патогенности исходно авирулентных штаммов микобактерий после культивировании на среде с рН 7,0-7,2 в течении 100 последовательных пассажей они вызывали характерные туберкулезные изменения у лабораторных животных, тогда как при пассажировании на среде с рН 6,5 такого явления не наблюдалось [34]. В литературе есть мнение, что более шелочная среда способствует сохранению вирулентности микобактерий и корд-фактора [17, 34]
Коллектив исследователей под руководством А.С. Донченко для культивирования микобактерий туберкулеза предложили усовершенствованный мясопептонный агаровый гель, отличающийся тем, что он дополнительно содержит глюкозу и глицерин (на 100 г мясопептонного агарового геля 1,0-1,2 г и .2,0-2,2 г компонентов соответственно) [13].
Эти же авторы предложили добавлять в плотную среду вытяжку древесной золы и оксидат торфа при следующем соотношении компонентов: яйца куриные, 4-5 шт, 2%-ный водный раствор малахитовой зелени, - 3,33 мл, 41,5%-ная вытяжка древесной золы, – 100 мл, глицерин, - 1,6-2,5 мл, оксидат торфа – 0,1 мл. Среда позволяет ускорить рост микобактерий как в чистой культуре, так и из биоматериала, что сокращает сроки постановки диагноза на туберкулез и повышает точность бактериологической диагностики заболевания [12].
Вытяжка древесной золы была использована и при разработке усовершенствованной жидкой среды для культивирования микобактерий туберкулеза на основе среды Сотона. Среда содержити аспарагин, глицерин, а минерально-солевую основу данной среды составляют такие компоненты, как лимонная кислота, калий фосфорнокислый двуосновной, магний сернокислый, цитрат аммиачного железа. Техническая задача улучшения ростовых свойств среды и сокращения сроков выращивания патогенных микобактерий туберкулеза была решена путем дополнительного введения криалла и сыворотки крови лошадей, а в качестве минерально-солевой основы была предложена вытяжка древесной золы при следующем соотношении компонентов: 1,5%-ная вытяжка древесной золы, глицерин – 6,0 г, аспарагин – 0,4 г; криалл– 1,0-1,2 г, сыворотка крови лошади –1,0-1,2 г. [11]. Авторы указывают, что положительное биологическое действие вытяжки древесной золы обусловлено содержанием в ней необходимых для питания микобактерий туберкулеза микроэлементов: серы, магния, железа, цинка, калия и фосфора, установленное путем проведения спектрального анализа.
Растительные компоненты были также были включены В.Г. Ощепковым и соавт. (2010) [25] в состав еще одной модифицированнной питательной среды для культивирования микобактерий туберкулеза: в состав среды Левенштейна- Йенсена в качестве стимулятора роста был введен 10%-й экстракт полыни. При этом экстракт полыни наслаивается на поверхность готовой среды в дозе 0,2-0,3 мл/на пробирку. Использование изобретения позволяет сократить сроки культивирования и повысить выделяемость культур микобактерий из биоматериалов на 8-10% за счет выявления микобактерий с измененными морфологическими, культуральными свойствами и ослабленной жизнеспособностью. Такой биологический эффект экстракта полыньи обуславливается содержанием в нем широкого набора биологически активных соединений: каучука, фенолкарболовых кислот и их производных, эфирного масла и др., которые в определенной дозе обладают стимулирующим действием на рост микроорганизмов.
В мировой медицинской практике для первичной изоляции микобактерий часто используется среда Middlebrook в разных модификациях. Middlebrook разработали ряд рецептур, содержащих олеиновую кислоту и альбумин в качестве основных ингредиентов для обеспечения роста туберкулезных бацилл и защиты микроорганизмов от ряда токсических агентов, в частности основную рецептуру бульона 7H9 одновременно с созданием базового агара. Среды обоих типов поддерживают рост видов микобактерий при наличии добавок питательных веществ, таких как глицерин, олеиновая кислота, альбумин и декстроза, за исключением M. bovis, рост которых ингибируется глицерином [72; 73].
Эти среды используются в приготовлении культур для определения противомикробной активности, в качестве минимальной среды для биохимических тестов, а также для получения субкультур исходных штаммов.
Миддлбрук и Кон (Cohn) [68] усовершенствовали рецептуру агара с олеиновой кислотой и альбумином и добились более быстрого и интенсивного роста видов Mycobacterium в среде, получившей обозначение 7H10. Сообщалось, что в среде 7H10 наблюдается рост меньшего количества микроорганизмов-загрязнителей, чем в среде на яичной основе, обычно используемой для культивирования микобактерий. В агаре BD Middlebrook 7H10 содержатся различные неорганические соли, которые служат веществами, необходимыми для роста микобактерий. Так, натрия цитрат, превращаясь в лимонную кислоту, служит для удержания определенных неорганических катионов в растворе. Глицерин является богатым источником углерода и энергии. Олеиновая кислота, как и другие жирные кислоты с длинной углеродной цепочкой, может использоваться туберкулезными бациллами и играет важную роль в метаболизме микобактерий. Каталаза разрушает токсичные пероксиды, которые могут присутствовать в среде. Основной эффект альбумина заключается в защите туберкулезных бацилл от токсических агентов, что позволяет повысить степень их выделения при первичной изоляции. Частичное ингибирование загрязняющих бактерий достигается благодаря присутствию красителя малахитового зеленого [19; 68; 72; 75].
Добавив один грамм панкреатического гидролизата казеина на литр в рецептуру агара 7H10, для улучшения роста штаммов Mycobacterium tuberculosis, для которых наблюдался слабый рост (или рост вообще отсутствовал), на 7H10 и других обычных изоляционных средах. Эта рецептура получила название агар 7H11[47; 73] .
При сопоставлении ростовых свойств агара 7H11, кровяного агара (B83), а также яичной среди Stonebrink’s(SB). [58] было установлено, что минимальное время появления колоний М.bovisпри применении сред 7H11 и B83 составило 28 дней, а среды SB – 36 дней, в то же время последняя из них обеспечивала выявление большего числа положительных проб.
Для усиления роста микобактерий предложено ряд добавок ADC, OADC, (FD018),ростовая добавка к среде VersaTREK Myco GS. В состав добавок в основном входят натрия хлорид, альбумин бычий (фракция 5), глюкоза, каталаза, кислота олеиновая, полиоксиэтилена стеарат. Олеиновая кислота и другие высокомолекулярные жирные кислоты составляют неотъемлемую часть метаболизма микобактерий, глюкоза используется как источник энергии. Каталаза нейтрализует токсичные перекиси, альбумин предохраняет туберкулезные бациллы от воздействия других токсичных агентов.
Важное значение для диагностики туберкулеза имеет выделение L-форм микобактерий туберкулеза. При этом требуется полужидкая питательная среда, обеспечивающая необходимые для их роста осмотические условия. Наиболее известной является полужидкая среда в модификации Дорожковой для выращивания L-форм микобактерий туберкулеза, содержащая: источник азота, сахарозу, нативную сыворотку крови крупного рогатого скота или лошади, лимоннокислый натрий, лимоннокислое аммиачное железо, калий фосфорнокислый, двухзамещенный натрий, магний сернокислый, глицерин, агар-агар и воду [14]. Однако эта среда не позволяет получить в лабораторных условиях экспериментальные L-культуры микобактерий, необходимые для опытов по изучению особенностей вызываемого ими инфекционного процесса. Кроме этого она не обеспечивает быстрого роста L-форм микобактерий туберкулеза и достаточного накопления биомассы, а присутствие примесей в солевой основе оказывают токсическое влияние на клетку.
Ощепков В.Г. и соавт (2004) [26] усовершенствовали ее путем дополнительного введения предельного углеводорода с длиной цепи С14-С17, изониазида, при этом солевая основа представлена буферным раствором Хенкса. Авторы указывают, что сокращение сроков роста и повышение выхода биомассы L-форм микобактерий, достигается тем, что стандартный раствор Хенкса не содержит токсичных ионов, создает необходимую буферность и играет существенную роль в обмене веществ микобактериальной клетки. Для приготовления среды пользуются предварительно очищенными реактивами и деионизированной водой. Предельные углеводороды с длиной цепи C14-C17 в дозе 0,1-0,2 мл на пробирку оказывают ростостимулирующее влияние, активно воздействуют на обменные процессы в микробной клетке, активизируют синтез углеводов, являются источником энергии и пластическим материалом Также было доказано, что понижение дозы не оказывает ростостимулирующего влияния, а повышение дозы приводит к снижению скорости роста, поэтому это количество (0,1-0,2 мл) является оптимальным для достижения эффекта.
В качестве L-трансформирующего агента питательная среда содержит изониазид, который влияет на белковый синтез микобактериальной клетки, в результате чего происходит нарушение целостности клеточной стенки бактерий и образование L-форм. Патогенные микобактерии являются биохимически менее активными, о чем свидетельствует их медленное размножение и потребность в определенном комплексе питательных веществ. Они содержат меньше энзимов и ростовых веществ, поэтому являются более чувствительными к антибактериальным препаратам.
Также необходимо наличие в среде нативной сыворотки крови крупного рогатого скота или лошади. Она обладает буферными свойствами, а также оказывает стимулирующее влияние на размножение и рост L-форм, так как с сывороткой крови в среду поступают белки и ряд прочно связанных с ними витаминов. Использование предлагаемой питательной среды позволяет ускорить рост L-форм в 2-3 раза, повысить интенсивность накопления биомассы в 2 раза.
Антигенные свойства углеводсодержащих фракций, выделяемых из микобактерий
Большое число различных белков, синтезируемых микобактериальной клеткиой классифицированы и изучены в составе групп с некоторыми общими свойствами, (физические и химические, функция и локализация в микобактериальной клетке). По меньшей мере восемь белков, секретируемых микобактериями туберкулеза при культвировании был выделены и охарактеризованы в различной степени [85].
Все микобактериальные антигены являются углеводсодержащими соединениями. Как уже сообщалось, известно несколько типов углеводсодержащих антигенов микобактерий: 1) гликолипиды – липополисахариды (диацилтрегалоза), липоолигосахариды (липоарабиноманнан В-LAM-B), 2) фосфатидилинозитол маннозиды (РІМ); 3) гликопептидолипиды, скомпонованные из гликозилированного липопептида – «ядра» и «жирового хвоста», связанного с треонином белка.
Гликопротеины являются одними из важных углеводсодержащих соединений микобактерий. Большинство из них тесно ассоциировано с пептидогликановыми комплексами, состоящими из глюкозамина, мурамовой и диаминопимеликовой кислот [39]. В их составе полностью отсутствуют арабиноза, галактоза и связывающий их миколиларабиногалактан [55].
Основными антигенами M. tuberculosis, связанными с клеточными стенками, являются белки с молекулярной массой 10, 19, 23, 28, 30, 40–50 и 65 кД. Антигены с такими же молекулярными массами характерны для культурального фильтрата M. tuberculosis: 32, 30, 24, 22, 19 и 12 кД и относятся к общим антигенам M. bovis и M. tuberculosis: Р32, МРВ59, МРВ64, МРВ70, 19 кД и 12 кД соответственно. Содержание углеводов в молекулах антигенов культурального фильтрата может быть весьма значительным. Для дуплетного антигена 55–60 кД содержание сахара составляет 34,6 % а для очищенной молекулы 38 кД – 25,7 %. Высокоспецифичные моноклональные антитела против антигена 38 кД распознавали как протеин ТВ-71, так и углеводную часть ТВ-72.
Большинство исследователей для получения высокоспецифических антигенов используют ультразвуковые дезинтеграты, которые качественно отличаются от культуральных микобактериальных фильтратов наличием углеводсодержащих, ассоциированных с клеточной стенкой белков, а также присутствием негликозилированных зрелых секреторных белков в культуральных фильтратах [76]. Адсорбция антигенов ультразвуковых дезинтегратов, в отличие от культуральных фильтратов микобактерий, приводит к дополнительному связыванию белков клеточной стенки микобактерий. Из ультразвуковых дезинтегратов M. tuberculosis была выделена фракция, содержащая в качестве основного компонента антиген 85 кД, который обладал иммуногенными свойствами на лабораторных животных. Полученная фракция обладает широкой перекрестной активностью по отношению ко многим поликлональным антисывороткам против разных видов микобактерий.
Ультразвуковые дезинтеграты использовались в качестве антигенов при разработке средств серодиагностики туберкулёза (РСК, РДСК, РНГА, РДП, РЭМА, ИФА). А. Н. Шаровым с соавт. [41] предложена реакция аглютинации РА, которая выявляет до 77,7 % инфицированных животных в разведении антигена 1:16.
Ученые из Беларуси [22] также считают перспективным использование ультразвуковых дезинтегратов клеток микобактерий для постановки ИФА при туберкулезе. Авторы отмечают, что внедрение серологических реакций сдерживается значительной перекрестной реактивностью антигенов M. bovis, M. tuberculosis и атипичных микобактерий. Исследователи изучали специфичность ППД-туберкулина, антигенов из клеточных стенок, ультразвукового дезинтеграта бактериальной массы, культурального фильтрата M. bovis и его фракций в ИФА и сделали вывод, что продукты лизиса микобактерий (культуральный фильтрат и туберкулин) в ИФА более специфичны, чем антигены клеточных стенок (ультразвуковой дезинтеграт, антиген из клеточных стенок). Также в ИФА использовался антиген с молекулярной массой 85 кД, в сравнении с аналогичными показателями для стандартного антигена ППД- и моноантигена анти-S4C1G4, а с протективной целью – Аг-10, 12, 24 кДа [2].
Нашими исследованиями был установлен белково-нуклеотидный состав нативных фильтратов культуры БЦЖ, фильтратов культур микобактерий туберкулеза бычьего вида (штамм Vallae) после термической обработки и суспензий культур микобактерий БЦЖ и Vallae, разбитых на ультразвуковом дезинтеграторе.
С этой целью на жидкой синтетической питательной среде выращивали культуру референтного штамма возбудителя туберкулеза бычьего вида Vallae и вакцинного штамма БЦЖ. Через 55–60 суток культивирования ёмкость с вакцинным штаммом БЦЖ и два с референтным штаммом Vallae подвергали термической обработке в автоклаве при температуре 132°С в течение 2 часов.
Культуральный фильтрат отделяли от бактериальной массы, пропуская его через стерилизующие пластины. Бактериальную массу разбивали на ультразвуковой установке «УЗДН» и после пропускания через СФ-фильтры использовали для исследований.
При хроматографии в нативном фильтрате культуры БЦЖ обнаружены лишь нуклеотиды преимущественно с молекулярной массой от 8000 до 48000 Да.
Наибольшая концентрация нуклеотидов – 17,0–21,0 мкг/см3(табл. 2) обнаружена во фракциях 16–18 (рис.10), что соответствует молекулярной массе 14000–30000 Да.
Молекулярную массу белковых и нуклеотидных частиц определяли по градуировочной прямой, данные которой изложены в табл. 3.
После термической обработки культур БЦЖ и Vallae при давлении 2·105Па (2 атм.) в течение 2 часов (в результате экстрагирования термостабильных белково-пептидных частиц из бактериальных клеток) в фильтрате появляются белки с молекулярной массой 5000–48000 Да, основную часть которых (66 %) составляют белки с молекулярной массой 14000–23000 Да (рис.8). Другой пик концентрации белка характерен для фракции с молекулярной массой 6500 Да, которая составляет 13,6 % от общего количества белка. Общая концентрация белка в фильтрате – 1,1 мг/см3.
В суспензиях, разбитых на УЗДН и подготовленных по собственной технологии микобактерий штаммов БЦЖ и Vallae, выявлено 10 фракций (рис. 11) высокомолекулярных протеидных соединений (табл.2) с молекулярной массой от 800 до 28 кД. Наибольшая концентрация белка была во фракциях: 3 – 0,476 мг/см3и 4 – 0,574 мг/см3при общей концентрации в фильтрате 1,4±0,3 мг/см3.
Таблица 2. Результаты фракционирования нативного фильтрата микобактерий туберкулеза
|
№ фракции |
Величина оптической плотности |
Концентрация нуклеотидов, мкг/см3 | ||||
|
А260 |
А280 |
А270 |
А290 | |||
|
14 |
0,15 |
0,08 |
0,1 |
0,04 |
3,25 | |
|
15 |
0,4 |
0,19 |
0,28 |
0,14 |
2,1 | |
|
16 |
0,77 |
0,32 |
0,51 |
0,19 |
17,3 | |
|
17 |
1,02 |
0,42 |
0,63 |
0,23 |
21,3 | |
|
18 |
1,05 |
0,42 |
0,63 |
0,23 |
21,7 | |
|
19 |
0,81 |
0,38 |
0,57 |
0,21 |
19,5 | |
|
20 |
0,44 |
0,19 |
0,3 |
0,11 |
10,3 | |
|
21 |
0,2 |
0,09 |
0,14 |
0,04 |
5,4 | |
|
22 |
0,08 |
0 |
0,04 |
0 |
0 | |
Рис. 10. Результаты фракционирования нативного культурального фильтрата на сефадексе G-2000.

Рис. 11. Результаты фракционирования дезинтеграта на сефадексе G-200
Полученные нами данные согласуются с результатами исследований G. Harth иM.A. Horwitz, (1997, 1999). которые выделяли экстрацелюлярные белки МРТ59, МРТ44, МРТ45, МРТ64, МРТ51, МРТ32, МРТ53 микобактерий, появляющиеся в культуральных фильтратах и попадающие туда с помощью механизмов сходных с таковыми в ферментах супероксиддисмутазе и глютаминсинтетазе [65; 66].
В культуральную питательную среду поступают кроме экстрацелюлярных компонентов белки с молекулярной массой 38 кДа protein PstS и липопротеины с молекулярной массой 19 кДа, которые постепенно высвобождаются из клеточной стенки микобактерий в культуральную среду [45]. Внутриклеточный белок GroES и рибосомальные белки L7/L12 обнаруживаются в культуральных фильтратах, что является свидетельством аутолиза M. bovis, M. tuberculosis, БЦЖ в культуральных фильтратах с выделением компонентов цитоплазмы. С целью изучения нуклеотидного состава дезинтеграта было использовано центрифугирование при 100000 g для осаждения основной массы разрушенных клеточных субстанций и высокомолекулярных соединений.
В надосадочной жидкости, получаемой после центрифугирования дезинтеграта при 100000 g выделено 16 фракций, содержащих белки с диапазоном их молекулярных масс от 5 до 800 кД, однако практически половину (49,3 %) составляют низкомолекулярные белки с молекулярной массой 20–5 кД.
При анализе состава цитозоля, полученного после осаждения микросомальных фракций, пропущенного через TSK-GEL (рис. 12) выделено 8 белково-нуклеотидных фракций. Белки первой фракции занимали 94,5 % удельного веса всей суспензии с молекулярной массой более 10 кД. Остальные семь фракций занимали 5,5 % удельного веса всей суспензии с молекулярной массой от 4,8 до 2,4 кД.
Основную часть 38,5 % и 28,6 % составляют нуклеотиды и белки 2-го и 6-го элюатов (рис. 13).
Сравнивая полученные результаты фракционирования дезинтегратов с результатами приведенными на рис. 11, можно сделать вывод, что белки, содержатся только во фракции с молекулярной массой 4,8 кД во всех остальных фракциях обнаружены только нуклеотиды.
Таким образом, нами впервые доказано, что до автоклавирования в культуральной жидкости выращенных микобактерий туберкулеза не существует экзогенных продуктов жизнедеятельности микобактерий белковой природы, а присутствуют ничтожно малые количества нуклеотидов от 17,0 до 21,0 мкг/см3, которые появляются в процессе культивирования микобактерий.
После термической обработки культуральных фильтратов микобактерий туберкулеза нами выявлены белковые фракции с концентрацией в общем объеме 1,1 мг/см3, что свидетельствует об экстрагировании белковых частиц из микобактерий туберкулеза в культуральный фильтрат.

Рис. 12. Молекулярная масса белков и нуклеотидов во фракциях дезинтеграта (после центрифугирования 100000g) и пропускания TSK‑Gel.
После разрушения на УЗДН отобранных из культурального фильтрата микобактерий туберкулеза выделено значительное количество цитоплазматических, внутриклеточных белков с общей концентрацией в суспензии протеинов 1,4±0,3 мг/см3, что является свидетельством значительного повышения выхода белковых субстанций после полного разрушения микобактерий туберкулеза.

Рис. 13. Содержание нуклеотидов во фракциях дезинтегратов (%) при пропускании через TSK‑Gel.
Эти данные свидетельствуют о содержании внутри микобактерий значительного числа туберкулопротеидов, которые можно получить не только с помощью термической обработки культуральных фильтратов микобактерий туберкулеза, но и разрушением клеточных оболочек на ультразвуковом дезинтеграторе.
Разрушение клеточных стенок микобактерий культурального фильтрата позволяет дополнительно получить до 1,4±0,3 мг/см3туберкулопротеина.
В литературе имеется ряд данных, характеризующих биологическую роль белков клеточной стенки микобактерий. Так, было установлено, что антиген микобактерий туберкулеза с молекулярной массой 40 кДа является L-аланиндегидрогеназой (EC 1.4.1.1) т.е. одним из немногих антигенов, обладающих ферментативной активностью. Это делает 40 кДа антиген привлекательным для потенциального использования в диагностических и терапевтических целях [67].
Антиген с молекулярной массой 60 кДа (A60) является основным термостабильным иммуногеном и входит в состав туберкулинов. При исследовании А60 с использованием органических растворителей, химических веществ и ферментов было установлено, что в нем содержатся две фракции свободных и связанных липидов, а также фрагментов белков и полисахаридов. После удаления свободной и связанной фракций липидов, ядро все еще сохранил способность к образованию иммунопреципитирующих линий с БЦЖ- антисывороткой [56].
При сравнительном изучении биологических свойств очищенных иммуногенных белков MPB64 и MPB80 из M. bovis, штамм БЦЖ по сравнению с белком MPB70. Относительно MPB70 и MPB80 установлена близость их физико-химических свойств, показано высокое содержание и аналогичное распределение в субштаммах BCG Токио, Моро, Россия и Швеция. В небольших количествах эти белки содержться в подштаммах BCG Glaxo, Тайс, Копенгаген и BCG Пастера. Эти результаты, по мнению авторов, показывают, что MPB70 и MPB80 являются двумя близкими формами продукта одного и того же гена, а наблюдаемые различия объясняют вероятными постсинтетическими изменениями. [76].
В исследованиях H G WikerandM Harboe(1992) [85] также были клонированы и секвенированы гены, кодирующие белки M. tuberculosis и M. bovis BCG. Было установлено, что они содержат типичные сигнальные последовательности, а белки комплекса антигенов 85 кДа (85-К) являються наиболее распространенными в культуральной жидкости M. tuberculosis, а его компоненты обозначают 85A, 85B, 85C. Установлено, что они кодируются тремя генами, расположенными в разных местах в геноме микобактерий, имеют значительную перекрестную реактивность, а также гомологию на генетическом и аминокислотном уровнях. Белки 85-К немного отличаются по молекулярной массе (на 30-31-кДа), и все они являются фибронектин-связывающими белками, имеют высокие иммуногенные свойства при естественных и экспериментальных микобактериальных инфекциях с точки зрения индукции синтеза антител и Т-клеточных реакций.
Авторы считают, что хорошо известное различие в эффективности живых и инактивированных микобактериальных вакцин следует рассматривать в связи с этой группой антигенов, выделяемых, например, BCG при размножении в организме животного.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Абрамов Л.П. Материалы по аллергической диагностике туберкулёза у крупного рогатого скота // Автор.дис.канд.вет.наук.-Л.,1957.,с16.
Авдиенко В.Г., Кондрашев С.Ю., Куликовская Н.В. и соавт. Серологические и иммунохимические свойства углеводсодержащей фракции из MycobacteriumtuberculosisH37Rv// Проблемы туберкулёза. -1998.-№6.-С.54-57.
Асташова Е.А. и соавт. Способ видовой идентификации - форм микобактерий Патент СССР № 4679368/13 от 30.10.91.
Блохина И.Н. Геносистема бактерий./ И.Н Блохина. , Г.Ф. Леванова -М.,1976.
Бойерс М., Цвишенбергер Дж. Кнсервативное и хирургическое лечение туберкулёза и других микобактериозов // Проблемы туберкулёза. -1998, №2. -С.47-51.
Бошьян, Г.М. «О природе вирусов и микробов/ Г.М. Бошьян.//М.: Медгиз, 1949. – 146 с.
Брудная Ю.Е. Сравнительное изучение некоторых билогических свойств и структуры ДНК туберкулёзных и нетуберкулёзных микобактерий: Автор.дисс….кан.мед.наук.-М.,1981- 16 с.
Бусол В.О. Суд над туберкулином. /В.О. Бусол //Ветеринарна газета.–2003. – № 9. – С. 7.
Власенко В.В. Туберкулез в фокусе проблем современности./В.В. Власенко.//Винница: Наука. 1998. - 35 с.
Донченко А.С., Мерман В.Г. Взаимосвязь туберкулёза человека и животных, особенности противотуберкулёзных мероприятий, проводимых ветеринарной и медицинской службами // Зооантропонозные болезни, меры профилактики и борьбы.-Гродно.-1997.-С.71-73.
Донченко А. С., Донченко В. Н., Донченко Н. А. Ионина С. В. Жидкая питательная среда для культивирования патогенных штаммов микобактерий туберкулеза RU 2300559 C2 Опубликовано: 10.06.2007
Донченко А.С., Донченко В.Н., Донченко Н.А., Ионина С.В. Среда для культивирования микобактерий туберкулеза RU 2192472 Опубликовано: 10.11.2002
Донченко А. С., Донченко В. Н., Донченко Н. А. Ионина С. В. Мясопептонный агаровый гель для культивирования микобактерий туберкулеза RU 2339691 Опубликовано 20.05.2007
Дорожкова И.Р., Керимжанова Б.Ф. Питательная среда для получения сферопластов микобактерий туберкулеза // Патент СССР № 4645683/13 от 15.01. 1991 года. //
Евглевский А.А. Сравнительная оценка существующих синтетических питательных сред, применяемых для изготовления очищенных туберкулинов // Труды ГНКИ ветбиопрепаратов, М., 1968. -т.15. -С.110-116.
Евглевский А.А. Среда для выращивания микобактерий туберкулеза // А.С. № 2139345, 1999.
Зеленська М.В. Ліпідний склад та вірулентність Mycobacteriumbovis, виділених від великої рогатої худоби Степової зони України// Автореф. … к. вет. н., Одесса, – 2006.–20 с.
Изучение термической устойчивости микобакетрий туберкулеза/ А.П. Лысенко [и др.].//Проблеммы туберкулеза и болезней легких. –2007.– № 2.– С. 42-46.
Инструкция по применению — готовая к использованию среда в чашках BDMiddlebrook7h10agar//Ошибка! Недопустимый объект гиперссылки.
Исамов Н.Н., Умеров Э.У., Камалов М.Б. и др. Питательная среда для выращивания микобактерий туберкулеза // А.С. № 1473343, 1986.
Кочмарський В.А. Удосконалення діагностики туберкульозу великої рогатої худоби та методичні підходи одержання вакцинних штамів мікобактерій / Автореф. … д. вет. н.-К., 2003.-36 с.
Лысенко А.П., Карпова Г.А.,Агеева Т.Н. Специфичность антигенов Mycobacteriumbovisпри диагностике туберкулёза крупного рогатого скота в ИФА // Ветеринария .-1992.-№3.-С.22-24.
Метод предпосевной обработки биоматериала для выделения микобактерий /Р.А Нуратинов [и др.].// Проблемы туберкулеза и болезней легких.– 2006. – № 9. –С. 48-50.]
Осташко Ф.И. Туберкулин, изготовленный на синтетической среде // Труды УИЭВ.-1954.-т.20.-С.73-76.
Ощепков В.Г., Таллер Л. А., Панкратова А. Д., Вассимирская Т. А., Шевцов А. С. Питательная среда для культивирования микобактерий туберкулеза RU 2382076 C1 Опубликовано: 20.02.2010
Ощепков В.Г. Таллер Л.А. Секин Е.Ю. Питательная среда для выделения и культивирования l-форм микобактерий туберкулеза RU 224251. Опубл. 20.12.2004
Попеску Т.Т. Питательная среда для культивирования микобактерий туберкулеза // А.С. № 1555358, 1988.
Прокопьева, Н.И., Протодьяконова Г.П.; Обоева Н.А. Эпизоотологический мониторинг микобактериозов крупного рогатого скота в Якутии [Данные за 2002-2010 гг.]/ Н.И. Прокопьева, Г.П Протодьяконова.; Обоева Н.А. //Материалы Междунар. науч.-практ. конф. "Актуал. проблемы инфекц. болезней молодняка и др. возрастных групп с.-х. животных, рыб и пчел". – М., 2011. – С. 194-197.
Романенко В.Ф. и соавт. Изменчивость возбудителя туберкулёза в организме не свойственного хозяина // Ветеринария.-1997,-№ 1.-С.20-24.
Сафонова С.Г., Аникин В.А., Голышевская В.И. Транспортная среда для возбудителя туберкулеза // Патент СССР № 4870743/13 от 30.12.93.
Сосов Р.Ф. Эпизоотология.//М.:Колос, 1974.– С.107-118.
Симбирцев В.Е. с соавт. О соотносительности статистических показателей при оценке эпизоотического состояния животноводства по туберкулёзу // Актуальные вопросы эпизоотологии : Тез.науч.док.науч.конф.-Казань.-1983.-С.39.
Ткаченко А.А. Эпизоотическое состояние по туберкулезу крупного рогатого скота и совершенствование методов диагностики // Автор.дисс. докт.вет.наук., Киев, 2000, С.43.
Ткаченко, О.А. Корд-фактор та вірулентність Mycobacteriumbovis швидкорослого штаму та атипових мікобактерій./ О.А. Ткаченко В.В. Зажарський, В.В. Гребенюк //Ветеринарна медицна України.- 2012.- № 3.- С. 10-13.
Тогунова А.И., Хатеневер М.Л., Жулина Л.В. Иммунобиологические свойства антигенных комплексов микобактерий туберкулёза // Ж. Микробиология, эпидем. и иммунол., 1961., №9.- 116-120.
Туберкулез – причины//http: live.com.ua/health/diseasese/infetsionnye-i-parazitarnye-bolezni/13217-tuderculez-obzor-informatsii/tuberculez-prichiny
Тяхнас К.К. Изучение парааллергических реакций и вызывающих их атипичных микобактерий у молодняка крупного рогатого скота// Автореф. Докт.вет.наук..,Таллин.,1975.-с.25.
Характеристика микобактерий туберкулеза http://main.rudn.ru/_new/russian/win/tubrus/01_mbt/01_01_01_etio_MBT_index.htm
Хоменко А.Г., Омаров Т.О ,Каминская Г.О.,Блонская Г.Ю. // Проблемы туберкулёза.-1991.-№8.-С.32-36.
Хорст, А. Молекулярные основы патогеннеза болезней./А. Хорст.//М.:Медицина, 1982. – 454 с.
Шаров А.Н., Шевырев Н.С.,Гринев А.А., Плотников Э.С. Препараты применяемые для диагностики туберкулёза животных // Ветеринария.-1978, №10.-С.43-50.
Шемякин И.Г. Использование молекулярно-биологических методов для индивидуальной характеристики штаммов Mycobacterium tuberculosis // Ж. Микробиологии эпидемиологии и иммунобиологии.-2000, №2.-С.6-11.
Электронно-микроскопическое изучение микобактерий туберкулеза/ И.И.Белоконов., Б.Т. Стегний., А.М. Коваленко., Завгородний А.И., Стегний М.Ю., Репин Н.В. \\ Ветеринарная медицина: межвед. темат. науч. сб. Х.- 2004. - Вып.84.- С. 71-75.
Allison, M.R. Documentation of case of tuberculosis in pre-Columbian America./ M.R. Allison, O.Mendoza, A.Pezzia// Am.Rev.Respir.Dis.–1973.– Vol. 107.– P. 985–991.
Andersen P. et al. Proteins released from Mycobacterium tuberculosis during growth. Infect. Immun. -1991- 59, 1905-1910.
Arabino-mycolates derived from cell-wall skeleton of Mycobacterium bovis BCG as a prominent structure for recognition by host immunity. Miyauchi M, [et all.] //Drug Discov Ther. –2011.– № 5– Р.130-135.
BBL Seven H11 Agar (Deep Fill). Mетодики контроля качества/– http://www.bd.com/resource.aspx?IDX=24652 BBL Seven H11 Agar (Deep Fill) L007412.
Bernard L., Lebong M. // Ann.Med.-1929.-Vol.4, P.25.
Borgdorff M.W., Nagelkerke N., Van Soolingen D.et al. // Аmer. J. Epidemiol.-1998.-Vol.147, N2.-P.187-195.
Böttger, E. C. Approaches for identification of microorganisms./ E. C. Böttger, // ASM News. – 1996. – Vol. 62.– P. 247-250.
Brambilla.Cyclopropanation of α-mycolic acids is not required for cording in Mycobacterium brumae and Mycobacterium fallax.// C.Brambilla, A Sánchez-Chardi, M., E. Julián, M Luquin.// Microbiology. –2012. – Vol. 158. –P. 1615-1621.
Brandt L.K., Elhay M., Rosenkrands I. Et al. // Infect.and Immun. –2000.-Vol.68.– P.791-795.
Brennan P.J. Structure, function, and biogenesis of the cell wall ofMycobacterium tuberculosis.//Tuberculosis.–2003.– Vol. 83.– P.91–97.
Cardona, P.J. A dynamic re-infection hypothesis of latent tuberculosis infection. Infection 2009.–Vol. 37. P. 80-86.
Clifton-Hadley R.S., Wilesmith J.W.// Vet.Record.-1991, 129. -P.5-12.
Cocito C Preparation and properties of antigen 60 from Mycobacterium bovis BCG. C Cocito and F Vanlinden.// Clin Exp Immunol.– 1986 Vol. 66, N 2. P: 262–272.
Cohn D.L., Obrien R.J. The use of restriction fragment length polymorphism (RFLP) analysis for epidemiological studies of tuberculosis in developing countries./ Cohn D.L., Obrien R.J. Int.J. Tuberc.Lung Dis.-1998.-Vol.2, N1.-P.16-26.
Corner, LA.Primary isolation of Mycobacterium bovis from bovine tissues: conditions for maximising the number of positive cultures/ L.A. Corner, E.Gormley, D.U.Pfeiffer //Vet Microbiol.– 2012.–156(1-2). P. 162-171.
Daffé M,Lanée MA. Analysis of the Capsule of Mycobacterium tuberculosis//Methods Mol Med.– 2001.–Vol.54.– P. 217-227.
Detection and identification of mycobacteria by amplification of rRNA./ B.. Böddinghaus, [et all.]//J.Clin.Microbiol. –1990.– Vol. 28. – P. 1751-1759.
Direct Visualization of the Outer Membrane of Mycobacteria and Corynebacteria in Their Native State/ B. Zuber et. 2008. Vol. 190, N 16. – P. 5672-5680.
Dubos, R.J., and G. Middlebrook. Media for tubercle bacilli. Am. Rev. Tuberc. 1947.–Vol. 56.– P. 334-345.
Frehel C, Ryter A, Rastogi N, David H. The electron-transparent zone in phagocytized Mycobacterium avium and other mycobacteria: formation, persistence and role in bacterial survival.//Ann. Inst. Pasteur Microbiol.– . 1986.– Vol.137B.–№3. – Р.239-257.
Genotypic identification of mycobacteria by nucleic acid sequence determination: report of 2-year experience in a clinical laboratory. Kirschner, P.[еt all.],//J. Clin. Microbiol. – 1993.– Vol. 31.– 2882-2889.
Harth G., Horwitz M.A. Expression and efficient export of enzymatically active Mycobacterium tuberculosis glutamine synthetase in Mycobacterium smegmatis and evidense thet the information for export is contained within the protein . J.Biol.Chem. –1997.– Vol. 272. – P 728-22,735.
Harth G., Horwitz M.A. Export of recombinant Mycobacterium tuberculosis superoxide dismutase is dependent upon both information in the protein and mycobacterial export machinery. A model for studying export of leaderless proteins by pathogenic mycobacteria. J.Biol.Chem.1999.-Vol. 274, 4281-4292
Hutter B. Properties of the 40 kDa antigen of Mycobacterium tuberculosis, a functional L-alanine dehydrogenase./ B Hutter M Singh//Biochem J. 1999. Vol 343 : P. 669–672.
Instructions for use – ready-to-use plated media BD Middlebrook 7H10 Agar https://www.bd.com/resource.aspxIDX=22859BBL Middlebrook 7H9 Broth with Glycerol L007467
Intact molecular characterization of cord-factor(trehalose-6,6-dimycolate) from nine species of Mycobacteria by MALDI-TOF mass spectrometry/Y. Fuita. T. [et all.] // Microbyology.- 2005.-Vol. 151.- 3403-3416.
Klegerman M.E. Chemical and ultrastructural investigations of Mycobacterium bovis BCG: implications for the molecular structure of the mycobacterial cell envelope //FEMS Immunol Med Microbiol.1996. – Vol. 15.№ 4.–Р. 213-222.
MikolajczekK.,KrzyzaniakJ.,LubenskaB.Zastosowaniechromatografiicienkowarswowejdotypowaniamycobacterii.-Pneumol.Pol., 1980,N6.-Vol.48, 375-381..48, 375-381.
Middlebrook, G., and M.L. Cohn. 1958. Bacteriology of tuberculosis: laboratory methods. Am. J. Pub. Health. 48:844-853.
Middlebrook, G., M.L. Cohn, W.E. Dye, W.B. Russell, Jr., and D. Levy. 1960. Microbiologic procedures of value in tuberculosis. Acta Tuberc. Scand. 38:66-81.
Paul TR, Beveridge TJ. Preservation of surface lipids and determination of ultrastructure of Mycobacterium kansasii by freeze-substitution.// Infect Immun. 1994.-Vol.62.N 5. – P.1542-1550.
Preparation of solid media for culture and DST// www.tbcare1. org/.../Module_Preparation of solid media for culture and DST.
Properties of proteins MPB64, MPB70, and MPB80 of Mycobacterium bovis BCG. //M Harboe [et all.]// Infect Immun.– Vol. 52, N 1. P. 293–302.
Route of BCG administration in possums affects protection against bovine tuberculosis./ Aldwell F.E. et al. // NZ Vet.J.1995.-43.-356-359.
Ryter A, Frehel C, Rastogi N, David HL. Macrophage interaction with mycobacteria including M. leprae.//Acta Leprol. – 1984.-№ 2(2-4).-Р. 211-226.
Slosarek M. // Atypical Mycob.-Budapest, 1973.-P.135-142.
Sikorska E.,Priegnitz A. // Med. Dosw. Microbiol.-1969.-Vol.21..-P.151-157.
Srinivasan V., Deepak А., Parthasarathi A.Unveiling Unusual Features of Formation of Septal Partition and Constriction in Mycobacteria—an Ultrastructural Study.//J. Bacteriol. -2012. Vol. 194,N 3.– P 702-707.
Stepashina V.N.et al. // Int.J. Tuberc.Lung Dis.-1999.-Vol.3, N1.-P.149-152.
The ribosomal database project (RDP)./ Maidak, B.L [et all.]//Nucleic Acid Res. –1996.– Vol. 24.– P. 82-85.
Yamamoto T. Electron microscopy of mycobacterium leprae murium in ultra-thin sections of murine leprosy lesions./ T Yamamoto, M. Nishiura, N. Harada, T. Imaeda //. Int. J. Lepr.– 1958. Vol. 26, N2.– P. 111-114.
Wiker H. G. The antigen 85 complex: a major secretion product of Mycobacterium tuberculosis./ H G Wiker and M Harboe.//Microbiol. Mol. Biol. Rev. –1992.–Vol. 56 N 4.– P. 4648-661.
Патогенез и клинические признаки туберкулеза
Необходимо констатировать, что патогенез туберкулеза крупного рогатого скота остается мене изученным, чем патогенез этого заболевания у людей. Как указыва.т V.Mitchellи соавт. (2006), достижения в области человеческого туберкулеза были в основном сделаны с использованием различных мелких животных (при моделировании инфекции M. tuberculosis). Относительно бычьего туберкулеза была сделана экстраполяция результатов полученных на мелких животных. Такая экстраполяция не всегда соответствует истине, поскольку существуют глубокие различия в восприимчивости, иммунном ответе, окружающей среде, экологии и поведении хозяина, а именно крупного рогатого скота [29].
Симптомы туберкулеза крупного рогатого скота обычно развиваются через несколько месяцев после инфицирования, но возбудители могут также оставаться «спящими» в течение многих лет и активироваться в периоды стресса или с возрастом [30].
Патогенез туберкулёза во многом зависит от того, впервые животное заразилось возбудителем этой инфекции или туберкулёзный процесс развивается в уже зараженном организме. По этой причине различают первичный и вторичный туберкулёз. Определение патогенеза вторичного туберкулёза затруднено сложностью установления его происхождения – экзогенного или эндогенного. Он может развиваться как эндогенная реинфекция, т.е. возникать в результате активизации микобактерий и распространению их из первичного очага поражения при снижении иммунитета под воздействием неблагоприятных факторов – ухудшения условий содержания и кормления, стрессов, ослабления другими болезнями. Также возможно развитие вторичного туберкулёза после повторного заражения микобактериями.
Первичный туберкулёз развивается у впервые заразившихся животных. При попадании массивной дозы высоковирулентных микобактерий обычно первичные изменения возникают в месте их внедрения – в воротах инфекции. При алиментарном заражении воротами инфекции являются глотка и тонкий кишечник, где наибольшее скопление лимфоидной ткани. При аэрогенном пути заражения первичные изменения обнаруживают в наиболее вентилируемых участках лёгких – диафрагмальных долях лёгких под плеврой. При внутриутробном попадании инфекции первичные изменения локализуются в печени.
Первичное туберкулёзное поражение не всегда указывает на ворота инфекции. Иногда микобактерии, не задерживаясь в воротах инфекции, сразу проникают обслуживающие их региональные лимфатические узлы, вызывая изменения в них. При заражении малыми количествами микобактерий последние, не вызывая изменений в воротах инфекции и лимфоузлах, с током лимфы разносятся по организму и локализуются в наиболее чувствительных органах, которыми обычно являются лёгкие у млекопитающих и печень у птиц.
Из первичного очага туберкулёзный процесс распространяется по лимфатическим сосудам в региональные лимфатические узлы, где также возникают туберкулёзные изменения. Лимфоузлы увеличенные, плотные.
Развитие туберкулёзного поражения (туберкул) происходит следующим образом. Макрофаги и гистиоциты фагоцитируют попавших в организм микобактерий, но их не лизируют. Большинство возбудителей туберкулёза продолжают размножаться в макрофагах, вызывая их гибель. Токсины микобактерий вызывают пролиферацию эпителиоидных клеток, которые, сливаясь, образуют многоядерные гигантские клетки. Это очень активные макрофаги.
Так формируется фокус туберкулёзного процесса, который выглядит как сероватый узелок размером от просяного зерна до лесного ореха. В центре узелка в результате притока фагоцитов, выделяющих протеиназу, действия токсинов микобактерий и образования тромбов в капиллярах происходит некроз клеток. Зона некроза окружена эпителиоидными клетками, единичными гигантскими клетками, а также лейкоцитами, лимфоидными клетками и фибробластами. В цитоплазме лейкоцитов, эпителиоидных и гигантских клеток находится большое количество деформированных и погибших микобактерий. В дальнейшем, после формирования вокруг туберкулёзного очага грануляционной ткани, образуется туберкул.
В зависимости от сопротивляемости организма к инфекции и вирулентности возбудителя различают три формы туберкул. Альтеративные туберкулы возникают у животных с ослабленными иммунитетом или при высокой вирулентности возбудителя. Особенность таких туберкулов – слабое развитие грануляционной ткани и быстро развивающийся казеозный некроз. Экссудативные туберкулы развиваются при гиперэргической реакции организма на возбудителя, характеризуются сильным воспалением и слабо выраженной грануляционной тканью. Продуктивные туберкулы образуются у животных с повышенными иммунитетом или при заражении слабовирулентными возбудителями. В продуктивных туберкулах слабо выражен некроз и сильно развита эпителиоидная ткань с гигантскими клетками.
Для первичного туберкулёза характерна стадия первичного комплекса, который может быть полным, неполным и сложным. Полный первичный комплекс характеризуется одновременным поражением органа и его региональных лимфоузлов. При неполном первичный комплексе поражаются только лимфоузлы, изменений в соответствующем органе не обнаруживают. Сложный первичный комплекс проявляется полным и неполным первичными комплексами в разных органах.
Выявление первичного комплекса имеет важнейшее значение для оценки пути передачи инфекции. Первичным комплексом при туберкулезе считается сочетание поражений в начальном очаге инфекции и региональных лимфатических узлах. В случае длительного или тяжелого диссеминированного туберкулеза, определение первичного комплекса может быть невозможным. Кроме того, когда заражение происходит через слизистые оболочки глотки и кишечника, начальные поражения слизистой могут быть не видны, в то время как в регионарных лимфатических узлах поражения выявляются [29].
Возможны два варианта течения первичного туберкулёза. Как правило, первичный комплекс подвергается заживлению, но при неблагоприятном течении может развиться вторая стадия – ранняя генерализация. Генерализация заболевания характеризуется проникновением микобактерий из очага первичного поражения в кровеносные и лимфатические сосуды и заносом в чувствительные органы.
Вторичный туберкулёз может развиться после угасания первичного. Он может проявляться в двух формах: поздней генерализации и изолированного поражения органов. Поздняя генерализация отличается от ранней отсутствием первичного комплекса. Изолированное поражение органов возникает при ослаблении сопротивляемости к инфекции и может распространяться только по воспаленным ходам органа.
Животное при хороших условиях содержания и кормления может болеть туберкулёзом несколько лет, оставаясь клинически здоровым. По этой причине большое диагностическое значение имеет исследование лимфоузлов. При туберкулёзе они увеличены иногда в несколько раз, плотные, малоподвижные, бугристые, безболезненные или малочувствительные.
У крупного рогатого скота, овец и коз чаще поражаются лёгкие. В связи с этим одним из первых клинических признаков при туберкулёзе является кашель, вначале редкий, затем частый и болезненный. Возникает кашель при вдыхании холодного воздуха, питье холодной воды, приеме корма, через несколько минут после начала движений. В начале заболевания перкуссией и аускультацией отклонений от нормы не выявляют. По мере прогрессирования туберкулёза дыхание становится частым и прерывистым, при аускультации слышны хрипы и ослабленное везикулярное дыхание. При появлении шероховатости плевры или образовании на ней туберкул прослушивается шум трения. При перкуссии выявляют очаги притупления. Перкуссия грудной клетки также вызывает у животных кашель и беспокойство. При тяжелом течении наблюдают выделение желтой жидкости из носа.
Поражение кишечника проявляется поносами и запорами. Фекалии жидкие с примесью слизи, иногда гноя и крови.
Больное туберкулёзом животное сохраняет аппетит, но постепенно худеет. Постепенное развитие малокровия выражается побледнением слизистых оболочек. Кожа сухая, шерсть становится взъерошенной и тусклой. Температура тела остается в пределах нормы, но по мере развития болезни может незначительно повышаться.
Поражение вымени у крупного рогатого скота протекает в форме мастита. Вначале поражаются задние доли вымени, затем туберкулёзный процесс может переходить на передние доли. Вымя становится уплотненным, горячим и болезненным. Надои молока уменьшаются, оно становится водянистым. Иногда в молоке наблюдают примесь творожистых крошек или гной.
В большинстве случаев у зараженной птицы клинические признаки не наблюдаются, но могут наблюдаться общее угнетение и истощение. В условиях интенсивного промышленного использования, может иметь место внезапная смерть, часто ассоциированная с серьезными поражениями в печени; такие поражения легко наблюдаются при посмертном исследовании.
Обобщение результатов исследования патогенеза туберкулеза у крупного рогатого скота дает все основания полагать, что передача M.bovisвосновном происходит через дыхательные системы посредством контаминированных аэрозолей. Следовательно, бычий туберкулез является «дыхательной» инфекцией и в большинстве случаев заражение происходит через «прямую» передачу возбудителя между животными, находящихся в непосредственной близости. Пероральное попадание микобактерий из объектов внешней среды, в том числе кормов, также не может быть исключено, [21; 25; 28]
Туберкулез у крупного рогатого скота, как правило – хроническая болезнь, но в отдельных случаях быть острым и быстропрогрессирующим [30].
Ранние инфекции часто протекают бессимптомно, при выполнении программам ликвидации, большинство инфицированного скота выявляется на ранних стадиях и проявление признаков заболевания является редкостью. На поздних стадиях общие симптомы заболевания проявляются прогрессирующее истощение, незначительное колебания температуры, слабость и отсутствие аппетита. У животных с легочной формой туберкулеза, как правило, наблюдается влажный кашель, усиливающийся утром, во время холодной погоды или упражнений, и может иметь место одышка или учащенное дыхание.
В терминальных стадиях, и животные могут быть чрезвычайно истощены, у них развиваются острые респираторные расстройства. У некоторых животных заглоточные или другие лимфатические узлы увеличиваются, что может привести к их разрыву. Значительно увеличенные лимфатические узлы могут также мешать нормальному функционированию кровеносных сосудов, дыхательных путей или пищеварительного тракта.
У оленей туберкулез, вызванный M.bovis, может иметь подострое или хроническое течение, У некоторых животных единственным симптомом могут быть абсцессы неизвестного происхождения в изолированных лимфатических узлах, а специфические симптомы заболевания не развиваются в течении нескольких лет.
По данным большинства исследователей[29; 34] в дикой природе у белохвостого оленя и другие оленевых поражения туберкулезного характера чаще всего возникают в медиальных заглоточных лимфатических узлах и миндалинах. Такой первичный комплекс туберкулезных поражений этих видов жвачных сходен с таковым у человека и указывает на пероральный путь передачи инфекции. Подтверждением этому служат установленные данные о передаче возбудителя от оленя к оленю посредством обмена кормом [31].
Представляют определенный интерес данные о манифестации инфекции M.bovisу кошек [30].Cимптомы могут включать потерю веса, субфебрильную температуру, обезвоживание, снижение аппетита и, возможно, рвоту или понос. Если в инфекционном процессе задействованы дыхательные пути, есть кашель, одышка и хрипы. Дыхательная недостаточность может возникать при нагрузке, если есть значительный плевральный экссудат. При кишечной форме туберкулеза увеличиваются брыжеечные лимфатические узлы, иногда достаточно сильно.
У кошек распространена и кожная форма инфекции, которая может проявляться в виде отека, язв и свищей, чаще всего на мордочке, шее или лопатках. У некоторых особей заболевание проявляется в виде деформации лба или переносицы. На терминальном этапе развития инфекции могут размягчаться или вообще уничтожаться кости носа и морды. Необычная форма туберкулеза у кошек главным образом влияет на глаза. Первыми симптомами могут быть слепота или ненормальная реакция зрачков, истечения из глаз, экссудат в стекловидном теле. На поздних стадиях наблюдаются васкуляризация, конъюнктивит, а также абсцессы в периорбитальной ткани.
У опоссумов бычий туберкулез обычно развивается молниеносно (2–7 месяцев) в виде заболевания легких. В заключительной стадии заболевания, у животных путанная походка, они не могут подняться, активны в дневное время. Напротив, большинство инфицированных M.bovisбарсуков не имеют видимых повреждений и могут выживать в течение многих лет. Симптомами бычьего туберкулезаа у них, в первую очередь, являются респираторные заболевания. [22].
ПАТОГЕНЕЗ И КЛИНИЧЕСКИЕ ПРИЗНАКИ ТУБЕРКУЛЁЗА Механизмы передачи микобактерий и особенности патогенеза при туберкулёзе
Животное или человек с активным туберкулёзом при кашле, с экскретами, молоком выделяют кислотоустойчивые бациллы. При заражении аэрогенным путем эти бациллы накапливаются в периферических воздушных путях, а при заражении алиментарным путем – в желудочно-кишечном тракте. Возможность развития инфекции зависит как от продолжительности и интенсивности поступления МБТ, так и от эффективности защиты организма. Обосновавшись в легочной паренхиме, МБТ начинают размножаться, вызывая первичную туберкулёзную пневмонию, поглощаются легочными макрофагами и доставляются в региональные медиастинальные лимфатические узлы, откуда они могут распространятся через лимфу или кровь по всему организму. Для туберкулёза характерен гематогенный путь распространения инфекции и бактериемия [11; 14; 17]. З. А. Лебедева [7] и другие авторы [9; 16; 18; 19; 20] считают, что первым этапом болезни при туберкулёзе является рассеивание возбудителя туберкулёзной инфекции, подтверждающееся наличием бацилл и морфологических изменений в различных органах.
До клинической манифестации заболевания, альвеолярные макрофаги обрабатывают микобактериальные антигены, которые активизируют циркулирующие Т-лимфоциты. Сенсибилизированные Т-лимфоциты начинают вырабатывать лимфокины через 6–10 недель после первичного заражения. Именно в это время проявляется положительная реакция на туберкулин. К этому моменту гематогенная диссеминация прекращается и чрезвычайно усиливается уничтожение внутриклеточно расположенных МБТ. Казеозный некроз, наблюдаемый в участке туберкулёзного поражения – это результат гидролитической активности макрофагов и лимфоцитов. Часть пораженных участков рассасывается полностью, а некоторые фибринизируются и в последующем кальцинируются. Туберкулёзные бациллы в тканях могут сохранятся на протяжении многих лет и реактивироваться при ослаблении напряженности иммунитета.
Важным для понимания особенностей патогенеза туберкулеза является тот факт, что заболевание относится к внутриклеточным инфекциям, с чем связывают высокую способность возбудителя к персистенции. Обобщая достаточно обширные данные литературы Brennan P.J. (2003) [23] констатирует, что микобактерии первично инфицируют макрофаги хозяина, используя особые «приемы» выживания и размножения в этих высокоспециализированных клетках. Микобактерии приспособили фагосомы, образующиеся при попадании возбудителя в макрофаг, для своей жизнедеятельности, при этом получая несомненные преимущества, необходимые для «уклонения» от действия защитных механизмов хозяина, таких как: антитела и система комплемента. При помощи маннозного, а также системы комплемента (CR1, CR3 и CR4) рецепторов, микобактерии связываются с мембраной макрофага и фагоцитируются внутрь клетки. Внутри фагосомы, микобактерии производят её ремоделинг таким образом, что нарушается процесс её созревания и дальнейшее слияние с лизосомой для образования фаголизосомы, в которой и происходит лизис клеток других видов микроорганизмов. В отличие от нормальной фагосомы, микобактериальная имеет значительные различия в составе мембран и их внутреннего содержимого. Эта фагосома имеет маркеры раннего этапа созревания (англ. early endosome), такие как ,tkrb rab5, coronin-1, кроме того, существует активное взаимодействие между ранними эндосомами и микобактериальной фагосомой, что обеспечивает микобактерии питательными веществами [31].
Как указывает M Daffé, (1999) [26], одним из ключевых факторов патогенности микобактерий являются гликаны капсул микобактерий, которые обеспечивают адгезию к клетке хозяина, а затем проникновение в нее, а также, вероятно участвует во внутриклеточном размножении возбудителя. Кроме того, капсула препятствует диффузии макромолекул к внутренней части оболочки бактерий, выделяет ферменты, участвующие в детоксикации реакционноспособных интермедиатов кислорода, в частности каталазы, пероксидазы и супероксиддисмутазы фагоцитов, что может обуславливать активное сопротивление бактерии бактерицидным механизмам хозяина. Наконец, в капсуле выявлено токсическое действие липидов и контакт-зависимые литические вещества, а также компоненты, которые ингибируют макрофаг и лимфопролиферации, тем самым объясняя часть иммунопатологии туберкулеза.
К факторам патогенности микобактерий также относят сульфолипиды, расположеные на поверхности бактериальной клетки, липидогликаны, способные модулировать секрецию цитокинов макрофагами и их эффекторные функции. Также было установлено, что антигены М. avium, локализованные на наружной поверхности клеточной оболочки, имеют тенденцию к накоплению в фагосомах после длительного инфицирования макрофагов, а гликопептидолипиды изменяют проницаемость их мембраны, обуславливая иммуносуппрессивное дейстиве на макрофаги [32]
Вышеприведенные особенности взаимодействия микобактерий и макрофагов обуславливают незавершенный характер фагоцитоза –микобактерии в нейтрофилах и макрофагах не погибают, а размножаются. Персистенция возбудителя в фагоцитируемых клетках – один из главных механизмов хронизации инфекционного процесса при туберкулезе. Необходимо отметить, что в период развития инфекционного процесса активизируются и гуморальные факторы иммунопротекции, но их роль во фтизиоиммунитете незначительная [10].
Приток фагоцитирующих клеток к очагу воспаления неизбежно сопровождается высвобождением ими в окружающую среду большого количества протеиназ, активирующих калликреин-кининовую систему крови и обладающих сильным разрушительным действием. Здоровый организм защищен от протеолитической агрессии мощной системой ингибиторов. Однако при туберкулёзе синтез низкомолекулярных ингибиторов слизистой бронхов в той или иной мере угнетается, а острофазный рост плазменных ингибиторов протеиназ оказывается недостаточным в силу их интенсивного потребления и инактивации продуктами свободно-радикального окисления. В результате накапливается избыток свободных протеолитических ферментов, играющих важную роль в воспалении и деструкции легочной ткани, а также в генерации других медиаторов [2; 3; 5; 13].
Причиной дисбаланса в системе «протеиназы–ингибиторы» является развитие внутрисосудистой коагуляции крови, поскольку действующие по механизму протеолитических каскадов системы гемостаза и фибринолиза претерпевают острофазные сдвиги и выходят из режима оптимальной саморегуляции.
Свой вклад в этот процесс вносят тромбоциты, индуцированные изменениями баланса в системах липидных медиаторов и функционально активных белков. Возникающая закупорка микрососудов тромботическими массами, нарушая кровоснабжение тканей, препятствует репаративным процессам и создает матрикс для последующего фиброзирования [6; 12].
При туберкулёзе основные белковые системы гомеостаза в значительной степени утрачивают самоконтроль и начинают работать в режиме, усугубляющем процессы воспаления и деструкции.
В системе гуморальной регуляции, непосредственно управляющей функциональным статусом иммунокомпетентных и фагоцитирующих клеток и процессами их взаимодействия, важная роль принадлежит липидным медиаторам и плазменному белку фибронектину.
Фибронектин представляет собой макромолекулярный гликопротеин, несущий на своей поверхности огромное количество сайтов, с помощью которых он быстро и прочно связывается как с патологическими молекулами, так и с различными бактериями. Фагоцитирующие клетки имеют на своей поверхности рецепторы к фибронектину, благодаря чему легко поглощают образующиеся комплексы, а сам фибронектин оказывается ключевым фактором в реализации процессов фагоцитоза.
В очагах тканевых поражений фибронектин, комплексируясь с коллагеном и выпавшим фибрином, откладывается в виде решетки и, стимулируя пролиферацию фибробластов и клеток эпителия, служит инициатором и матриксом для реализации процессов репарации и фиброзирования [15; 24; 25; 33].
При естественном развитии туберкулёза в организме чувствительного животного содержание фибронектина в плазме крови и бронхоальвеолярном пространстве претерпевает фазовые изменения. В начальный период развития инфекции в бронхоальвеолярном пространстве происходит накопление фибронектина, служащего мощным фактором хемотаксиса и инициации фагоцитоза для клеток моноцитарно-макрофагальной системы. На этапе генерализации специфических изменений и расплавления казеоза содержание фибронектина резко снижается в силу интенсивного потребления.
Позже по времени аналогичные закономерности просматриваются и в плазме крови. Высокий уровень фибронектина в жидких средах организма сопутствует периодам мобилизации защитных сил организма и выраженных репаративных процессов. Неудержимое прогрессирование заболевания сопровождается истощением системы фибронектина [4].
Развитие и эволюция туберкулёза опосредуются сложным комплексом тесно взаимосвязанных патохимических реакций, определяющих интенсивность и эффективность фагоцитоза, прогрессирование и отграничение воспаления, процессов деструкции и репарации.
Оптимальный, или напротив, несбалансированный характер этих реакций взаимосвязан как с генетическими, так и с приобретенными особенностями организма, факторами кормления и содержания [8].
Нашими исследованиями было установлено, через три месяца после заражения морских свинок возбудителем туберкулеза бычьего вида (штамм Vallae) развиваются типичные, очень хорошо выраженные распространяющиеся туберкулезные изменения в легких, а в печени, селезенке и лимфатических узлах – тотальные поражения, часто с преобладанием некрозов.
Нами при проведении гематологических и биохимических исследований крови от морских свинок всех групп через месяц после заражения было установлено, что показатели количества эритроцитов и концентрации гемоглобина у животных первой и второй групп были достоверно выше, чем у животных третьей группы [1]. Перекисная резистентность эритроцитов у неиммунизированных животных была ниже (р≤0,05), чем у морских свинок опытной группы, иммунизированных изучаемым препаратом, и составила 17,6 %. В плазме крови животных третьей группы концентрация См оказалась выше на 107 %, ЦИК – на 91 %, активность АсАТ – на 108 % по сравнению с соответствующими показателями у животных четвертой группы, а содержание мочевины оказалось ниже на 46 % (р≤0,05). Отмечена также тенденция к снижению концентрации альбумина.
Через три месяца после заражения у животных контрольной группы установлено достоверное снижение в 1,3 раза концентрации гемоглобина в эритроцитах, в 1,4 раза – альбумина и в 1,7 раза – активности АлАТ в плазме крови в сравнении с интактными животными (р≤0,01) (табл. 3).
Таблица 3. Гематологические и биохимические показатели крови морских свинок
|
Показатели |
Группы | |||
|
1 ПКП-3 + заражения n=20 |
2 БЦЖ + заражения n=10 |
3 Контроль + заражения n=9 |
4 Интактные животные n=6 | |
|
Эритроциты, млн/мкл |
7,4±0,25 |
8,23±0,5 |
7,46±0,3 |
8,66±1,1 |
|
Гемоглобин, г/л |
105±6,9* |
112±5,0* |
89,7±5,0 |
121,0±5,5* |
|
Альбумин, г/л |
41,4±2,1* |
44,4±3,9* |
34,3±3,4 |
49,4±8,0* |
|
АлАТ, ммоль/л·ч |
2,3±0,23 |
2,02±0,3 |
1,7±0,6 |
2,9±0,8* |
|
АсАТ, ммоль/л·ч |
1,0±0,12* |
1,3±0,2 |
1,67±0,3 |
1,8±0,4 |
|
Мочевина,мкмоль/л |
1,8±0,16* |
1,8±0,26* |
1,07±0,1 |
1,7±0,09* |
|
ЦИК, г/л |
0,16±0,002* |
0,18±0,02* |
0,1±0,01 |
0,2±0,03* |
|
Серомукоиды,г/л |
0,055±0,008* |
0,048±0,01* |
2,9±0,2 |
0,09±0,015* |
Примечание: «*» – разница достоверна по отношению к контролю (р≤0,05).
Полученные данные указывают на снижение синтезирующей функции печени, что, по всей видимости, связано с поражением этого органа при развитии туберкулезного процесса при экспериментальном заражении.
У зараженных животных наблюдали также развитие иммуносупресивного состояния: концентрация серомукоидов выросла в 32 раза, а концентрация ЦИК была в 2 раза ниже относительно этих показателей у интактных животных.
Биохимические исследования крови иммунизированных животных дали возможность установить, что препарат ПКП-3 и вакцина БЦЖ сдерживают развитие патобиохимических изменений в организме животных.
Концентрация альбумина и активность АлАТ снижались у животных первой группы только в 1,2 раза, а у животных второй группы – в 1,2 раза и 1,3 раза соответственно, в сравнении с показателями интактных морских свинок.
Введение препаратов способствовало также снижению иммуносупресии в организме зараженных морских свинок: уровень серомукоидов был выше в 1,25–1,1 раза, а концентрация ЦИК даже повышалась в сравнении с показателями у животных четвертой группы.
Другие биохимические показатели крови иммунизированных и в дальнейшем инфицированных животных также существенно не отличались от таковых у интактных животных.
Патологоанатомическими исследованиями морских свинок, иммунизированных противотуберкулезным комплексным препаратом ПКП-3 и в последующем зараженных возбудителем туберкулеза бычьего вида (штамм Vallae), выявлено, что только у трёх животных развивались туберкулезоподобные изменения в лимфатических узлах регионарных месту введения возбудителя туберкулеза (табл. 4).
Таблица 4. Обобщенные данные патологоанатомических исследований морских свинок
|
Группа животных |
Количество животных в конце опыта |
Количество животных с различными степенями патологоанатомических изменений внутренних органов, свойственных туберкулезу, по классификации А. И. Тогуновой |
% защиты | ||||
|
Отсутствуют поражения |
Слабая степень |
Средняя степень |
Генерализованная форма | ||||
|
ПКП-3 |
18 |
15 |
3 |
— |
— |
84 | |
|
БЦЖ |
10 |
4 |
4 |
2 |
— |
40 | |
|
Кон- троль |
9 |
— |
— |
— |
9 |
0 | |
У иммунизированных вакциной БЦЖ поражения внутренних паренхиматозных органов средней степени по классификации А. И. Тогуновой, туберкулёзом обнаружены у двух животных, слабой – у четырёх особей. У животных контрольной группы наблюдали множественные туберкулезные очаги в лимфатических узлах, печени, селезенке, сливающиеся в скопления отторгнутых клеток.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Бiохiмiчнi показники кровi тварин, iмунiзоiваних протитуберкульозним комплексним препаратом ПКП-3 /А.М.Коваленко, В.О. Бусол, Л.В.Коваленко, В.С.Антонов // Наук.-техн. бюл. Iнституту землеробства i бiологiї тварин. Серiя - Фiзiологiя i бiохiмiя.- Львiв, 1999.- Вип.1(3).- С.183-185.
Закс О.В. Клиническое значение показателей протеолитической активности мокроты у больных туберкулёзом лёгких:Автреф. Дисс. … канд.мед.наук.-М, 1987.
Каминская Г.О. и соав. // Проблемы туберкулёза.-1991.-№6.- С.55-58.
Каминская Г.О., Абдулаев Р.Ю. и соавт. Молекулярные механизмы межклеточных взаимодействий при прогрессировании и заживлении туберкулёза // Проблемы туберкулёза. -1996. -№6. -С.19-22.
Каминская Г.О., Жукова Н.Л., Чуканов В.И. // Проблемы туберкулёза.-1983.-№12.-С.50-56.
Каминская Г.О., Серебряная Б.А., Казакова Л.В. // Проблемы туберкулёза.-1991.-№8.-С.5-8.
Лебедева З.А. // Проблемы туберкулёза. -1952. -№6.- С.8-20.
Литвинов В.И., Мороз А.М., Гергерт В.Я. Достижения и перспективы исследований в области иммунологии и иммуногенетики туберкулёза // Проблемы туберкулёза.-1996.-№6.-С.14-18.
Пузик В.И. Патоморфология начальных форм первичного туберкулёза у человека.-М.,1958.
[Рекомендации по специфической профилактике туберкулёза крупного рогатого скота / Сост.: Ласкавый В.Н., Панфёров В.И., Галкина О.А.; ФГОУ ВПО «Саратовский ГАУ». – Саратов, 2008. – 12 с.]
Рубинштейн Г.Р. // Проблемы туберкулёза .-1947.-№2.-С.8-20.,
Серебряная Б.А., Казакова Л.В. // Всесоюзный конгресс по болезням органов дыхания,2-й.-Челябинск.-1991.-С.156.
Степанян И.Э. Клиническое значение показателей протеолитических ферментов и их ингибиторов в бронхоальвеолярном содержимом у больных с диффузным поражением лёгких: Автореф.дисс. .. канд.мед.наук.-М.,1986.
Струков А.И., Серов В.В. // Патологическая анатомия.-М.,1985.
Федоров Н.А., Овчарук И.Н., Федотов А.В. // Вестн. АМН СССР.-1987. -№7.-С.53-60.
Хоменко А.Г., Омаров Т.О.,Каминская Г.О.,Блонская Г.Ю. // Проблемы туберкулёза.-1991.-№8.-С.32-36.
Шувалова Е.П. Инфекционные болезни.-М.,1990.
Эйнис В.Л. Туберкулёз.-М.,1961.
Barnes P.F., Arevalo C. // J.Infect.Dis. -1987. -Vol.156, N2. -P.377-379.
Bernard L., Lebong M. // Ann.Med.-1929.-Vol.4, P.25.
Biet, F., Zoonotic aspects of Mycobacterium bovis and Mycobacterium avium–intracellulare complex (MAC) Biet, F., Boschiroli, M.L., Thorel, M.F., Guilloteau, Vet. Res. 2005. 36, 411–436.
[BovinecTuberculosis//Rev.2009. – C.: 1-6 http://www.cfps.iastate.edu/Factsheets/pdfs/bovine_tuberculosis.pdf]
[Brennan PJ. Structure, function, and biogenesis of the cell wall ofMycobacterium tuberculosis. Tuberculosis 2003. 83:91–97.]
Brown E.J., Goodwin J.L. // J.Exp.Med. -1988. -Vol. 167. -P.777-793.
Cassidy J. P, The pathogenesis and pathology of bovine tuberculosis with insights from studies of tuberculosis in humans and laboratory animal models// Veterinary Microbiology, vol. 112, no. 2–4, pp. 151–161, 2006.
Daffé, M. The capsule of Mycobacterium tuberculosis and its implications for pathogenicity. M Daffé, G Etienne // Tuberculosis and Lung Disease.–1999.–Vol.: 79, N 3. –P. 153-169
Grinelli F., Billingham R.E., Burgess L. // J.Invest.Derm. -1981.-Vol.76. -P.181-189.
Herd-Level Risk Factors for Bovine Tuberculosis: A Literature Review Review Article /Veterinary Medicine International Volume Robin A. [] 2012 (2012), Article ID 621210, 10 pages http://www.hindawi.com/journals/vmi/2012/621210/
Mitchell V Advances in bovine tuberculosis diagnosis and pathogenesis: What policy makers need to know/Mitchell V. Palmer, W. Ray Waters// Veterinary Microbiology.–2006.–Vol. 112.–P. 181–190.
[[Monies B, Bovine tuberculosis in cats. / Monies B, Jahans K, de la Rua R. Vet Rec. – 2006. – Vol. 158. –P. 245-246. ].
[Mycobacterium tuberculosis //http://www.mikrobiki.ru/nauka/klinicheski-vazhnye-bakterii/mycobacterium-tuberculosis.html].
Rastog, N. The mycobacteria: an introduction to nomenclature and pathogenesis /N. Rastog, iE. Legrand & C. Sola //Rev. sci. tech. Off. int. Epiz.– 2001.– Vol. 20,N 1.– P. 21-54
Saba T.M., Blumenstock F.A., Shah D.M. et al. // Amer.Surg.-1984.-Vol.199.-P.87-96.
(Tonsillar lesions in whitetailed deer (Odocoileus virginianus) naturally infected with Mycobacterium bovis. Palmer, M.V. [ ]2002. Vet. Rec. 151, 149–150.).

