
- •1 Основные положения молекулярно-кинетической теории газа. Понятие о идеальном и реальном газе.
- •2 Параметры и функции состояния. Уравнение состояния идеального газа.
- •3 Смеси газов. Кажущаяся молекулярная масса. Газовая постоянная смеси газов.
- •4 Первый закон термодинамики.
- •5 Энтальпия газа.
- •6 Теплоемкость газа. Удельные теплоемкости газа. Средние и истинные теплоемкости.
- •7 Теплоемкость газа в изохорном и изобарном процессах. Уравнение Майера.
- •8 Изохорный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •9 Изобарный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •10 Изотермический процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •11 Адиабатный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •12 Политропный процесс. Вывод уравнения. Изменение теплоты и работы в процессе,
- •13 Политропный процесс. Обощающий характер процесса
- •14 Тепловая диаграмма в координатах p-V
- •15 Второй закон термодинамики.
- •16 Прямой цикл Карно.
- •17 Энтропия газа.
- •18 Циклы холодильных установок.
- •19 Обратный цикл Карно.
- •20 Реальные газы. Уравнение Ван-дер-Ваальса. Изотерма Ван-дер-Ваальса.
- •21 Диаграмма h-s водяного пара. Определение параметров состояния.
- •22 Диаграмма h-s водяного пара. Расчет изменений внутренней энергии, работы и теплоты в паровых процессах.
- •23 Способы передачи теплоты. Суть каждого.
- •24 Понятие о стационарном и нестационарном теплообмене, тепловом потоке, плотности теплового потока.
- •25 Закон Фурье.
- •26 Теплопроводность через плоскую стенку.
- •27 Теплопроводность через цилиндрическую стенку.
- •28 Теплопроводность через многослойную плоскую стенку.
- •29 Теплопроводность через многослойную цилиндрическую стенку.
- •30 Коэффициент теплопроводности. Методика экспериментального определения.
- •31 Теплоотдача. Факторы влияющие на интесивность теплоотдачи. Уравнение Ньютона.
- •32 Критерии подобия: Nu, Re, Ре, Pr, Gr.
- •34 Коэффициент теплоотдачи. Методика экспериментального определения.
- •35 Лучистый теплообмен. Тепловые лучи, их свойства. Способность тел поглощать, и отражать тепловые лучи.
- •36 Закон Планка
- •37 Закон Стефана-Больцмана.
- •38 Методика экспериментального определения коэффициента излучения.
- •39 Лучистый теплообмен между двумя параллельными поверхностями.
- •40 Ослабление излучения экранами.
- •41 Составной теплообмен. Учет лучистого теплообмена при расчете теплоотдачи.
- •42 Теплопередача между средами разделенными плоской стенкой.
- •43 Теплопередача между средами разделенными цилиндрической стенкой.
5 Энтальпия газа.
В термодинамике
важную роль играет сумма внутренней
энергии системы U и произведения давления
системы р на ее объем V, называемая
энтальпией и обозначаемая Н:
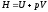 .
.
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия
обладает свойством аддитивности.
Величина
 ,
называемая удельной энтальпией (h =
H/M), представляет собой энтальпию системы,
содержащей 1 кг вещества, и измеряется
в Дж/кг.
,
называемая удельной энтальпией (h =
H/M), представляет собой энтальпию системы,
содержащей 1 кг вещества, и измеряется
в Дж/кг.
Поскольку
энтальпия есть функция состояния, то
она может быть представлена в виде
функции двух любых параметров
состояния:
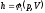 ;
;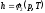 ;
;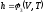 ,
а величина dh является полным дифференциалом.
,
а величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе
определяется только начальным и конечным
состояниями тела и не зависит от
характера процесса. При расчетах
практический интерес представляет
изменение энтальпии в конечном
процессе:
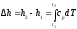
6 Теплоемкость газа. Удельные теплоемкости газа. Средние и истинные теплоемкости.
Отношение
количества теплоты
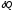 ,
полученного телом при бесконечно малом
изменении его состояния, к связанному
с этим изменению температуры тела
,
полученного телом при бесконечно малом
изменении его состояния, к связанному
с этим изменению температуры тела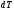 ,
называется теплоемкостью тела в данном
процессе:
,
называется теплоемкостью тела в данном
процессе:
 .
.
Обычно
теплоемкость относят к единице
количества вещества и в зависимости
от выбранной единицы различают: удельную
массовую теплоемкость c , отнесенную
к 1 кг газа, Дж/(кг·К); удельную объемную
теплоемкость c´, отнесенную к количеству
газа, содержащегося в 1 м3 объема при
нормальных физических условиях,
Дж/(м3·К); удельную мольную теплоемкость
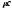 ,
отнесенную к одному киломолю, Дж/(кмоль·К).
Зависимость между удельными теплоемкостями
устанавливается очевидными
соотношениями:
,
отнесенную к одному киломолю, Дж/(кмоль·К).
Зависимость между удельными теплоемкостями
устанавливается очевидными
соотношениями: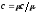 ;
;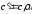
Для идеальных газов теплоемкость не зависит от давления, а зависит от температуры, атомности и условий нагрева или охлаждения, причем с увеличением температуры газа его теплоемкость повышается.
Под средней
теплоемкостью понимают отношение
количества теплоты q, подведенной к
единице количества вещества (газа), к
изменению его температуры от t1 до t2 при
условии, что разность температур t2 –
t1 является величиной конечной.
 Под истинной теплоемкостью понимают
теплоемкость газа, соответствующую
бесконечно малому изменению температуры
газа, соответствующую бесконечно малому
изменению температуры dt, т. е. c = dq/dt.
Под истинной теплоемкостью понимают
теплоемкость газа, соответствующую
бесконечно малому изменению температуры
газа, соответствующую бесконечно малому
изменению температуры dt, т. е. c = dq/dt.
7 Теплоемкость газа в изохорном и изобарном процессах. Уравнение Майера.
В соответствии
с первым законом термодинамики для
закрытых систем, в которых протекают
равновесные процессы
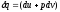 ,
и
,
и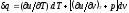 .
Для изохорного процесса (v=const) это
уравнение принимает вид
.
Для изохорного процесса (v=const) это
уравнение принимает вид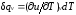 ,
и, учитывая (1.5), получаем, что
,
и, учитывая (1.5), получаем, что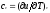 ,
т. е. теплоемкость тела при постоянном
объеме равна частной производной от
его внутренней энергии по температуре
и характеризует темп роста внутренней
энергии в изохорном процессе с увеличением
температуры.
,
т. е. теплоемкость тела при постоянном
объеме равна частной производной от
его внутренней энергии по температуре
и характеризует темп роста внутренней
энергии в изохорном процессе с увеличением
температуры.
Для идеального
газа

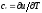 Для изобарного процесса () из уравнения
(2.16) и (2.14) получаем
Для изобарного процесса () из уравнения
(2.16) и (2.14) получаем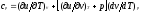 или
или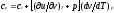
Это уравнение
показывает связь между теплоемкостями
ср и сv. Для идеального газа оно
значительно упрощается. Действительно,
внутренняя энергия идеального газа
определяется только его температурой
и не зависит от объема, поэтому
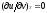 и, кроме того, из уравнения состояния
следует
и, кроме того, из уравнения состояния
следует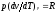 ,
откуда
,
откуда
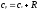 .
Это соотношение называется уравнением
Майера и является одним из основных в
технической термодинамике идеальных
газов.
.
Это соотношение называется уравнением
Майера и является одним из основных в
технической термодинамике идеальных
газов.
