
- •1 Основные положения молекулярно-кинетической теории газа. Понятие о идеальном и реальном газе.
- •2 Параметры и функции состояния. Уравнение состояния идеального газа.
- •3 Смеси газов. Кажущаяся молекулярная масса. Газовая постоянная смеси газов.
- •4 Первый закон термодинамики.
- •5 Энтальпия газа.
- •6 Теплоемкость газа. Удельные теплоемкости газа. Средние и истинные теплоемкости.
- •7 Теплоемкость газа в изохорном и изобарном процессах. Уравнение Майера.
- •8 Изохорный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •9 Изобарный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •10 Изотермический процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •11 Адиабатный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
- •12 Политропный процесс. Вывод уравнения. Изменение теплоты и работы в процессе,
- •13 Политропный процесс. Обощающий характер процесса
- •14 Тепловая диаграмма в координатах p-V
- •15 Второй закон термодинамики.
- •16 Прямой цикл Карно.
- •17 Энтропия газа.
- •18 Циклы холодильных установок.
- •19 Обратный цикл Карно.
- •20 Реальные газы. Уравнение Ван-дер-Ваальса. Изотерма Ван-дер-Ваальса.
- •21 Диаграмма h-s водяного пара. Определение параметров состояния.
- •22 Диаграмма h-s водяного пара. Расчет изменений внутренней энергии, работы и теплоты в паровых процессах.
- •23 Способы передачи теплоты. Суть каждого.
- •24 Понятие о стационарном и нестационарном теплообмене, тепловом потоке, плотности теплового потока.
- •25 Закон Фурье.
- •26 Теплопроводность через плоскую стенку.
- •27 Теплопроводность через цилиндрическую стенку.
- •28 Теплопроводность через многослойную плоскую стенку.
- •29 Теплопроводность через многослойную цилиндрическую стенку.
- •30 Коэффициент теплопроводности. Методика экспериментального определения.
- •31 Теплоотдача. Факторы влияющие на интесивность теплоотдачи. Уравнение Ньютона.
- •32 Критерии подобия: Nu, Re, Ре, Pr, Gr.
- •34 Коэффициент теплоотдачи. Методика экспериментального определения.
- •35 Лучистый теплообмен. Тепловые лучи, их свойства. Способность тел поглощать, и отражать тепловые лучи.
- •36 Закон Планка
- •37 Закон Стефана-Больцмана.
- •38 Методика экспериментального определения коэффициента излучения.
- •39 Лучистый теплообмен между двумя параллельными поверхностями.
- •40 Ослабление излучения экранами.
- •41 Составной теплообмен. Учет лучистого теплообмена при расчете теплоотдачи.
- •42 Теплопередача между средами разделенными плоской стенкой.
- •43 Теплопередача между средами разделенными цилиндрической стенкой.
8 Изохорный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
При изохорном
процессе выполняется условие dv = 0 или
v = const. Из уравнения состояния идеального
газа следует, что p/T=R/v=const, т. е. давление
газа прямо пропорционально его абсолютной
температуре: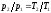 .
.
Количество
теплоты, подведенной к рабочему телу в
процессе 12 при
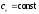 ,
определяется как:
,
определяется как: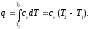 Так как l= 0, то в соответствии с первым
законом термодинамики
Так как l= 0, то в соответствии с первым
законом термодинамики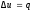 и
и
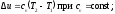
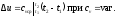
9 Изобарный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
Из уравнения
состояния идеального газа при р=const
находим
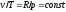 ,
или
,
или ,
т. е. в изобарном процессе объем газа
пропорционален его абсолютной температуре
(закон Гей-Люссака, 1802 г.). На рисунке
изображен график процесса. Из выражения
,
т. е. в изобарном процессе объем газа
пропорционален его абсолютной температуре
(закон Гей-Люссака, 1802 г.). На рисунке
изображен график процесса. Из выражения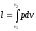 следует,
что
следует,
что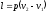 .
Так как
.
Так как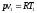 и
и ,
то одновременно
,
то одновременно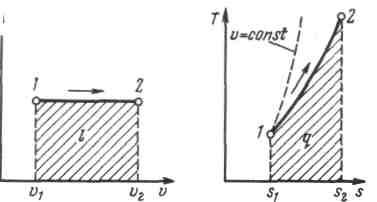
 Количество теплоты, сообщаемое газу
при нагревании (или отдаваемое им при
охлаждении):
Количество теплоты, сообщаемое газу
при нагревании (или отдаваемое им при
охлаждении):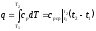 ,
где
,
где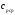 —
средняя массовая изобарная теплоемкость
в интервале температур от t1 до t2 при
—
средняя массовая изобарная теплоемкость
в интервале температур от t1 до t2 при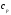 =
const
=
const .
.
10 Изотермический процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
При
изотермическом процессе температура
постоянна, следовательно, pv = RT = const,
или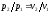 ,
т. е. давление и объем обратно
пропорциональны друг другу, так что
при изотермическом сжатии давление
газа возрастает, а при расширении —
падает (закон Бойля — Мариотта, 1662 г.).
Работа процесса:
,
т. е. давление и объем обратно
пропорциональны друг другу, так что
при изотермическом сжатии давление
газа возрастает, а при расширении —
падает (закон Бойля — Мариотта, 1662 г.).
Работа процесса: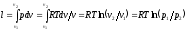 .
Так как температура не меняется, то
внутренняя энергия идеального газа в
данном процессе остается постоянной
(
.
Так как температура не меняется, то
внутренняя энергия идеального газа в
данном процессе остается постоянной
(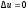 )
и вся подводимая к газу теплота
полностью превращается в работу
расширения:
)
и вся подводимая к газу теплота
полностью превращается в работу
расширения: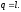

11 Адиабатный процесс. Вывод уравнения, график в координатах p-V и t-s. Изменение внутренней энергии, теплоты и работы в процессе.
Процесс,
происходящий без теплообмена с
окружающей средой, называется
адиабатным, т. е. .
Для того чтобы осуществить такой
процесс, следует либо теплоизолировать
газ, т. е. поместить его в адиабатную
оболочку, либо провести процесс настолько
быстро, чтобы изменение температуры
газа, обусловленное его теплообменом
с окружающей средой, было пренебрежимо
мало по сравнению с изменением
температуры, вызванным расширением
или сжатием газа. Как правило, это
возможно, ибо теплообмен происходит
значительно медленнее, чем сжатие или
расширение газа. Уравнения первого
закона термодинамика для адиабатного
процесса принимают вид:
.
Для того чтобы осуществить такой
процесс, следует либо теплоизолировать
газ, т. е. поместить его в адиабатную
оболочку, либо провести процесс настолько
быстро, чтобы изменение температуры
газа, обусловленное его теплообменом
с окружающей средой, было пренебрежимо
мало по сравнению с изменением
температуры, вызванным расширением
или сжатием газа. Как правило, это
возможно, ибо теплообмен происходит
значительно медленнее, чем сжатие или
расширение газа. Уравнения первого
закона термодинамика для адиабатного
процесса принимают вид: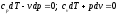 .
Поделив первое уравнение на второе,
получим
.
Поделив первое уравнение на второе,
получим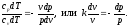 Интегрируя последнее уравнение при
условии, что k =cp/cv=const, находим
Интегрируя последнее уравнение при
условии, что k =cp/cv=const, находим После
потенцирования имеем
После
потенцирования имеем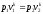 .
Это и есть уравнения адиабаты идеального
газа при постоянном отношении
теплоемкостей (k = const). Величина
.
Это и есть уравнения адиабаты идеального
газа при постоянном отношении
теплоемкостей (k = const). Величина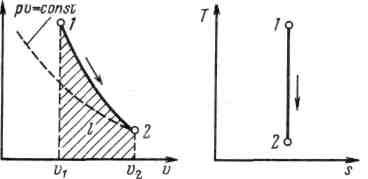
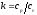 называется показателем адиабаты.
Подставив cp = cv-R, получим k. Согласно
классической кинетической теории
теплоемкость газов не зависит от
температуры, поэтому можно считать,
что величина k также не зависит от
температуры и определяется числом
степеней свободы молекулы. Работа
расширения при адиабатном процессе
согласно первому закону термодинамики
совершается за счет уменьшения внутренней
энергии и может быть вычислена по одной
из следующих формул:
называется показателем адиабаты.
Подставив cp = cv-R, получим k. Согласно
классической кинетической теории
теплоемкость газов не зависит от
температуры, поэтому можно считать,
что величина k также не зависит от
температуры и определяется числом
степеней свободы молекулы. Работа
расширения при адиабатном процессе
согласно первому закону термодинамики
совершается за счет уменьшения внутренней
энергии и может быть вычислена по одной
из следующих формул:
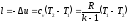 .
Так как
.
Так как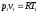 и
и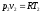 ,
то
,
то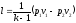 .
В данном процессе теплообмен газа с
окружающей средой исключается, поэтому
q=0. Выражение
.
В данном процессе теплообмен газа с
окружающей средой исключается, поэтому
q=0. Выражение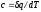 показывает, что теплоемкость
адиабатного процесса равна нулю.
Поскольку при адиабатном процессе
показывает, что теплоемкость
адиабатного процесса равна нулю.
Поскольку при адиабатном процессе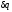 =
0, энтропия рабочего тела не изменяется
(ds=0 и s=const). Следовательно, на
Т,s-диаграмме адиабатный процесс
изображается вертикалью.
=
0, энтропия рабочего тела не изменяется
(ds=0 и s=const). Следовательно, на
Т,s-диаграмме адиабатный процесс
изображается вертикалью.
