
5M
.pdfМинистерство транспорта Российской Федерации Федеральное агентство железнодорожного транспорта
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Дальневосточный государственный университет путей сообщения»
Кафедра «Физика»
Е.А. Антонычева, Н.Н. Рекунова, Г.В. Куликова
ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
Методические указания на выполнение лабораторной работы
Хабаровск Издательство ДВГУПС
2013
УДК 536.7(075.8) ББК В 317.1я73
А 725
Рецензент: Профессор кафедры «Физика»
Дальневосточного государственного университета путей сообщения
А.В.Сюй
Антонычева Е.А.
Изучение изотермического процесса : метод. указания на вы-
А725 полнение лабораторной работы. – Хабаровск : Изд-во ДВГУПС,
2013. – 19 с. : ил.
Цель методических указаний помочь студенту в выполнении лабораторной работы по теме «Изучение изотермического процесса». Кратко рассмотрены основы теории затрагивающей темы. Даны методика и порядок выполнения лабораторной работы.
Указания предназначены для студентов 1-го и 2-го курсов всех форм обучения технических специальностей, изучающих дисциплину «Физика».
УДК 536.7(075.8) ББК В 317.1
© ДВГУПС, 2013
2
ВВЕДЕНИЕ
Термодинамика и молекулярная физика изучает макроскопические процессы в телах, т. е. такие явления, которые связаны с колоссальным количеством содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический и термодинамический. Первый лежит в основе молекулярной физики, второй – термодинамики.
Молекулярная физика, изучает не только макроскопические явления, но и рассматривает свойства и строение отдельных молекул и атомов. А также законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода.
Рассмотренный эксперимент является одним из методов физических исследований. Его значение важно и в самостоятельной работе студента, что позволяет ему изучить различные явления окружающего мира.
Физический практикум позволяет студенту решать ряд экспериментальных задач:
‒научиться воспроизводить изучаемое явление;
‒производить анализ физического явления;
‒получить навыки работы с измерительными инструментами и приборами.
Методическая разработка по выполнению лабораторной работы «Изучение изотермического процесса» особенно актуальна по содержанию и своим задачам для студентов первого курса. В ней изучаются законы идеальных газов.
Экспериментальная проверка закона Бойля-Мариотта позволяет уяснить смысл идеализации физических явлений и модель идеального газа.
Вэкспериментальной части работы измеряют изотермический модуль сжатия и массу воздуха, находящегося в баллоне.
3

ТЕМА: ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
Цель работы:
1.Изучить зависимость давления воздуха от объёма при постоянной температуре.
2.Измерить изотермический модуль всестороннего сжатия.
3.Определить массу воздуха, накаченного в баллон.
Приборы и принадлежности: воздушные баллоны, микрокомпрессор, краны, клапаны, соединительные трубки.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1. Идеальный газ
Состояние некоторой массы газа m характеризуется такими физическими величинами, как объём (V), давление (P) и температура (T), которые являются основными термодинамическими параметрами. Можно доказать, что все параметры термодинамической системы, находящейся в равновесном состоянии, независимы: внутренние параметры такой системы зависят только от внешних параметров и температуры.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В настоящее время можно применять только две температурные шкалы – термодинамическую в кельвинах (К) и Международную практическую, в градусах Цельсия (С○). Соотношение между ними имеет вид:
T 273,15 t .
При Т = 0 прекращается хаотическое тепловое движение молекул газа. Эта температура называется абсолютным нулем. Важно, что для идеального газа абсолютная температура не может быть отрицательной: но существуют системы, когда такие состояния осуществляются. Они носят название состояний с инверсной заселенностью энергетических уровней, то есть такие системы являются неравновесными.
Объём газа V всегда совпадает с объёмом сосуда, в котором он находится.
Давление есть физическая величина, численно равная силе, действующей на единицу площади поверхности по нормали к ней:
PdFn , [P] = Па. dS
4

Уравнение, связывающее любой термодинамический параметр системы с параметрами, принятыми в качестве независимых переменных, называется уравнением состояния. Уравнение состояния, связывающее для однородного тела давление P, объём V и температуру T, термодинамическим уравнением состояния системы:
f ( P,V ,T ) 0.
Простейшим объектом, для которого в термодинамике может быть рассмотрено термическое уравнение состояния, является идеальный газ. Идеальным называется газ, молекулы которого имеют пренебрежительно малый собственный объём, не взаимодействуют друг с другом на расстоянии, а при взаимном столкновении ведут себя как абсолютно упругие шарики с диаметром d, зависящим от химической природы газа.
При нормальных условиях, то есть при давлении P0 = 1,01 105 Па и температуре Т0 = 273,15 ○К, многие газы (например, водород, гелий, неон, азот, кислород, воздух и другие) можно считать (с хорошим приближением) идеальными.
1.2. Уравнение состояния идеального газа
Термическое уравнение состояния идеального газа, связывающее параметры идеального газа, называется уравнением Клапейрона
PV |
B . |
(1.1) |
|
|
|||
T |
|||
|
|
Для заданной массы идеального газа произведение давления газа на объем, деленное на абсолютную температуру, есть величина постоянная.
При изменении давления и температуры соответственно изменяется и объем, выражение PV/T сохраняется постоянным, равным некоторой величине, именуемой газовой постоянной. Ее значение зависит только от массы и рода газа. Объем V mv , где v – удельный объем газа, то уравнение Клапейрона можно переписать.
Pv CT , |
(1.2) |
где C=B/m – универсальная газовая постоянная, зависящая только от химического состава газа.
В одном моле любого вещества содержится одно и тоже число молекул Na, называемое постоянной Авогадро Na = 6,02·1023 моль-1 .
Если m0 – масса одной молекулы, то масса произвольного количества вещества равна:
5

k R Na
m m0 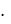 Na
Na 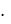 ,
,
где M m0 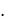 Na – молярная масса газа, равная отношению массы газа к
Na – молярная масса газа, равная отношению массы газа к
содержащемуся в нем количеству вещества M |
m v . |
|
||||
Величина равная |
Vm |
V |
называется молекулярным объемом. Пере- |
|||
v |
||||||
|
|
|
|
|
||
пишем уравнение состояния идеального газа (1.1) в форме: |
|
|||||
|
|
PVm |
v BT или PVm |
RT , |
(1.3) |
|
B
где R MB – молярная газовая постоянная.
V
Согласно закону Авогадро: при одинаковых давлениях и температуре молярные объемы различных газов тоже одинаковы.
Из закона Авогадро и уравнения (1.3) следует, что молярная газовая постоянная R одинакова у всех газов. Поэтому ее принято называть универсально газовой постоянной. Экспериментально установлено, что R = = 8,31 Дж/(моль·К).
Для произвольной массы m газа можно переписать уравнение (1.1) в виде:
PV |
m |
RT . |
(1.4) |
|
M |
||||
|
|
|
В такой наиболее общей форме термодинамическое уравнение со-
стояния идеального газа называется уравнением Клапейрона-Менде- леева.
Из этого уравнения выразим плотность газа:
|
m |
|
PM |
. |
(1.5) |
|
|
|
|
|
|
|
|
||||
V |
|
RT |
|
|
|
|
||
Если ввести постоянную Больцмана k, равную отношению универ- |
|
|
||||||
сальной газовой постоянной R к постоянной Авогадро Na: k |
R |
1,38 10 |
2 |
|||||
|
|
|||||||
Na |
|
|||||||
|
|
|
|
|
|
|
||
1,38 10 23 Дж/К, получим выражение: |
|
|
|
|
|
|
|
|
|
|
P |
kNa |
T kTn0 , |
(1.6) |
|
|
||||
|
|
|
Vm |
|
|
где n0 |
Na |
– концентрация молекул газа. |
|
||
|
|
||||
|
Vm |
|
|
|
|
6

1.3. Изопроцессы идеального газа
Термодинамические процессы, в которых изменение состояния газа происходит, когда один из параметров сохраняется постоянным, а два оставшихся изменяются, носят общее название изопрцессов.
1) Изотермический процесс – процесс, когда изменение состояния газа происходит при постоянной температуре. (T = const).
Такой закон описывается законом Бойля и Мариотта, установленном на основе экспериментов. При изотермическом процессе произведение давления на объем для данной массы газа (m = const) есть величина постоянная:
|
|
PV const . |
(1.7) |
Р |
|
||
|
|
|
|
|
|
Графически эта зависимость изобра- |
|
|
|
||
|
|
жается равнобокой гиперболой и носит |
|
|
T3 |
название изотермы (рис 1.1). Для одной |
|
|
T2 |
и той же массы разные изотермы соот- |
|
|
ветствуют различным температурам |
||
|
T1 |
||
|
T1 <T2 <T3 . |
|
|
|
V |
|
|
|
2) Изобарический процесс – процесс, |
||
|
|
||
Рис. 1.1. График изотермического |
когда изменение состояния газа происхо- |
||
процесса |
дит при постоянном давлении (P=const). |
||
Обозначим объем некоторой массы газа при 0 ○С через VO . При изобарическом нагревании его на t○ его объем возрастет и сделается равным Vt. Такой процесс описывается законом Гей-Люссака, который также был установлен опытным путем: при изобарическом процессе относительное
увеличение объема данной массы газа (m = const) |
|
V |
Vt |
VO |
прямо |
||||
V |
O |
|
V |
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
O |
|||
пропорционально увеличению температуры, при постоянном |
давлении |
||||||||
(P = const). |
|
|
|
|
|
|
|
|
|
Vt |
V0 |
t , |
|
|
|
|
(1.8) |
||
|
|
V0 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
где – коэффициент пропорциональности, называемый коэффициентом объемного расширения.
Коэффициент численно равен относительному увеличению объема газа (по отношению к объему, измеренному при 0 ○С) при нагревании его на 1 градус. Как показали опыты, этот коэффициент для всех газов одинаков и равен 1/273 град-1 .
7
Следовательно, |
Vt V0 |
1 |
t или Vt V0 1 |
1 |
t . |
(1.9) |
||
|
|
|
273 |
|||||
V0 |
273 |
|||||||
|
|
|
|
|||||
График зависимости объема газа V от температуры t является прямой линией (рис 1.2).
V, м3
1
273 VO t
t ○C
0 |
t, ○C |
|
|
Рис 1.2. График изобарного процесса
3) Изохорический процесс – процесс, когда изменение состояния газа происходит при постоянном объеме (V = const).
Если давление некоторой массы газа при температуре 0 ○С будет P0, то при изохорическом нагревании газа на t ○С давление возрастает и становится равным Pt. Изохорический процесс описывается опытным законом Шарля: при изохорическом процессе относительное увеличение давления
данной массы газа (m = const) |
P |
|
Pt P0 |
прямо пропорционально уве- |
P |
|
P |
||
|
|
|
||
|
0 |
0 |
|
|
личению температуры при постоянном объеме (V = const).
Pt |
P0 |
t , |
(1.10) |
|
P0 |
||
|
|
|
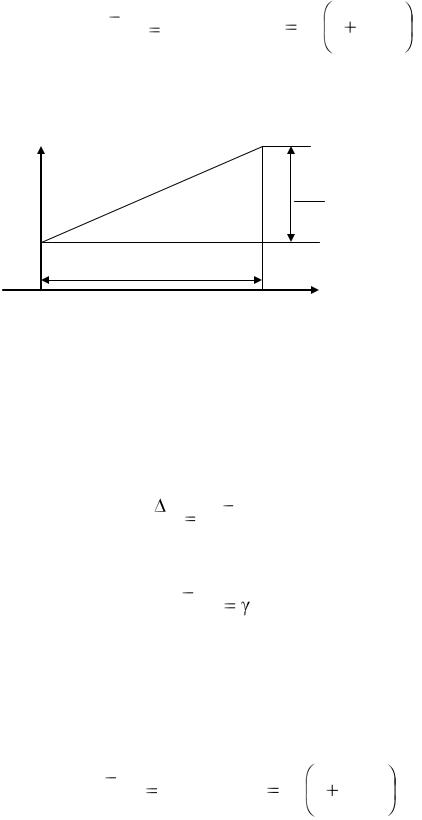
где 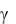 – коэффициент пропорциональности, называемый температурным коэффициентом давления и численно равный относительному увеличению давления газа (по отношению к давлению газа взятому при 0 ○С) при нагревании газа на 1 градус. Эксперименты показали, что этот коэффициент для всех газов одинаков и равен 1/273 град-1, следовательно,
– коэффициент пропорциональности, называемый температурным коэффициентом давления и численно равный относительному увеличению давления газа (по отношению к давлению газа взятому при 0 ○С) при нагревании газа на 1 градус. Эксперименты показали, что этот коэффициент для всех газов одинаков и равен 1/273 град-1, следовательно,
Pt P0 |
|
1 |
или Pt |
P0 1 |
1 |
t . |
(1.11) |
|
tP0 |
273 |
273 |
||||||
|
|
|
|
|||||
График зависимости давления газа P от температуры t изображается в виде прямой линии (рис 1.3). Из рисунка видно, что продолжить эту прямую в область отрицательных температур (по Цельсию) до пересечения ее с осью Х (точка О1), то можно получить уравнение:
8

P |
P 1 |
1 |
t 0 , откуда t = -273 ○C. |
|
|||
t |
0 |
273 |
|
|
|
|
Давление газа на стенки сосуда является следствием ударов молекул об эти стенки, т. е. связано с передачей импульсов стенкам сосуда при ударах молекул. Приведенный выше результат означает, что при t = -273 ○C прекращается поступательное движение молекул. Поэтому температура t=-273 OC носит название абсолютного нуля температуры.
Р, Па
1
273 Р0 t
|
|
РO |
|
O1 |
0 |
t, ○C |
|
|
273 ○C |
t ○C |
|
|
|
||
|
|
||
|
Рис. 1.3. График изохорного процесса |
|
|
Температура, отсчитанная от абсолютного нуля, именуется абсолютной температурой (температурой по Кельвину) и обозначается буквой Т.
Точка плавления льда при нормальном атмосферном давлении оказалась равной 273,15 ○К, а по шкале Цельсия она принята за 0 ○С, поэтому абсолютная температура Т связана с температурой t (по шкале Цельсия) следующим соотношением T = 273,15+t , для приближенных подсчетов можно считать, что T = 273+t
Преобразуем выражение (1.9), характеризующее изобарический процесс, заменяя температуру, отсчитанную по шкале Цельсия, абсолютной температурой.
|
V |
V |
1 |
|
1 |
|
t |
|
|
V |
|
273 |
|
t |
V |
T |
. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
t |
O |
|
|
273 |
|
|
|
o |
|
273 |
|
o 273 |
||||||
|
Обозначим объем газа при температуре Т1 через V1, а при температуре |
||||||||||||||||||
Т |
, через V . Напишем V |
V |
|
|
T1 |
; |
V |
|
V |
|
|
T2 |
|
Поделив почленно равенст- |
|||||
|
273 |
|
|
273 |
|||||||||||||||
2 |
2 |
1 |
|
0 |
|
|
|
2 |
|
0 |
|
|
|
|
|||||
ва, получим:
9
V1 |
|
T1 |
. |
(1.12) |
V |
|
|||
T |
|
|||
2 |
2 |
|
|
|
При изобарическом процессе объем некоторой массы газа прямо пропорционален его абсолютной температуре.
Аналогично можно прийти к выводу, что при изохорическом процессе давление некоторой массы газа прямо пропорционально его абсолютной температуре. Так формируется принцип Шарля.
Р1 |
|
T1 |
. |
(1.13) |
Р |
|
|||
T |
|
|||
2 |
2 |
|
|
|
1.4.Основное уравнение молекулярно-кинетической теории идеальных газов
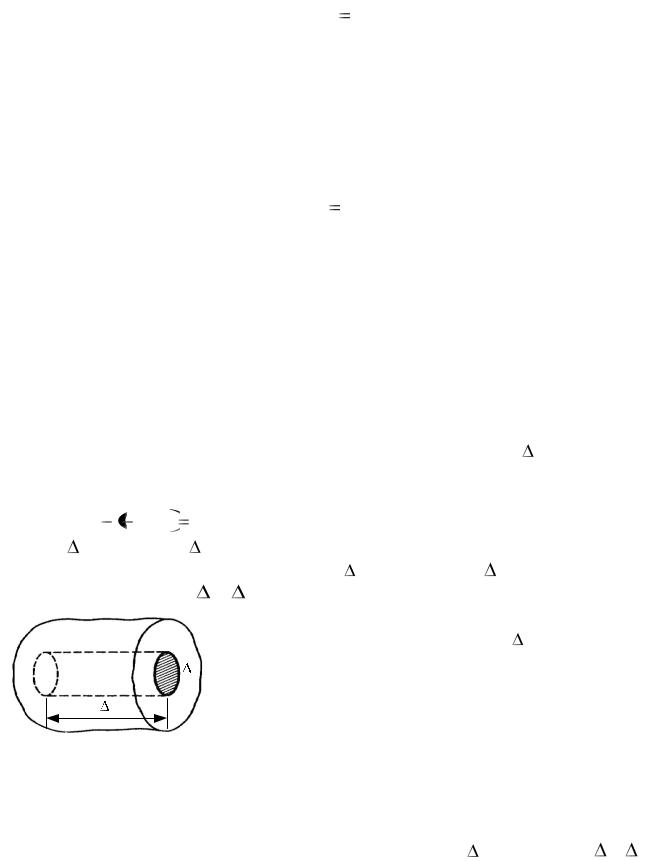
Для вывода основного уравнения молекулярно-кинетической теории рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку S (рис. 1.4) и вычислим давление, оказываемое на эту площадку. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей им-
пульс m0v |
m0v |
2m0v , где m0 – масса молекулы, v – ее скорость. За |
время t площадки |
S достигнут только те молекулы, которые заключе- |
|
ны в объеме цилиндра с основанием S и высотой v t (рис. 1.4). Число этих молекул равно n Sv t ( n – концентрация молекул).
Необходимо, однако, учитывать, что реально молекулы движутся к площадке S под разными
Sуглами и имеют различные скорости, причем скорость молекул при каждом соударении меня-
ется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так
что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул 1/6 движется вдоль данного направления в одну сторону, половина – в противоположную. Тогда число ударов молекул,
движущихся в заданном направлении, о площадку S будет 1 /6 n Sv t . При столкновении с площадкой эти молекулы передадут ей импульс
10
