
lektsii_bav_Tovkusм
.pdf
ω – скорость реакции.
Для периодического реактора и реактора ИВ для реакций первого порядка имеем:
где с0 – начальная концентрация;
с – текущая концентрация;
x – степень превращения;
k – константа скорости реакции.
Для реакций второго порядка:А+В, при сА0=сВ0
Определение времени пребывания реагентов в периодическом реакторе. (Обратимая реакция второго порядка).
В периодическом реакторе проводят реакцию получения этилацетата:
С2Н5ОН + СН3СООН↔СН3СООС2Н5+Н2О
А |
В |
D |
R |
При 100°С константа скорости прямой реакции k1=7,93∙10-6 м3/кмоль∙с, константа равновесия К=2,93. Скорость описывается уравнением:
.
Реагенты загружены в виде водного раствора плотностью 1020 кг/м3, которые имеют состав: в масс.%
этанол (А) |
46 |
уксусная кислота (В) |
23 |
вода (R ) 100-46-23=31

Определить время реакции до достижения степени превращения х, равной 0,6 от равновесной хр.
Решение.
|
|
|
|
|
Концентрации |
||
Компонент |
|
Мм |
|
|
|
|
|
Начальная |
|
|
Конечная |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Кг/кг |
|
Кмоль/м3 |
|
Кмоль/м3 |
|
|
|
|
|
|
|
|
С2Н5ОН (А) |
46 |
0,46 |
|
cA0= 10,20 |
|
cA= cA0-x∙cB0 |
|
|
|
|
|
|
|
|
|
СН3СООН (В) |
60 |
0,23 |
|
cB0=3,91 |
|
cB= cB0-x∙cB0 |
|
|
|
|
|
|
|
|
|
СН3СООС2Н5 (D) |
88 |
0 |
|
cD0=0 |
|
cD=x∙cB0 |
|
|
|
|
|
|
|
|
|
Н2О ( R ) |
18 |
0,31 |
|
cR0=17,75 |
|
cR= cR0-x∙cB0 |
|
|
|
|
|
|
|
|
|
кмоль/м3, |
|
|
|
|
|
|
|
кмоль/м3, |
|
|
|
|
|
|
|
кмоль/м3. |
|
|
|
|
|
|
|
Константу равновесия можно выразить как:
Отсюда находим равновесную концентрацию хр, а затем х, которое равно х=0,6∙хр.
Выражение для скорости по условию имеет вид:
С помощью константы равновесия К=k1/k-1 найдём константу обратной реакции k-1. Тогда выражение для скорости примет вид:

Зная ω(х) и х найдём τ:
Каскад реакторов идеального смешения.
Для реактора идеального смешения:
Чем больше степень превращения, тем меньше кпд реактора. Для того, чтобы этого избежать прибегают к использованию каскада реакторов идеального смешения. Бесконечное количество реакторов в каскаде приближает нас к реактору идеального вытеснения. Обычно в каскаде 3-4 реактора.

Так как объёмы реакторов одинаковы, то общее время пребывания равно:
τ=τ1+τ2+τ3+…+τn
Для реакций первого порядка:
Объём реактора:
τ определяется графическим или аналитическим методом.
1.Геометрический метод. Точность этого метода невелика.
, (с0 и с3 – известны).

2.Аналитический метод.
Для реакций первого порядка:
,; так как реактора одинакового объёма, то τ=τ1=τ2=τ3 – время пребывания в одном реакторе.
,;
,;
,.
Эти уравнения справедливы только для реакторов, которые находятся в одинаковых условиях.
Уравнение Антуана.
Уравнение Антуана связывает температуру и упругость паров чистого вещества.
Когда ниже указанное равенство достигается, жидкость кипит.
где парциальное давление чистого вещества, мм.рт.ст;
хi – мольная доля;
Р – внешнее давление.
где Аi ,Вi, Ci – табличные значения для i-го компонента;
Т – температура, К.
По этому уравнению можно определить температуру начала кипения многокомпонентной смеси.
Пример. Определить температуру начала кипения смеси продуктов хлорирования метана при атмосферном давлении. Коэффициенты уравнения Антуана и мольные доли компонентов представлены в таблице ниже.
№ |
|
Компонент |
Коэффицие |
|
Мольные |
|
||
|
|
|
|
нты |
|
доли |
|
|
|
|
|
|
уравнения |
|
|
||
|
|
|
|
Антуана |
|
|
|
|
|
|
|
|
А |
|
В |
С |
|
|
|
|
|
|
|
|
|
|
1 |
СН2Сl2 |
|
16,3029 |
|
2622,44 |
-41,70 |
0,010 |
|
|
|
|
|
|
|
|
|
|
2 |
СНСl3 |
|
15,9732 |
|
2696,79 |
-46,16 |
0,893 |
|
|
|
|
|
|
|
|
|
|
3 |
ССl4 |
|
15,8742 |
|
2808,19 |
-45,99 |
0,097 |
|
|
|
|
|
|
|
|
|
|
Решаем задачу по уравнению Антуана с помощью оболочки MathCad.
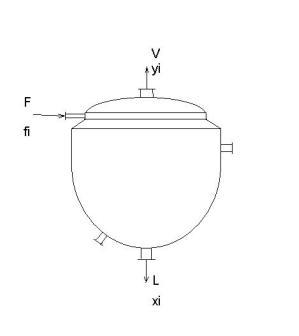
Расчёт куба-испарителя.
Составим уравнение материального баланса для процесса:
F = V + L.
Для каждого i-uj компонента можно записать:
F∙fi = V∙yi + L∙xi.
Состояние равновесия описывается выражением:
yi = ki ∙ xi, где k – константа фазового равновесия.
ki = . Отсюда: .
Пример. В куб-испаритель непрерывно поступает 100 кмоль в час жидкости известного состава. Температура в кубе 110°С, давление атмосферное. Коэффициенты уравнения Антуана представлены в таблице:
№ |
|
Компонент |
Коэффицие |
|
fi |
|
||
|
|
|
|
нты |
|
|
|
|
|
|
|
|
уравнения |
|
|
|
|
|
|
|
|
Антуана |
|
|
|
|
|
|
|
|
А |
|
В |
С |
|
|
|
|
|
|
|
|
|
|
1 |
Бензол |
|
15,9008 |
|
2788,51 |
-52,36 |
0,502 |
|
|
|
|
|
|
|
|
|
|
2 |
Этилбензол |
|
16,0195 |
|
3279,47 |
-59,95 |
0,113 |
|
|
|
|
|
|
|
|
|
|
3 |
Толуол |
|
16,0137 |
|
3096,52 |
-53,67 |
0,297 |
|
|
|
|
|
|
|
|
|
|
4 |
Изопропилбензол |
|
15,9722 |
|
3363,60 |
-63,37 |
0,088Р |
|
|
|
|
|
|
|
|
|
|
Решаем задачу в MathCad.
Расчёт прямоточного и противоточного конденсаторов. Прямоточный конденсатор:

Противоточный конденсатор:

В прямоточном конденсаторе газовая фаза и конденсат двигаются в одну сторону. В противоточном – в противоположные.
Прямоточный конденсатор обеспечивает в конденсате максимальное количество летучих компонентов. В противоточном образуется газовая фаза, содержащая максимальное количество легко летучих компонентов.
Расчёт прямоточного конденсатора.
Материальный баланс процесса:
F = W + V.
Для каждого i-го компонента можно записать:
Заменим yi на выражение
