
Платиновые металлы
.pdf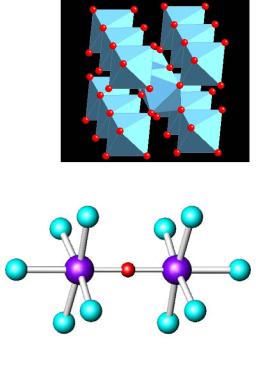
Соединения Ru, Os (IV)
1. Галогениды: известны RuF4, RuCl4, OsF4, OsCl4, OsBr4
Ru + 2Cl |
2 |
+ 2KCl = K [RuCl |
] |
t |
2g |
4e 0, μ = 2.8 мБ |
|
|
2 |
6 |
|
|
g |
||
OsCl4 + 2KCl = K2[OsCl6] K2[OsCl6] + en = [OsCl4(en)] + 2KCl RuO4 + 14HCl + 4KCl = K4[Ru2OCl10] + 7H2O + 4Cl2
|
|
|
|
|
|
темно-красный |
|
|
||
2. Оксиды RuO2, OsO2 |
|
структура рутила |
|
|||||||
RuO |
|
: темно-синий, т.разл. = 1200 оС |
|
|
||||||
2 |
: светло-коричневый, т.разл. = 600 |
оС |
|
|||||||
OsO |
|
RuO2 |
||||||||
2 |
|
|
|
|
|
|
|
|
||
Ru + O |
2 |
= RuO (400 oC) |
|
|
||||||
|
|
|
|
|
2 |
|
|
|
|
|
OsO + H |
2 |
= OsO + 2H |
2 |
O (25 oC) |
|
|
||||
4 |
|
|
|
|
2 |
|
|
|
||
3. Кислородные соединения |
|
[Ru2OCl10]4– |
||||||||
RuO + SrCO |
3 |
= SrRuO |
3 |
(700 oC) |
|
|||||
2 |
|
|
|
|
|
|
|
|
||
2K4[Ru2OCl10] + 6H2SO4 + 16H2O = [Ru4O6(H2O)12](SO4)2 + 4K2SO4 + 20HCl

Низшие с.о. Ru, Os
1. |
Галогениды: известны MX3 (кроме OsF3), MX2 (кроме MF2) |
|
|
2Ru + Cl2 = 2RuCl3 2RuO4 + 16HI (aq) = 2RuI3 |
+ 5I2 + 8H2O |
|
2RuO4 + 16HCl (конц) + 6KCl = 2K3[RuCl6] + 5Cl2 |
+ 8H2O |
2. |
Комплексы Ru, Os (III) все – октаэдры, низкоспиновые |
|
RuCl3·3H2O + 2NaCl = Na2[RuCl5(H2O)] + 2H2O красный RuCl3·3H2O + 3H2C2O4 = H3[Ru(C2O4)3]+3HCl+3H2O темно-зеленый
2K2[OsO2(OH)4] + 16HCl (конц) + 2KCl |
= 2K3[OsCl6] + 12H2O + 3Cl2 |
|||||||
[Ru(H O) ]3+ |
+ e– = [Ru(H |
O) |
|
]2+ |
E0 = |
+0.23 В |
||
2 |
6 |
2 |
|
6 |
|
|
|
|
[Ru(NH ) ]3+ |
+ e– = [Ru(NH |
) |
]2+ |
E0 = |
+0.24 В |
|||
|
3 6 |
|
3 |
6 |
|
|
|
|
3. Комплексы Ru(II) |
|
|
|
|
|
|
||
[Ru(NH3)5(H2O)]Cl2 + N2 |
|
P |
[Ru(NH3)5(N2)]Cl2 + H2O |
|||||
|
|
|
|
|||||

Высшие с.о. Rh, Ir
1. Соединения Rh, Ir (VI,V) |
|
||
|
Известны RhF6, IrF6, RhF5, IrF5 |
IrF |
|
RhF6 |
= RhF5 + ½F2 |
120 oC |
5 |
|
|||
5IrF6 |
+ Ir = 6IrF5 |
350 oC |
|
2IrF6 |
+ H2O = 2IrO2·2H2O + O2 + 12HF |
сильные |
|
RhF6 + 3Cl2 = 2RhF6 + 6ClF |
окислители |
||
|
|||
2. Соединения Rh, Ir (IV) |
|
||
|
Известны RhF4, IrF4, IrO2 (единственный оксид Ir) |
||
IrO2 + 4HCl + 2KCl = K2[IrCl6] + 2H2O |
темно-красный |
||
(NH4)2[IrCl6] + 2H2 = Ir + 2NH3 + 6HCl |
|
||
K2[IrCl6] + 2KI = K3[IrCl6] + ½I2
IrF4
Rh(IV) – очень сильный окислитель
Соединения Rh, Ir (III)
1.Наиболее устойчивая с.о. для Rh, Ir Известны все МХ3 и Rh2O3
2.Комплексы Rh(III)
[Rh(NH3)6]Cl3 |
[RhIVF6]2– |
|
|
|
|
|
|
NH |
|
|
) |
|
|
|
|
3 |
3 |
|
(aq |
(100 |
BF |
NH |
3 |
o |
|
||
|
|
||
C |
|
|
|
) |
|
|
|
[RhCl(NH3)5]Cl2
[RhH(NH3)5]2+ |
Zn |
|
NH3 |
||
|
||
Rh2O3·nH2O |
||
|
HC |
|
|
l |
|
|
O |
|
|
H |
|
|
– |
|
OH–
RhCl3·3H2O  Rh2O3·nH2O
Rh2O3·nH2O
H+
OH–
[RhCl6]3–
|
[Rh(H O) ]3+ |
|||
|
l |
|
2 |
6 |
|
|
|
|
|
C |
|
|
|
|
H |
|
|
o |
|
|
|
t |
|
|
|
, |
|
|
|
|
O |
|
|
|
H2 |
|
|
|
|
Соединения Rh, Ir (III)
3. Комплексы Ir(III)
[Ir(NH3)6]Cl3
NH
3 (150 o C)
[IrIVCl6]2– |
|
|
|
|
3 |
|
[IrCl(NH3)5]Cl2 |
HCl |
|
oC) |
|
HNO |
|
00 |
|
|
|
1 |
|
|
|
( |
|
|
NH |
3 |
|
|
|
|
|
|
|
|
|
|
KCl |
|
|
|
|
|
|
CH3CN |
[Ir(CH3CN)3Cl3] |
||
K3[IrCl6] |
|
|
IrCl ·3H |
2 |
O |
||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
H O, to |
|
|
|
|
|
|
|
|
|
|
[IrCl |
]3– |
2 |
|
|
[Ir(H O) |
]3+ |
OH– |
IrO ·nH |
O |
||||||
|
|
|
|||||||||||||
6 |
|
HCl (изб) |
2 |
|
6 |
|
O2 |
2 |
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
4. Все комплексы октаэдрические, низкоспиновые |
|||||||||||||||
E |
|
|
|
|
eg |
О ЭСКП = 12/5 O |
Rh3+, Ir3+ (d6) |
||||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||
t2g
Низшие с.о. Rh, Ir
1. Получение |
CH3COOH |
|
|
|
|
|
|
|
|
||||
RhCl |
·3H |
2 |
O |
[Rh |
(CH |
COO) ]·2H |
2 |
O |
Rh 4+ |
||||
3 |
|
|
CH OH, to |
2 |
3 |
|
|
4 |
|
2 |
|||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
RhCl |
·3H |
2 |
O |
|
PPh3 |
[RhCl(PPh |
) |
] Rh1+ |
|
|
|
||
C H OH, to |
|
|
|
||||||||||
3 |
|
|
|
|
3 |
2 |
|
|
|
|
|||
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
K |
3 |
[IrCl |
6 |
] |
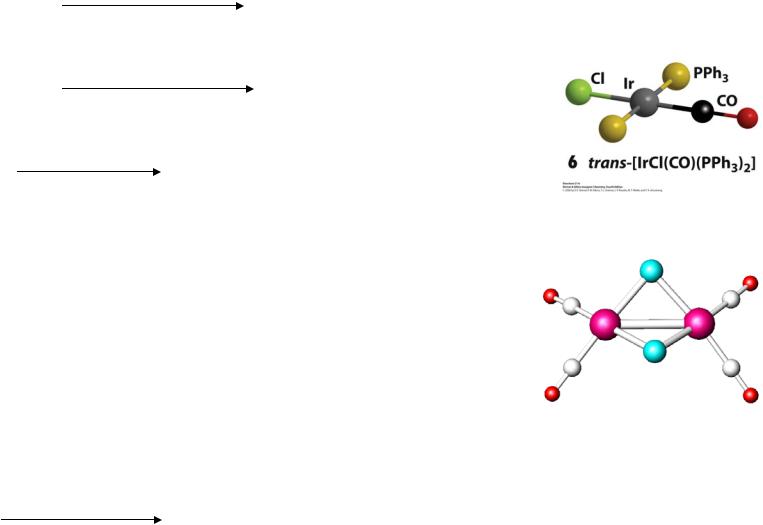
CO, PPh3 |
[IrCl(CO)(PPh ) ] |
Ir1+ |
|
|
|
to, p |
3 2 |
|
2.Все комплексы Rh(II) имеют остов Rh24+
3.Все комплексы Rh(I), Ir(I) квадратные, d8
легко окисляются d8 → d6
[IrCl(CO)(PPh3)2] + I2 = [IrCl(I)2(CO)(PPh3)2] 4. Карбонилы
2RhCl3·3H2O + 6CO = Rh2(CO)4Cl2 + 2COCl2 K3[IrCl6] CO, CH3OH Ir4(CO)12
Rh2(CO)4Cl2
+ 6H2O
Соединения Pd, Pt (IV)
1. Основные с.о. Pd, Pt +2, +4.
Известен PtF6 - фторокислитель
PtF |
+ O |
= O [PtF ] |
Pt5+ |
|
6 |
2 |
2 |
6 |
|
2. Оксиды PdO2, PtO2
PtCl4 + 4KOH + (n–2)H2O = PtO2·nH2O + 4KCl
оранжевый (n=2)
K2[PtCl6] + 2Na2CO3 = PtO2 + 4NaCl + 2KCl + 2CO2
коричневый
PtO2·2H2O + 2NaOH = Na2[Pt(OH)6] PtO2·2H2O + 6HCl (конц) = H2[PtCl6] + 4H2O
Соединения Pd, Pt (IV)
2. Галогениды
Известны PdF4, PtX4
PtI4
Pt + 2Cl |
2 |
= PtCl (300 oC) красно-коричневый |
|
4 |
PtCl4 + 5H2O = [PtCl4(H2O)2]·3H2O
[PtCl4(H2O)2]·3H2O + 2HCl = H2[PtCl6] + 5H2O (NH4)2[PtCl6] + 6NH3 (ж) = [Pt(NH3)6]Cl4 + 2NH4Cl H2[PtCl6] + KCl = K2[PtCl6]↓ + HCl
H2[PtCl6] + 4KI = PtI4↓ + 2HCl + 4KCl
H2[PdCl6] + 2NaI = H2[PdCl4] + I2 + 2NaCl
PtCl4

Соединения Pd, Pt (II)
1. Галогениды. |
|
|
|
|
|
Известны все МХ2, кроме PtF2 |
|||
Pd + Cl2 = PdCl2 |
(500 oC) |
т.пл. = 680 оС |
||
PtCl |
= PtCl + Cl |
2 |
(400 oC) |
т.пл. = 580 оС |
4 |
2 |
|
|
|
Образование комплексов:
PdCl2 + 2HCl = H2[PdCl4]
H2[PtCl6] + SO2 + 2H2O = H2[PtCl4] + H2SO4 + 2HCl
Восстановление:
PdCl2 + CO + H2O = Pd + CO2 + 2HCl
α-PdCl2
Соединения Pd, Pt (II)
2. Оксиды |
|
|
|
||
PdO т.разл. = 900 оС, PtO т.разл. = 350 оС |
|
|
|||
PdCl |
2 |
+ 4NaNO 600 oC PdO + Na O + 2NaCl + 2N |
2 |
+ 5O |
|
|
3 |
2 |
2 |
||
PdCl2 |
+ 2KOH = Pd(OH)2 + 2KCl |
амфотерен |
|
|
|
Pd(OH)2 + 2HClO4 + 2H2O = Pd(ClO4)2·4H2O |
|
|
|||
|
|
[Pd(H O) ]2+ |
|
|
|
|
|
2 |
4 |
|
|
Pd(OH)2 + 2KOH = K2[Pd(OH)4]
квадратные комплексы
H2[PtCl4] + 4KOH = PtO·2H2O + 4KCl + H2O PdO
