
Сборник лабораторных по химии
.pdf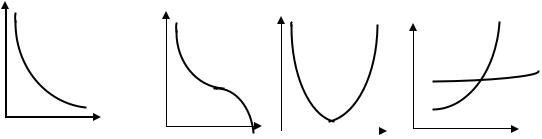
Установлено, что более устойчивы к коррозии металлы с однородной структурой, содержащие маленькое количество примесей, не имеющие внутренних напряжений. И, наоборот, в большей степени подвержены коррозии металлические конструкции, изготовленные из металла, содержащего значительное количество примесей, а также металлические конструкции, работающие под нагрузкой.
v |
|
|
|
|
Ni, Cd, Co |
|
|
|
|
|
|
|
|
|
|
|
Mn, Mg, Fe |
|
|
|
|
Al, Zn, Sn |
Ta, Mo, W |
|
|||||
|
|
|
|
|
|
|
|
Pb, Be |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Au, Pt, Ag |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
0 |
7 |
14 |
0 |
7 |
14 |
0 |
7 |
14 |
0 |
7 |
14 |
рН |
||
Рис. 3. Зависимость скорости коррозии металлов от рН среды
Увеличивает скорость электрохимической коррозии присутствие в электролитах веществ, повышающих их электропроводность, а также присутствие соединений, которые препятствуют образованию на поверхности металла защитной пленки из продуктов реакции коррозии. Защитную пленку на поверхности металла способны разрушать вещества, содержащие ионы хлора (NaCl, KCl и т. д.). Активирующее действие ионов хлора на коррозию металлов объясняется тем, что ионы хлора, адсорбируясь на поверхности металла, препятствуют образованию сплошной защитной пленки оксида или гидроксида металла. По этой причине многие металлы быстро разрушаются в морской воде.
Важнейшие особенности электрохимической коррозии следующие:
1.протекают одновременно и в значительной степени независимо друг от друга два электродных процесса;
2.процессы окисления и восстановления протекают на различных участках поверхности металла, где их протекание облегчено, т. е. энергетически выгодно;
3.материальный эффект коррозии (растворение металла) проявляется преимущественно на анодных участках металла;
4.скорость коррозии может быть выражена плотностью
коррозионного тока:
i = I / S (a/м2 ; а/дм2),
где I – коррозионный ток; S – площадь поверхности анода.
11

Пример 2. Корпус стального изделия ржавеет на воздухе. Изменится ли скорость коррозии, если: а) на корпус попала капля ртути; б) в воздухе повысилось содержание СО2?
Электрохимическая коррозия стали (или железа) протекает по электрохимическому механизму. Роль катодных участков могут играть включения углерода или карбида железа (Fe3C), так как φ˚(Fe3C) > φ˚(Fe).
Схема коррозионного гальванического элемента будет записываться следующим образом:
(-) Fe | O2, H2O | Fe3C (+)
Электродные процессы: |
|
Анод: Fe – 2 ē → Fe2+ |
2 |
Катод: 2 H2O + O2 + 4 ē → 4 OH¯ |
1 |
2 Fe + 2 H2O + O2 = 2 Fe(OH)2↓ |
|
Образование ржавчины происходит в результате дальнейшего окисления гидроксида железа(II):
4 Fe(OH)2 + O2 + 2 H2O = 4 Fe(OH)3 → 4 FeОOH + 4 H2O
ржавчина
Поверхность металла под рыхлым слоем ржавчины продолжает корродировать. Появляются новые анодные участки на поверхности металла за счет образовавшегося гидроксида и за счет того, что поверхность металла неравномерно снабжается кислородом.
а) При попадании ртути на поверхность корпуса стального изделия образуются новые коррозионные гальванические элементы (контактная коррозия), схема которых может быть записана таким образом:
(-) Fe | O2, H2O | Hg (+)
ЭДС такого коррозионного гальванического элемента будет достаточно большой, так металлы сильно отличаются по величине электродного потенциала:
φ˚(Hg2+/Hg) = +0,79 B; φ˚(Fe2+/Fe) = –0,44 B. |
|
Электродные процессы: |
|
Анод: Fe – 2 ē → Fe2+ |
2 |
Катод: 2 H2O + O2 + 4 ē → 4 OH |
1 |
2 Fe + 2 H2O + O2 = 2 Fe(OH)2↓ |
|
4 Fe(OH)2 + O2 + 2 H2O = 4 Fe(OH)3 → 4 FeООН + 4 H2O
ржавчина
Скорость коррозии стального корпуса при попадании на него капель ртути увеличится, так как возрастает разность потенциалов между анодными и катодными участками. Хотя механизм протекания коррозии останется прежним.
12
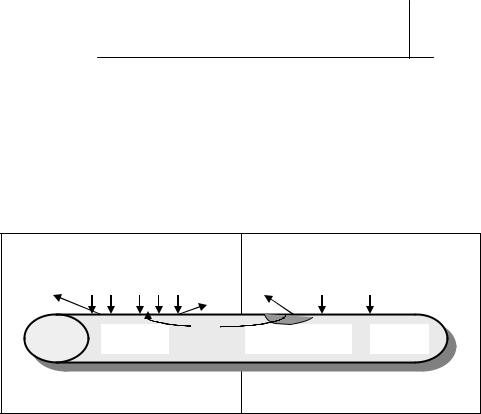
б) На поверхности стального корпуса адсорбируется влага, и повышенное со- |
||||||
держание СО2 в воздухе приводит к повышению содержания диоксида углерода в |
||||||
электролите, который за счет этого подкисляется: |
|
|
|
|||
Н2О + СО2 ↔ Н+ + НСО3¯ |
|
|
||||
Продукты коррозии стали (железа) имеют основной характер, следовательно, |
||||||
они будут растворяться в кислоте, что приведет к усилению процесса коррозии. |
||||||
Схему коррозионного гальванического элемента и электродные реакции можно |
||||||
записать следующим образом: |
|
Fe | O2, H+ | Fe3C (+) |
|
|
||
(-) |
|
|
||||
Электродные процессы: |
|
|
|
|
|
|
Анод: Fe – |
2 ē → Fe2+ |
|
|
2 |
||
Катод: O2 + 4H+ + 4 ē → 2 Н2О |
1 |
|||||
2 Fe + O2 + 4Н+ = 2 Fe2+ + 2 H2O |
||||||
Пример 3. Подземный трубопровод переходит из глинистых почв в |
||||||
песчаные почвы (рис. 4). Где быстрее будет разрушаться стальная труба? |
||||||
В почве присутствует кислород и вода, в которой могут находиться |
||||||
растворимые вещества из почвы. |
|
|
|
|
|
|
Н2O |
|
|
Fe2+ |
О2 Н2О |
|
|
О2 О2 |
О2 |
|
||||
ОН- |
|
ОН- |
|
|
|
|
Катод |
|
ē |
.Fe - 2 ē = Fe2+ |
Анод |
||
песок |
|
|
|
глина |
||
|
|
|
|
|
||
песок |
|
|
глина |
|
|
|
Рис. 4. Схема коррозии железа в почве с разным доступом кислорода |
||||||
Доступ кислорода к трубе в песчаной и глинистой почвах различен (неравномерная аэрация). По этой причине на участке трубы, где глинистая почва переходит в песчаную, будут возникать анодные и катодные участки. Разрушение металла будет происходить на анодном участке, там, где концентрация окислителя меньше, т. е. в глинистой почве. Катодными будут участки, с большим доступом кислорода – те, что находятся в песке
Для данного случая коррозионный гальванический элемент можно представить в таком виде:
(-) Fe | O2, H2O | Fe (+)
Электродные процессы:
13

Анод: Fe – 2 ē → Fe2+ |
2 |
|
Катод: 2 H2O + O2 |
+ 4 ē → 4 OH¯ |
1 |
2 Fe + 2 H2O + O2 |
= 2 Fe(OH)2 |
|
4 Fe(OH)2 + O2 + 2 H2O = 4 Fe(OH)3 → 4 FeООН + 4 H2O
ржавчина
1.3. Пассиваторы и активаторы коррозии металлов
Состояние металла с повышенной химической устойчивостью поверхности металла называется пассивным. Оно связано с образованием защитной пленки на поверхности металла (чаще оксидной или солевой) или с торможением анодного процесса коррозии.
Большая сопротивляемость коррозии алюминия, довольно активного металла, обусловлена наличием плотной, тонкой и эластичной оксидной пленки на поверхности металла типа А12О3 (А1ООН). Устойчивость свинца в разбавленных серной и соляной кислотах объясняется образованием на поверхности свинца нерастворимых солевых пленок: PbSO4 и PbCl2.
Вещества, пассивирующие поверхность металла, т. е. способствующие возникновению на металле защитной пленки, называются
пассиваторами.
Пассивное состояние металла могут вызывать окислители. Холодная концентрированная азотная кислота пассивирует алюминий, железо, хром и некоторые другие металлы, вызывая образование защитной оксидной пленки на поверхности металла. В качестве пассиваторов металлов часто используют натриевые соли хромовой кислоты (Na2CrO4) и азотистой кислоты (NaNO2).
Если на поверхности металла образуется рыхлая пленка продукта коррозии, которая легко отщепляется от металла, то она не защищает металл, а напротив, значительно усиливает коррозию. Такого типа пленка образуется на поверхности железа при окислении его во влажном воздухе.
Состояние металла с повышенной реакционной способностью поверхности металла называется активным. Оно обусловлено разруше-
нием защитных пленок или усилением анодного процесса коррозии.
14
Вещества, усиливающие коррозию металлов, называются
активаторами коррозии.
Активаторы обычно способствуют разрушению или разрыхлению защитной пленки, усиливая тем самым коррозию металлов. Ионы хлора (С1 ), присутствующие в растворе, адсорбируются на поверхности металла и разрушают защитную пленку. Этим объясняется быстрое разрушение большинства металлов в морской воде.
Активаторами коррозии алюминия являются соли ртути и металлическая ртуть. Если смочить очищенную пластинку алюминия ртутью, то образуется ртутная амальгама – сплав алюминия с ртутью. От амальгамированной поверхности алюминия отслаивается пленка оксида А12О3 (А1ООН) и она перестает выполнять свои защитные свойства. Поэтому оставленная на воздухе пластинка быстро покрывается рыхлыми хлопьями А1(ОН)3 (продуктом коррозии алюминия). Кроме того, коррозия усиливается и за счет контакта алюминия с ртутью (малоактивным металлом), так как при этом образуется коррозионный гальванический элемент:
А1| О2, Н2О| Нg .
1.4.Методы защиты металлов от коррозии
Впрактике широко используются следующие методы защиты металлов от коррозии:
1.Изоляция металлов от агрессивной среды путем нанесения защитных покрытий. Для этой цели применяют различные виды покрытий:
а) органические покрытия (краски, лаки, эмали, смазочные масла, полимерные покрытия и т. д.);
б) неорганические покрытия (оксидные или солевые пленки).
в) металлические покрытия
Для создания неорганических покрытий часто используют метод пассивирования металлов, с помощью которого на поверхности металла разными способами создается прочная оксидная (реже солевая) пленка.
Для создания металлических покрытий используются металлы ус-
тойчивые в агрессивных средах – цинк, хром, никель, серебро, золото и т. д. Металлические покрытия делятся на два вида: анодные и катодные.
15
Если для металлического покрытия используется более активный металл, то покрытие считается анодным, менее активный металл –
катодным.
2. Электрохимическая защита Этот вид защиты осуществляется в виде протекторной или элек-
трической защиты.
а) При протекторной защите к защищаемой металлической конструкции присоединяют более активный металл – протектор. В образующейся гальванической паре протектор в силу большей активности будет являться анодом и, следовательно, будет разрушаться, защищая металлическую конструкцию.
б) При электрической защите защищаемая металлическая конструкция присоединяется к отрицательному электроду источника постоянного тока, а к положительному электроду присоединяется вспомогательный электрод (ненужный кусок железа), который разрушается и, тем самым, предохраняет металлическую конструкцию от разрушения.
3. Применение ингибиторов
Ингибиторы – вещества, замедляющие скорость реакции коррозии.
В качестве ингибиторов могут выступать различные органические соли и кислоты, амины, неорганические соли, такие как хроматы, фосфаты, нитраты и т. д.
Ингибиторы действуют разными способами на процесс коррозии: а) Адсорбируясь на поверхности металла, сильно влияют на элек-
тродные процессы микрогальванопар. Ингибиторы, как правило, тормозят анодный или катодный процесс;
б) Вследствие своего окисляющего действия образуют на поверхности металла плотную оксидную пленку, хорошо защищающую металл.
Универсальных ингибиторов не существует. В каждом конкретном случае используют специально подобранные в результате эксперимента вещества. Довольно эффективными ингибиторами являются нитраты или хроматы натрия. Из органических соединений в качестве ингибитора используется уротропин.
16
4. Изменение коррозионной среды Для уменьшения агрессивности коррозионной среды проводят ее
обработку. В систему вводятся вещества, способные уменьшить концен-
трацию вредных компонентов (кислорода – О2, ионов хлора – С1-, ионов водо-
рода – Н+ и т. д.). Концентрацию кислорода можно понизить, вводя в систему сульфит натрия (Na2SO3) или гидразин (N2H4). Поглощение кислорода происходит в результате следующих реакций:
2 Na2SO3 + O2 = 2 Na2SO4
N2H4 + O2 = N2 + 2 H2O
Концентрацию кислорода в растворе можно уменьшить кипячением или барботированием раствора инертным газом. Концентрацию ионов водорода уменьшают и путем нейтрализации их щелочью:
Н+ + ОН¯ = Н2О
Следует отметить, что данный метод применяется в ограниченных по объему системах.
5. Легирование металлов Этот метод заключается в создании сплавов с заданными свойствами
(сплавов медленно подвергающихся коррозии). В металл вводятся различные добавки – хром, марганец, вольфрам и другие металлы. При этом повышается однородность структуры и резко снижается возможность образования коррозионных гальванических пар. Легированные стали широко применяются для изготовления деталей, работающих в особо агрессивных средах. В частности они используются в производстве аппаратуры, трубопроводов и емкостей для химической промышленности.
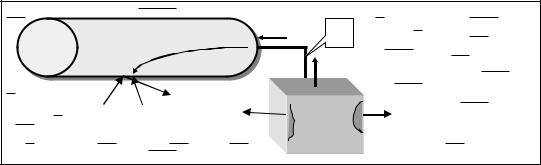
Пример 4. Стальная конструкция находится в речной воде (рис. 5). Какой металл целесообразнее выбрать в качестве протектора Al, Mg, K или Pb?
Все технические металлы неоднородны, т. е. на поверхности металла имеются анодные и катодные участки. Назначение протектора заключается в том, чтобы все анодные участки на поверхности металла превратить в катодные участки. Таким образом, вся стальная конструкция станет катодом, а анод (протектор) будет разрушаться. Эффективность протекторной защиты будет обуславливаться:
а) максимальной разностью потенциалов металлической конструкции и протектора;
17
б) электропроводностью среды (образующийся гальванический элемент не будет «работать» в дистиллированной воде);
в) экономичностью процесса.
Расположим рассматриваемые металлы по величине их стандартного электродного потенциала:
|
K |
Mg |
Al |
Fe |
Pb |
φ˚ (в) |
–2,92 |
–2,37 |
–1,66 |
–0,44 |
–0,13 |
Свинец не может быть протектором, т.к. он характеризуется более высоким потенциалом, чем железо.
Максимальное значение будет иметь гальванический элемент «К – Fe». Но так как калий чрезвычайно химически активен. Он легко взаимодействует с водой:
2 К + 2 Н2О = 2 КОН + Н2,
поэтому не может использоваться в качестве протектора для защиты стальной конструкции в воде.
Fe - катод |
2 |
|
ē |
3 |
|
|
|
|
ē |
|
|
ē |
|
|
|
|
ОН¯ |
2+ |
Mg - 2ē |
|
2+ |
||
О2 + 2Н2О |
Mg |
Mg |
|||||
|
|
Анод |
4 |
||||
|
|
|
|
|
|||
4 |
|
|
|
1 |
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
||
Рис. 5. Схема протекторной защиты стального трубопровода магнием в речной воде:
1 – протектор; 2 – трубопровод; 3 – соединительный провод; 4 – вода.
Алюминий и магний имеют более низкие значения электродных потенциалов по сравнению с железом, значит, оба могут использоваться в качестве протектора.
В данном случае предпочтение следует отдать магнию, так как:
а) алюминий быстро пассивируется, а это будет тормозить его анодное растворение при «работе» в качестве протектора;
б) гальванопара «А1 – Fe» имеет меньшую разность потенциалов по сравнению с гальванопарой «Mg – Fe».
Схема коррозионного гальванического элемента и электродные процессы записываются следующим образом:
(-) Mg | O2, H2O | Fe (+) |
|
|
A: Mg – 2ē = Mg2+ |
|
2 |
|
||
K: O2 + 2 H2O + 4 ē = 4 OH¯ |
|
1 |
2 Mg + O2 + 2 H2O = 2 Mg(OH)2 |
||
18

Пример 5. От длительной эксплуатации изделий позолота на медном контакте поцарапалась, а покрытие на луженой меди (покрытой оловом) отслоилось. В каком случае быстрее разрушится медь, находящаяся на воздухе?
О2, Н2О |
ОН¯ |
Sn2+ |
ОН¯ О2 , Н2О |
|
|
|
Cu2+ |
|
|
|
|
|
|
|
|
|
|
Sn - 2 ē |
|
Au – катод |
|
|
|
|
|
|
Sn– анод |
|
|
Cu – анод |
|
|
|
|
|
Cu - 2 ē |
Cu - катод |
|
|
|
а) |
б) |
|
|
Рис. 6. Схема атмосферной коррозии меди, покрытой: а) золотом; б) оловом
Электрохимическая природа покрытий на меди имеет разный характер (рис.6). Золото для меди является катодным покрытием, так как φ˚(Au3+/Au) > φ˚(Cu2+/Cu). При нарушении цельности покрытия в контакте с токопроводящей средой образуется коррозионный гальванический элемент, в котором медь будет играть роль анода, а золото – катода. Схема коррозионного гальванического элемента и электродные процессы в первом случае будут записываться таким образом:
(-) Cu | O2, H2O | Au |
|
|
|
|
|
|
|
A: Cu – 2ē = Cu2+ |
|
2 |
|
K: O2 + 2 H2O + 4 ē = 4 OH- |
|
1 |
|
|
|
||
2 Cu + O2 + 2 H2O = 2 Cu(OH)2
На воздухе медь покрывается зеленым налетом (CuOH)2СО3 в результате взаимодействия с диоксидом углерода:
2 Cu(OH)2 + СО2 = (CuOH)2СО3 + H2O или 2 Cu + O2 + H2O + СО2 = (CuOH)2СО3
Покрытие олова на меди является анодным покрытием, так как φ˚(Sn2+/Sn) < φ˚(Cu2+/Cu). При нарушении покрытия в присутствии кислорода и воды образуется коррозионный гальванический элемент, в котором олово является анодом, а медь – катодом и не разрушается.
Схема коррозионного гальванического элемента и электродные процессы во втором случае будут записываться таким образом:
19
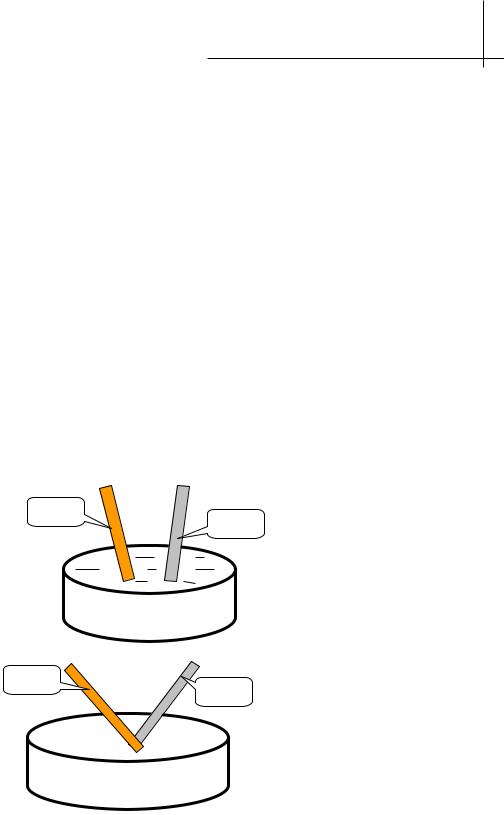
(-) Sn | O2, H2O | Сu (+) |
|
A: Sn – 2ē = Sn 2+ |
2 |
K: O2 + 2 H2O + 4 ē = 4 OH¯ |
1 |
2 Sn + O2 + 2 H2O = 2 Sn (OH)2
1.5.Техника безопасности
1.Перед началом работы познакомьтесь с методикой выполнения каждого опыта.
2.При работе с кислотами и щелочами соблюдайте осторожность, не допускайте их попадания на кожу и одежду. Отработанные реактивы сливайте в раковину только после разбавления водой.
3.В лаборатории соблюдайте тишину и порядок. После окончания работы вымойте посуду и приведите в порядок рабочее место.
4.Обо всех происшествиях немедленно доложите преподавателю или лаборанту.
1.6.Экспериментальная часть
Опыт 1. Коррозия, возникающая при контакте двух разных металлов
В фарфоровую чашку налейте 0,01 н. раствор серной кислоты.
|
|
|
|
|
|
|
|
|
а) В чашку погрузите полоску |
Медь |
цинка и очищенную медную пла- |
||||||||
|
|
|
|
|
|
|
|
Цинк |
стинку, но так, чтобы они не со- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
прикасались друг с другом. На- |
|
|
|
|
|
|
|
|
|
блюдается ли выделение водорода |
|
|
|
|
Н2SO4 |
(пузырьки газа) на цинке, на меди? |
||||
|
|
|
|
|
|
|
|
|
Почему пузырьки газа появляются |
Медь |
только на одном металле? Каком? |
||||||||
|
|
|
|
|
|
|
|
Цинк |
Запишите уравнение протекающей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакции. |
|
|
|
|
|
|
|
|
|
б) Прикоснитесь в растворе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты одной пластинкой к дру- |
||||
|
|
|
Н2SO4 |
|
|
|
|
||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
гой. Объясните, почему в этом слу- |
|
|
|
|
|
|
|
|
|
|
Рис. 7. Схема опыта коррозии |
чае на медной пластинке появля- |
||||||||
цинка в контакте с медью |
ются пузырьки водорода? Измени- |
||||||||
в растворе серной кислоты |
лась ли скорость выделения водо- |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рода? Почему? |
20
