
Лекции / Лекции (Павлова) / L9
.docЛекция №9.
В т/д и термохимии различно записываются теплоты химических реакций две системы знаков. Различают экзотермические и эндотермические химические процессы.
В т/д реакции, сопровождающие выделением тепла, - экзотермические, теплота считается отрицательной. Реакции с поглощением тепла – эндотермические, теплота считается положительной.
υ – стехиометрический коэффициент.
В термохимии знаки противоположные т/д, т.е. выделенная системой теплота – положительная, а поглощенная – отрицательная. Мы будем пользоваться т/д знаками.
Термохимическое уравнение.
Стехиометрические уравнения химических реакций, дополненные сведениями о состоянии образующихся и реагирующих веществ, а также указанных их тепловых эффектов. Запишем в общем виде термохимические уравнения:
υ1А1 + υ2А2 + … = υ’1A’1 + υ’2A’2 + Qp (кДж) – термохимической системе знаков.
υ1А1 + υ2А2 + … = υ’1A’1 + υ’2A’2 – т/д система знаков - тепловой эффект записывается отдельно от уравнения. ∆Н – т/д система знаков.
υ1А1(ТВ) + υ2А2(Ж) + υ3А3(ГАЗ) + … = (термохимич.)
υ’1A’1(Г) + υ’2A’2(ТВ) + υ’3A’3(Т) + … (указываются агрегатные состояния) Могут указываться также и другие условия, при которых протекает реакция (давление). Для характеристики тепловых процессов используется изменение энтальпии (изменение внутренней энергии реже).
Qp = -∆H
Следствие из законов Гесса.
Практическое значение уравнения закона Гесса.
Состоит в том, что с помощью закона Гесса можно вычислить неизвестную теплоту реакции, для этого комбинируют стехиометрические уравнения и теплоты реакций, которые изучены термохимически.
Рассмотрим пример сжигания углерода с образованием CO, изучить экспериментально нельзя, т.к. в чистом виде эта реакция не осуществляется. С помощью закона теплоты неполного сгорания углерода можно рассчитать, зная теплоту окисления окиси углерода. Запишем термохимические уравнения этих реакций и приведем соответствующие теплоты:
Стандартное состояние углерода – графит.
1. C(графит) + O2 = CO2 ∆rH298,15 = -2405 кал
2. CO + ½O2 = CO2 ∆rH298,15 = -67640 кал
Поставим вопрос: необходимо найти стандартные теплоты реакций окисления углерода:
3. С(ГР) + ½O2 = CO – недоокисление ∆rH298,15 (3) = ?
4. С(ГР) + CO2 = 2CO – восстановление ∆rH298,15 (4) = ?
Составим схему, на основании которой можно оценить тепловые эффекты (3,4)
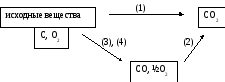
Согласно закону Гессе, если скомбинировать (1) и (2), то получим (3), т.е.
(1) – (2) = (3).
∆rH298,15 (3) = ∆rH298,15 (1) - ∆rH298,15 (2) = - 26412 кал.
Чтобы найти ∆rH298,15 (4) надо 2 * тепловой коэффициент 2, т.е.
∆rH298,15 (4) = ∆rH298,15 (1) – 2*∆rH298,15 (2) = 41272 кал
Вывод: закон Гессе позволяет обращаться с термохимическими уравнениями как с алгебраическими, т.е. почленно умножать на постоянный множитель, складывать, вычитать, если соблюдать условие (3) Л-8, т.е. одинаковое значение температур для исходных и конечных продуктов реакции.
Теплота образования химических соединений.
υ1А1 + υ2А2 + υ3А3 + … = υ’1A’1 + υ’2A’2 + υ’3A’3 + …
Введем обозначения: внутренней энергии исходных веществ Ui ,
энтальпии исходных веществ Hi , для продуктов реакции эти обозначения с индексом j, т.е. Uj, Hj.
Запишем формулу для теплового эффекта в общем виде:
![]()
![]() При
V=const Qr
= ∆U = Uпродуктов
– Uисходных веществ =
При
V=const Qr
= ∆U = Uпродуктов
– Uисходных веществ =
![]() -
-
![]()
при p=const
= ∆H = Hпрод.
– Hмх =
![]() -
-
![]()
Абсолютное значение Ui,j и Hi,j нам неизвестные, но это не имеет значения, т.к. их можно отсчитывать от любого уровня одинакового для исходных веществ и продуктов реакции. Тогда величины U и H, характеризующие начало отсчета, будут исключены из окончательного результата, т.к. в левой и в правой частях уравнения находится одинаковое число атомных элементов, из которых состоит реагирующее вещество.
Стандартное состояние элемента.
Выбирается (в термохимии) состояние простого вещества устойчивого при T=25C и P=1атм. Для N, O, H, серы, C стандартными состояниями являются газы N2, O2, H2 (т.е. двухатомные газы), Sромбическая, Cграфит (t=25C, p=1атм.). Исключение фосфор – для него стандартное состояние – белый фосфор, а не красный; белый менее устойчив, чем красный.
При расчетах тепловых эффектов используют теплоты образования веществ – тепловые эффекты реакции образования 1 моля вещества из соответствующих количеств простых веществ при указанных условиях, теплоты образования могут быть как положительными, так и отрицательными. Теплоты образования простых веществ условно принято равнять нулю.
Пример 2:
Покажем, что тепловой эффект химической реакции можно рассчитывать из теплот образования исходных веществ и продуктов (воспользуемся законом Гесса).
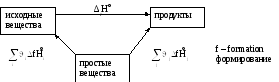

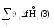
∆rH = -
Д оказательство:
оказательство:
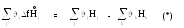
Индекс «к» относится к элементам или к простым веществам, из которых образованы вещества, участвующие в реакции. Если рассматривать разницу (*) и (**), то к взаимно уничтожатся уравнение (3) верно.
Станлартные теплоты образования некоторых веществ.
(t=25C, p=1атм.)
вещество ∆fH298,15 ккал/моль
ОН- -54,98
Сгр 0,000
Салмаз 0,437
Нг 39,098
Н2г 0,000
О2г 0,000
О3г 34,000
Sмоноклин 0,71
Sромбическая 0,000
Sг 65,222
COг -26,416
CO2г -94,052
H2Oг -57,796
H2Oж -68,315
C2H5OHж -66,19 - этиловый спирт
H3O+ 0,000
Cалмаз + O2 = CO2 =
-
∆rH298 ∆fH298 , т.к. здесь в качестве углерода используется не графит (его стандартное состояние), а используется алмаз.
-
∆rH298 = ∆I = Н (CO2, 298,15) – другая запись.
Во многих случаях теплоты образования экспериментально определить нельзя и их рассчитывают по тепловым эффектам других реакций, например, через теплоты сгораний, такие рассчеты популярны в органической химии, т.к. реакции между органическими веществами протекают неоднозначно и идут не до конца, а реакции сгорания протекают полностью.
Пример 3:
Классический пример: образование твердой глюкозы C6H12O6 (тв) из простых веществ.
Запишем термохимическое уравнение для реакции образования глюкозы.
6С(гр) + 6H2(г) + 3O2 (г) C6H12O6
Реакция прямым путем не осуществима и тепловой эффект определяется из тепловых эффектов следующих реакций:
-
6C(гр) + 6O2(г) = 6CO2(г) ∆rH(1) = -544ккал
-
6H2(г) + 3O2(г)= 6H2O(ж) ∆rH(2) = -410ккал
-
C6H12O6(тв) + 6O2(г) = 6CO2 + 6H2O(ж) ∆rH(3) = -670ккал
Комбинации этих 3-х тепловых эффектов, а именно:
∆rH = (1 + 2 - 3) = ∆rH(1) + ∆rH(2) - ∆rH(3) = ∆fH (C6H12O6,тв,298,15) = 34 ккал/моль
Теплота сгорания – тепловой эффект реаккции сгорания кислородом с образованием оксидов входящих в него или соединение этих оксидов.
Тепловой эффект реакций сгорания определяют экспериментально путем сжигания километрических веществ.
Для функции (1, 2, 3) теплоты сгорания найдены с точностью +- (плюс-минус) 0,02%.
Д./з.: оценить ошибку в определении результирующей теплоты образования глюкозы, которую мы рассчитываем.
