
Лекции / Лекции (Павлова) / L7
.docЛекция №7.
H=U+pV энтальпия, так же как и внутренняя энергия – функция состояния.
рV – функция состояния, т.о. энтальпия.
Н – функция состояния, т.е. изменения не зависят от пути проведения процесса.
Вывод: в двух случаях при p=const, V=const, когда все полезные виды работ равны 0, теплота Q (Qp и QV) приобретает свойства функции состояния.
Итоги: первое начало т/д для закрытых систем:
dU=U-A
А – различные виды работ
A=pdV+OA’
А’ – полезные работы, не связанные с изменением объема
A’=dS+dl+…
p, dV, , dS, , dl – параметры, характеризующие систему.
Этот переход возможен при равновесном процессе(если не равновесный, то p, dV – относятся к внешней среде).
Внутренняя энергия: (T, V, p)=0;
T – характеристика кинетической энергии;
V – определяет потенциальную энергию частиц;
![]() U=(T,V).
U=(T,V).
Запишем дифференциал и при протекании процесса:
Э![]() нтальпия:
функция теплоты и давления H=(T,P)
нтальпия:
функция теплоты и давления H=(T,P)
H=U+pV.
При постоянстве давления и отсутствии других видов работ теплота …. изменением энтольпии системы.
При V=const, и отсутствии вообще всех работ, теплота определяется изменением внутренней энергии
U, H – функции состояния системы, экстенсивные, не известны абсолютные значения.
Взаимосвязь между изменениями функций ∆U и ∆H.
∆Н=U-p∆V+V∆p
При p=const ∆H=∆U+p∆V.
При V=const ∆H=∆U+v∆p.
Для химической т/д наиболее интересными процессами являются химические реакции, допустим что в химической реакции температуры исходных и конечных веществ подчиняется уравнению идеального газа:
∆(pV)=∆n1-RT
∆n – изменение числа молей газообразных веществ, участвующих в химической реакции.
∆MT=∆UT-∆nГRT ()
Если в химической реакции участвуют на ряду с газообразными жидкие или твердые вещества, то при условии nГ0, изменение величины ∆(pV) для конденсированных веществ можно пренебречь ∆(pV)0, то имеем опять ().
Если реакция протекает либо в твердом теле либо в жидкости, т.е. в конденсированной среде, слагаемое ∆nГRT=0, а значение изменения внутренней энергии приблизительно равно ∆Н, т.е. ∆Н∆U.
Теплоемкость газа.
В![]()
 общем случае теплоемкость вещества –
функция процесса. Запишем определение
теплоемкости математически:
общем случае теплоемкость вещества –
функция процесса. Запишем определение
теплоемкости математически:

И A=0![]()
X A’=0

![]()
О


– функции
экстенсивные
ба состояния справедливы для любых
веществ в любых агрегатных состояниях
![]() n
– число молей
n
– число молей
Н
()![]()
П
dU=(T,V)
()![]()
И![]() спользуя
уравнение состояния: (T,P,V)=0.
Запишем полный дифференциал объема:
спользуя
уравнение состояния: (T,P,V)=0.
Запишем полный дифференциал объема:
– подставим это
выражение в формулу для dU()![]()
П![]() осле
преобразований получим выражение:
осле
преобразований получим выражение:
У![]() читывая
взаимосвязь a
читывая
взаимосвязь a
З
Подставив это
уравнение в исходное выражение Cp
()![]()
П
()![]()
П![]() рименим
формулу ()
к идеальным газам.
рименим
формулу ()
к идеальным газам.
В
в выражение
()
первое слагаемое отсутствует![]() идеальном газе U=(T).
идеальном газе U=(T).
Уравнение Майера
Сp-СV=R
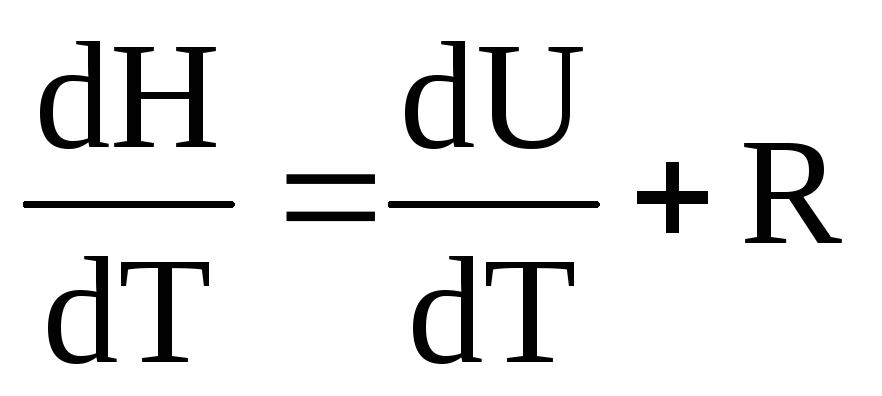 H=U+PV
H=U+PV
Cp-CV=R
Определим теплоемкость одноатомного идеального газа.
Т![]()
![]() .о.
при p=const и V=const теплоемкость идеального
газа не зависит от температуры.
.о.
при p=const и V=const теплоемкость идеального
газа не зависит от температуры.
Cp=a+bT+cT2+dT3+…+T-2
Обеспечивает стыковку теплоемкости в области высоких и низких температур.
4. Адиабатический процесс.
Q=0
-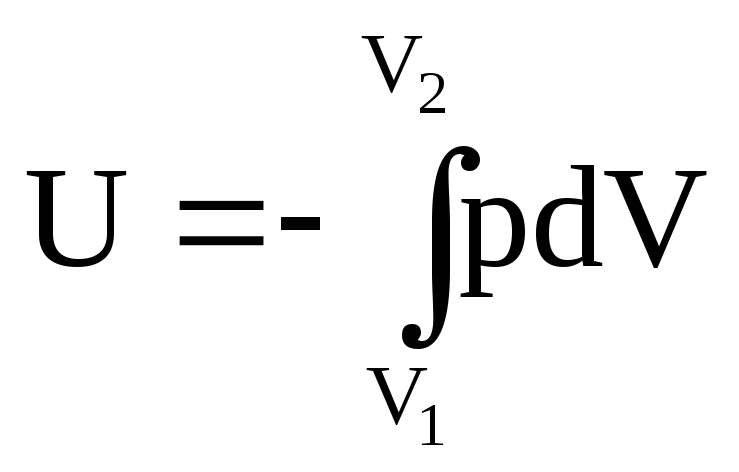 dU=A
или после интегрирования
dU=A
или после интегрирования
В
 таком процессе работа производится
только за счет изменения внутренней
энергии, следовательно температура
системы при адиабатическом процессе
работа и изменение внутренней энергии
равны, но имеют разные знаки. Для
идеального газа: dU=n*CV*dT,
поэтому величина работы будет равна:
таком процессе работа производится
только за счет изменения внутренней
энергии, следовательно температура
системы при адиабатическом процессе
работа и изменение внутренней энергии
равны, но имеют разные знаки. Для
идеального газа: dU=n*CV*dT,
поэтому величина работы будет равна:
П![]() олучим
уравнение адиабаты: для этого используя
уравнение состояния нужно в выражении
работы заменить давление через объем
и проинтегрировать. Удобно при этом
выразить газовою постоянную R через
разность теплоемкостей (СP-СV)
и ввести адиабатный коэффициент ,
который определяется как:
олучим
уравнение адиабаты: для этого используя
уравнение состояния нужно в выражении
работы заменить давление через объем
и проинтегрировать. Удобно при этом
выразить газовою постоянную R через
разность теплоемкостей (СP-СV)
и ввести адиабатный коэффициент ,
который определяется как:
-
проинтегрируем
и получим![]()

 V=const’
V=const’