
Т/д имеет 3-и особенности:
дедуктивный (переход от общего к частному), исходя из общих законов т/д получают выражения, которые применяют к анализу систем.
макроскопическая наука имеет дело с макроскопическими величинами, которые измеряют на опыте.
т/д рассматривает процессы вне времени.
Системы (по типу):
- открытые (1)
- закрытые (2)
- изолированные (3)
обмениваются с окружающей средой и материально и теплом
не имеющая материального обмена с окружающей средой, но может обмениваться теплом
не может обмениваться ни материально, ни теплом
Н
Работа
совершается во время циклического
процесса = фигуре, заключенной между
кривыми прямого и обратного процесса.
При соприкосновении различной степени нагретых тел в течение некоторого времени их температура становится одинаковой (заключение сделано с открытием термометра – принцип термического равновесия – середина 18 века Джозеф Блэк).
Принцип термического равновесия:
(современное определение) если система 1 находится в состоянии равновесия по отдельности с системами 2 и 3, то эти системы так же находятся в состоянии термического равновесия между собой (английский физик Фаулер – 1931).
2
принцип
транзитивности теплового равновесия
3
Нулевой принцип т/д имеет значение эквивалентное другим постулатам т/д.
Законы, описывающие идеальный газ:
Бойля-Мариотта(1669г.)
Ч T=const P1V1=const PV=const P2V2=const![]()
2. Шарля-Гейлюсака.
(закон теплового расширения газа) – объем данной массы идеального газа при p=const линейно возрастает с температурой.
P=const, Vt=V0(1+t)
3. Уравнение Клайперона-Менделеева. Уравнение состояния идеального газа.
Закон парциального давления для смеси идеальных газов сформулировал Дж.Дальтон.
(1)nобщ=nA+nB+nc+… , где ni – составляющее смеси.
Закон Максвелла (распределение молекул по скоростям)
В масса индивидуальной молекулыывод законов Больцмана и Максвелла базируется на теории вероятности

-
формула Максвелла
Основными причинами отклонений свойств реал. газов от идеальных являются:
притяжение молекул;
наличие у них собственного объема.
Наибольшее раскрытие вследствие простоты и физической надменности получило уравнение Ван-дер-Ваальса, ввел две поправки в уравнение состояния идеального газа.
(P+a/ν2)(ν-b)=RT (для 1-ого моля);
(P+n2/ν2)(ν-b)=nRT (для n-моль);
поправка “a” учитывает притяжения молекул
поправка “b” – учитывает собственный объем и взаимное отталкивание на малых расстояниях.
a=27R2T2/64крит b=RTк/8крит
Недостаток: для различных газов a и b различны, поэтому уравнение Ван-дер-Ваальса не является универсальным, хотя многие годы (реал.) поддаются под описание этого уравнения.
Уравнение не работает при высоких давлениях и в критической точке. Значит теория состояний для всех газообразных и жидких веществ уравнение должно быть справедливо: уравнение единого состояния:
Первый закон термодинамики –
Д![]() ля
циклического процесса принцип
эквивалентности записывается в виде:
ля
циклического процесса принцип
эквивалентности записывается в виде:
∆U=Q-A
Свойства ∆U:ее изменение определяется только начальным и конечным состоянием системы.

∆U– функция состояния – не зависит от пути проведения процесса.
Функция состояния.
Функция от параметров состояния, если ее значения зависят только от этих параметров, и не определяется процессами предшествующими этапу состояния. Aи теплота не являются функциями состояния системы, они зависят от пути процесса, определяют следующим образом
dU=Q-A
с и
значит![]()
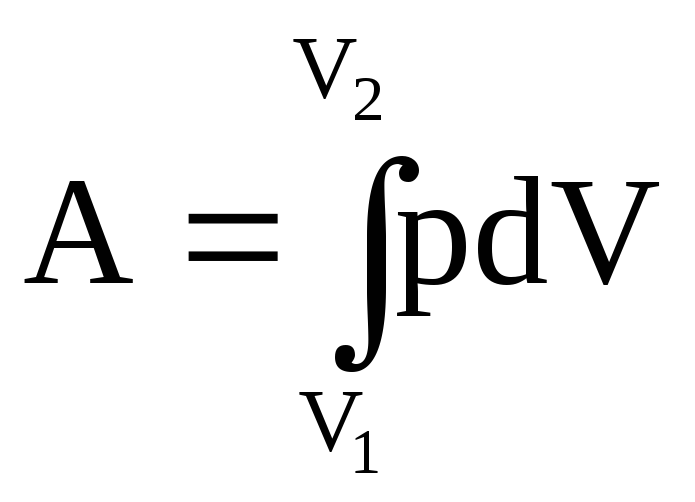
 dU=-pdV
dU=-pdV
Другие виды работы, которые не связаны с изменением объема системы – полезные работы.
Р
Поверхностное
натяжение абота
по поднятию силы тяжести:A=pdh=mgdh
абота
по поднятию силы тяжести:A=pdh=mgdh
Р абота
по переносу заряда между двумя
потенциалами:A=dl
абота
по переносу заряда между двумя
потенциалами:A=dl
Работа по изменению поверхности жидкости на величину dS:A=….dS
В формулировке Гельмгольца первое начало термодинамики записывается так:
Полезные
работы


 dU=Q-pdV-A
dU=Q-pdV-A
Н аиболее
полезной работой называется та, которой
система может получить за счет химических
превращений.
аиболее
полезной работой называется та, которой
система может получить за счет химических
превращений.
dV– экстенсивное свойство
рвн=рсист+р
рвнрсист, значит в равновесных условияхр -внутренние свойства.
H=U+pV энтальпия, так же как и внутренняя энергия – функция состояния.
рV – функция состояния, т.о. энтальпия.
Н – функция состояния, т.е. изменения не зависят от пути проведения процесса.
Э![]() нтальпия:
функция теплоты и давленияH=(T,P)
нтальпия:
функция теплоты и давленияH=(T,P)
H=U+pV.
При постоянстве давления и отсутствии других видов работ теплота …. изменением энтольпии системы.
