
Лекции / Лекции (Павлова) / L19
.docЛекция №19.
∆mixS = -R |
Зависимость энтропии от V, P, T.
Обратимся к объединенному уравнению 1-го и 2-го начал т/д:
TdS = dU + pdV
Выразим из этого уравнения величину давления:
![]()
Индекс T указывает на изотермический процесс. Возьмем производную от давления, от температуры при условии постоянства объема:
![]()
В разделе, где мы рассматривали взаимосвязь энтропии и теплоемкости показано, что смешанно две производные в этом уравнении связаны между собой согласно формуле:
![]()
Учитывая это равенство, заключаем, что два последних слагаемых взаимно уничтожаются. Таким образом, получаем выражение:
![]()
Продифференцировав это уравнение по температуре, нетрудно убедиться в справедливости выражения:
![]()
Припишем эту формулу к идеальному газу. Основное уравнение идеального газа: PV = RT
P = RT / V, если дважды продолжим получим 0.
Следовательно, теплоемкость идеального газа не зависит от объема:
![]()
Получим выражение, определяющее зависимость энтропии от давления:
![]()
Для этого воспользуемся выражением для энтальпии системы.
H = U + PV
Продифференцируем его:
dH = dU +PdV +VdP, где dU +PdV = TdS
dH = TdS +PdV
Выразим объем системы:
![]()
После дифференцирования по температуре получим:
![]()
С учетом равенства вторых производных:
![]() ,
получим исходное выражение
,
получим исходное выражение
![]() ;
;
![]()
Продифференцируем по температуре:
![]()
Применим
это уравнение к идеальному газу. Из
уравнения состояния выразим объем
![]() и найдем
и найдем
![]() .
.
Следовательно из второго начала т/д, теплоемкость при постоянном объеме (V) не зависит от давления:
![]() (1)
(1)
![]()
Эти уравнения представляют интерес по той причине, что они выражают скорость изменения энтропии при постоянной температуре и скорость изменения S с V при t=const через величины, которые поддаются экспериментальному определению.
![]() ,
где - коэффициент
термического расширения,
- коэффициент изотермического сжатия.
,
где - коэффициент
термического расширения,
- коэффициент изотермического сжатия.
![]()
В правой части уравнение (1).
Дифференцирование уравнения состояния.
Термические коэффициенты.
1. Термическое и калорическое уравнения состояния.
P, V, T. (P; V; T) = 0
V – внешний параметр.
Внешние параметры – это величины, определяемые положением не входящих в систему частиц. Пример: объем.
Внутренние параметры определяются совокупным движением и расширением входящих в систему частиц. Пример: плотность, энтропия и т.д. Внутренние параметры определяются положением и движением частиц системы и внешними параметрами. В т/д различают калорические и термические уравнения состояния. Уравнения вида:
P = (T, V) – термическое уравнение состояния;
V = (T, P) – термическое уравнение состояния;
Уравнения вида: U – энергия системы:
U = (T, V) – калорическое уравнение
H = (T, P) – калорическое уравнение
Для конденсированных веществ зависимость (P; V; T) = 0 не может быть получено в рамках т/д. Она устанавливается на основе экспериментального вычисления физических свойств веществ. Далее получим некоторые условия, которые должны удовлетворять уравнение состояния каждой системы. Выразим уравнение состояния p = (T, V). Пользуясь математикой, запишем полный дифференциал давления.
![]()
…. ограничение: p=const;
![]()
Из этого уравнения легко получить соответствие, связывающее между собой частные производные одних параметров по другим. Получим:
![]()
Это выражение может быть названо дифференциалом уравнения состояния. Частные производные уравнения состояния обычно используются:
![]()
![]()
- коэффициент термического расширения.
![]()
- коэффициент термической упругости.
Связь между термическими коэффициентами для конденсированных … определяется выражением:
![]()
Т/д температурная шкала.
Для измерения температуры можно пользоваться изменением различных свойств веществ от температуры.
Жидкий термометр. Изменение объема жидкости с температурой.
В термометре сопротивления – изменение термической проводимости.
В термопарах изменение электродвижущей силы. Эти изменения не надо класть в основу построения температурной шкалы. Т.к. все они зависят от индивидуальных свойств того или иного вещества.
0,01 температурного интервала между точкой замерзания и испарения H2O при P = 1 атм – это градус в 100-ной шкале.
Если взять другие жидкостные термометры, отметить на них эти температуры, поделить на равные части, и даже при идеальной циллиндричности капилляра можно обнаружить, что температуры для них не совпадают. Это связано с тем, что коэффициент термичности жид изменяется сам с температурой. = (T) и эти изменения не одинаковы у разных жидкостей. Такая зависимость от вида термометрической жидкости недопустима при построении рациональной шкалы температур. В этом отношении было возможно построение такой шкалы на основе применимости в качестве термометрического вещества идеального газа.
Законы идеальных газов приводят к представлению о температурах абсолютного нуля, что ведет к введению понятия абсолютной температуры. Другой путь построения температурной шкалы, не зависящий от индивидуальных особенностей того или иного вещества, дает второй закон т/д.
Пользуясь соотношением для КПД тепловой машины, можно установить строгую количественную абсолютную шкалу для измерения температуры, основанную на втором законе т/д и не зависящую от устройства термометра.
С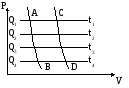 хема
для 3-ех обратимых циклов Карно.
хема
для 3-ех обратимых циклов Карно.
В
процессе участвуют 3-ри термостата (t1,
t2, t3).
Все три цикла ограничены общими
адиабатами AB и CD.
1-ый цикл: действует между изотермами t1 и t2.
2-ой цикл: t1 и t3.
3-ий цикл: t2 и t3.
Через Q1, Q2, Q3 обозначено количество теплоты, полученное рабочим телом, общим для всех циклов. Термостат t2 в первом цикле является холодильником для него, Q2 < 0. В третьем цикле термостат является нагревателем; Q2’’’ > 0.
Запишем для каждого цикла соотношение теплот:
![]()
![]()
![]()
Из этих уравнений получаем взаимосвязь между правыми частями:
![]()
- дзета.
Данная взаимосвязь возможна только в том случае, если (t1, t3) = (t1)(t3)
(t2, t3) = (t2)(t3)
В этих уравнениях и также являются универсальными и зависят от T только одной изотермы. На основании полученных соотношений приходим к равенству:
![]()
Реакция универсальна для любых циклов Карно. Ее вид зависит от выбора шкалы для измерения T. Это соотношение позволяет установить абсолютную шкалу измерения T, не зависящую от особенностей прибора, с помощью которого ее измеряют.
