
Лекции / Лекции (Павлова) / L13
.docЛекция №13.
Qобр = dU + pdV A’ = 0
Qобр = CvdU + pdV
pV = RT
Qобр = CvdU + (RT / V)·dV |:T
![]()
![]() 0
= 0
0
= 0
Левая часть уравнения – полный
дифференциал. Мы доказали, что
![]()
Доказано существование энтропии с помощью представлений для идеального газа из первого закона термодинамики и уравнения состояния.
Общий случай.
Исходя из первого закона термодинамики, можно показать, что для системы справедливо:
Q = Xdx +Ydy +Zdz + … (1)
Выражение типа (1) называется уравнениями Пфаффа. Мы работали с уравнением Пфаффа с двумя степенями свободы: z = Mdx + Ndy
Остановимся на математических свойствах уравнения Пфаффа:
В тех случаях, когда dz является полным дифференциалом, т.е. функция z зависит от переменных x и y, имеет место равенство частных производных
![]() (2)
(2)
По правилу дифференциации запишем полный дифференциал dz в виде
![]()
![]()
![]()
Введем эти соотношения в уравнение (2),
получим условие
![]() ,
получили равенство вторых производных.
,
получили равенство вторых производных.
Итоги: в теории уравнений Пфаффе показано, что для системы с двумя степенями свободы, например, совершается только механическая работа, всегда имеется интегрирующий делитель. При большем числе степеней свободы уравнение Пфаффе имеет интегрирующий делитель только в том случае, если в точке B, лежащей на линии или поверхности, описываемой уравнениями (1) или уравнением Q = dU + pdV (3), есть хотя бы одна точка, которая не может быть достигнута из точки B по кривой, из условия Q = 0, т.е. условия адиабатного процесса.
Принцип недостижимости Каратериодири:
В близи
любого состояния термически однородной
и адиабатически изолированной системы
существует множество других состояний,
не достижимых адиабатической изоляции
системы.
близи
любого состояния термически однородной
и адиабатически изолированной системы
существует множество других состояний,
не достижимых адиабатической изоляции
системы.
Должны существовать точки, куда нельзя прийти адиабатическим путем. Справедливость принципа Каратериодири можно доказать, исходя из постулатов Томсона. Рассмотрим состояния a и b, перейдем a b изотермическим путем, переход за счет теплоты и из теплоотдатчика. Согласно первому началу термодинамики эта теплота в изотермическом процессе будет израсходована на изменение внутренней энергии системы и совершение работы. Q = -∆U + A’
(Q = A + A’) не может быть, т.к. противоречие второму началу термодинамики.
Физический смысл энтропии. Энтропия и необратимые процессы.
Используя формулу Клаузиуса, запишем объединенные уравнения первого и второго начал термодинамики.
объединение первого и второго законов
термодинамики справедливо только для
обратимых процессов.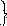
![]()
dU = TdS – pdV (*)
dU = TdS - A (*)
 Получим
характеристики необратимых процессов.
Рассмотрим переход системы из состояния
1 в состояние 2 двумя путями:
Получим
характеристики необратимых процессов.
Рассмотрим переход системы из состояния
1 в состояние 2 двумя путями:
∆U = U2 – U1 изменение не зависит от типа процесса. Используя первое начало термодинамики, запишем выражение для ∆U:
-
обратимый процесс:
∆ U
= Qобр - Aобр
U
= Qобр - Aобр
-
необратимый процесс:
∆U = Qнеобр - Aнеобр Aобр > Aнеобр
Qобр > Qнеобр

Вся обратимая площадь - необратимая работа.
Запишем изменение энтропии в обратимом процессе, посчитаем изменение интеграла для приведенных теплот:
(2) > (1)![]()
![]() - необратимый процесс (1)
- необратимый процесс (1)
Изменение энтропии связано с приведенной теплотой знаком равенства только в обратимом процессе. Аналогично запишем для цикличного процесса:
-
обратимый: ![]()
-
необратимый: ![]()
-
общий случай: ![]()
Последняя запись не означает, что в необратимом цикле изменяется энтропия, изменение энтропии равно нулю для любого цикла, но сумма приведенных теплот полученной системы меньше нуля, в результате проведенного цикла окружающая среда получит системы некоторое количество приведенной теплоты. Если прямой цикл необратимый, то теплоприемник получит больше теплоты, чем в обычном процессе, при одинаковых теплотах, взятых от теплоотдатчика. В этом случае теплота необратимо перейдет от передатчика к приемнику.
Основные выражения второго начала термодинамики.
|
обратимый процесс |
необратимый самопроизвольный процесс |
любой процесс |
|
|
|
|
|
конечный |
|
|
|
изотермический процесс
|
(T=const)
|
|
|
адиабатический процесс ∆S = 0 |
∆S > 0 |
|
|
объединенные уравнение (1) и (2) начала термодинамики: |
||
|
dU = TdS - A |
dU < TdS - A |
|
|
если A’=0, dU = TdS - pdV |
A = pdV dU < TdS - pdV |
|
Наиболее важные из этих соотношений, соотношения для адиабатического процесса, из которого следует, что для адиабатического процесса в химически изолированной системе изменение энтпропии dS 0, ∆S 0. Т.е. энтропия постоянна, если преодолеваются внешние силы и проделывается работа, и энтропия растет, если необратимый процесс, все это справедливо для изолированной системы, когда отсутствуют внешние силы.
Всякий самопроизвольный процесс необратим в изолированной системе. Равновесие характеризуется максимумом энтропии. Энтропия – критерий самопроизвольного протекания процесса.
