
Лекции / Лекции (Павлова) / L8
.doc
![]() Лекция
№8.
Лекция
№8.
![]() Глазов,
Пашин.
Глазов,
Пашин.
О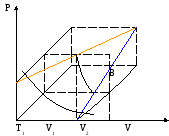 бъемная
диаграмма идеального газа:
бъемная
диаграмма идеального газа:
D
T2
P1
T3 C
Каждое равновесное состояние идеального газа на каждой диаграмме обозначается точками с координатами T,P,V. Представлены три сечения плоскостями постоянной температуры T1=const, T2=const,T3=const совокупность AB – изотерма (гипербола при T=const) при V=const и P=const – прямые.
A(P1, V1, T1) – исходное состояние идеального газа. Рисунок показывает состояние идеального газа при переходе газа из одного состояния в другое.
С не лежит на прямой T=const, т.к. адиабатный процесс.
Работа адиабатического процесса AC’V2V1.
Термохимия. Тепловой эффект химической реакции.
Закон Гесса.
Отличительной чертой химических реакции является глубокое изменение системы взаимодействующих веществ, которое сопровождается обычно выделением или поглощением энергии, чаще всего тепловой. Можно предвидеть течение химических процессов и управлять ими, меняя соответствующим образом внешние условия, путь – изучение отдельных химических связей и прочность химических связей. Изменение внутренней энергии в химической реакции происходит путем выделения (поглощения) теплоты и совершением работы.
A = du +A A’ 0
A – работа химической реакции, должна быть очень мала, т.е. близка к нулю, т.к. все химические реакции необратимые процессы, А в необратимом процессе тем меньше, чем более он не обратим. Работу химической реакции можно не учитывать или вычислять.
Теплота – значительная величина и часто определяется экспериментальным путем. Изучением теплот химических реакций занимается термохимия, где рассматривается калометрия, учение о …. и теплоемкости и др. Калометрия – экспериментальный метод определения ∆H, ∆U, CP , CT и др. В термохимию внесли большой вклад Г. И. Гессе и Ю. Томсон, которые в 19 веке занимались теплотой химических реакций. Учение о теплотах химических реакций – термохимия.
Тепловой эффект химической реакции.
Это мера изменения запаса энергии системы в результате необратимого протекания данного химического процесса. Тепловой эффект определяется суммой выделенной или поглощенной при реакции теплоты и совершенной внешней работы, выраженной в тех же единицах, когда реагируют между собой молярные количества веществ, тепловой эффект и теплота не одно и тоже.
Тепловой эффект химической реакции эквивалентен теплоте, которая поглощается (выделяется) при реакции при соблюдении следующих условий:
-
P=const или V=const
-
При химическом процессе никаких работ кроме расширения.
A’ = 0 A = pdV
-
Температуры исходных веществ и продуктов реакции должны быть одинаковы.
T1=T2
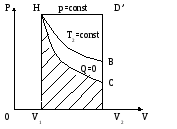
Пояснить написанное, используя первый закон т/д, т.е. доказать, что тепловой эффект химической реакции не зависит от пути протекания этой реакции. (Доказательство требует введения условий полной необратимости химической реакции (Q)V,Yi = dU ).
(Q)P,Yi = dH
Yi – координата или фактор экстенсивности для выражения любой полезной работы в случае изобарического процесса; необратимость химической реакции заключается в том, что внутренняя энергия не переходит ни в какие виды работ, кроме работы расширения.
Закон Гессе (1840г.) – закон постоянства
сумм теплот химических реакций.
Тепловой закон Гессе: тепловой эффект химической реакции при V=const и p=const не зависит от пути реакции, а зависит только от природы и состоянии исходных веществ и продуктов реакции (на основании анализа экспериментальных данных).
Рассмотрим получение четыреххлористого аммония.
Имеем: NH3 (Г) , HCl (Г) продукт – NH4Cl (…..)
-
1. NH3 (Г) + HCl (Г) = NH4Cl (Г) Тепловой эффект этой реакции ∆H1=-41.85ккал.
2. NH4Cl(Г) + H2O = NH4Cl(АДИА) ∆H2=3,92 ккал
3. NH3 (Г) + HCl(Г) + aq = NH4Cl(AQ)
II. 1. NH3 (Г) + aq = NH3 (AQ) ∆H’1=-8,35 ккал
2. HCl (Г) + aq = HCl (AQ) ∆H’2=-17,32 ккал
3. NH3 (AQ) + HCl (AQ) = NH4Cl (AQ) ∆H’3=-12,27 ккал
= -37,94 ккал
Изобразим процесс в виде схемы:
и сходные
вещества
сходные
вещества
I путь
Условие 3 выведено для удобства сопоставления тепловых эффектов. Тепловые эффекты химических реакций зависят главным образом от температуры в меньшей степени от давления.
Стандартное состояние.
Вводится для удобства сопоставления тепловых эффектов и других термодинамических функций.
Для твердых и жидких веществ в качестве стандартных принимают их устойчивые состояния при внешнем давлении равные 1 атм.
Для газа в качестве стандартного принимается состояние идеального газа при 1 атмосфере. В ряде случаев при этихусловиях реальный газ далек от идеального.
Рассмотрим состояние водяного пара при p = 1атм. T = 25C (такое состояние для пара – гипотетическое , т.к. при t=25C давление насыщенного пара составляет 0,0312 атмосфер).
При переходе от экспериментальных к стандартным функциям (и наоборот) надо учитывать поведение реального газа при p = 1 атмосф. от идеального. Поясним с помощью рисунка, как это происходит.
в точке В свойства реального газа близки
к идеальному
АО – отклонение свойств идеального
газа от реального.
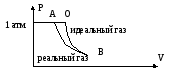
Переход от реального состояния к стандартному (точка О) осуществляется (точка А) путем изотермического расширения газа до точки B, в которой отклонение от идеального поведения ничтожно мало. Последующее сжатие по изотерме идеального газа до точки O, для этого пути рассчитывают соответствующие изменения рассматриваемое т/д функции. Если изотермы реального и идеального газа при P<1 атм. близки, то поправки на не идеальность малы, если отклонения велики, то поправки больше.
Стандартные состояния могут выбираться при любых температурах, но в справочниках в качестве стандартных беруться температуры.
-
t = 25C или 298,15 K
-
T = 0K
H стандартное состояние (1 амт, 298K или 0К) (индекс «» сверху – стандартное состояние)
H298,15 K H0 K
 Реакция
образования воды:
Реакция
образования воды:
Запишем тепловые эффекты этих реакций:
-
∆H298,15 = -63,315 ккал
-
∆H298,15 = -57,796 ккал
Такая запись означает, что стандартные величины относящиеся к температуре 298,15 К, которая показывает, что превращение 1 моль водорода и 0,5 моль кислорода, взятых в стандартных состояниях, в 1 моль Н2О(эл) или в 1 моль Н2О(пар) характеризуются приведенными значениями тепловых эффектов.
Различие в величинах ∆Н определяется тепловым эффектом превращения, связанного с изменением агрегатного состояния воды. Это превращение относится к 298К, когда жидкая вода при 1 атм переходит в гипотетическом плане в Н2О(пар).
