

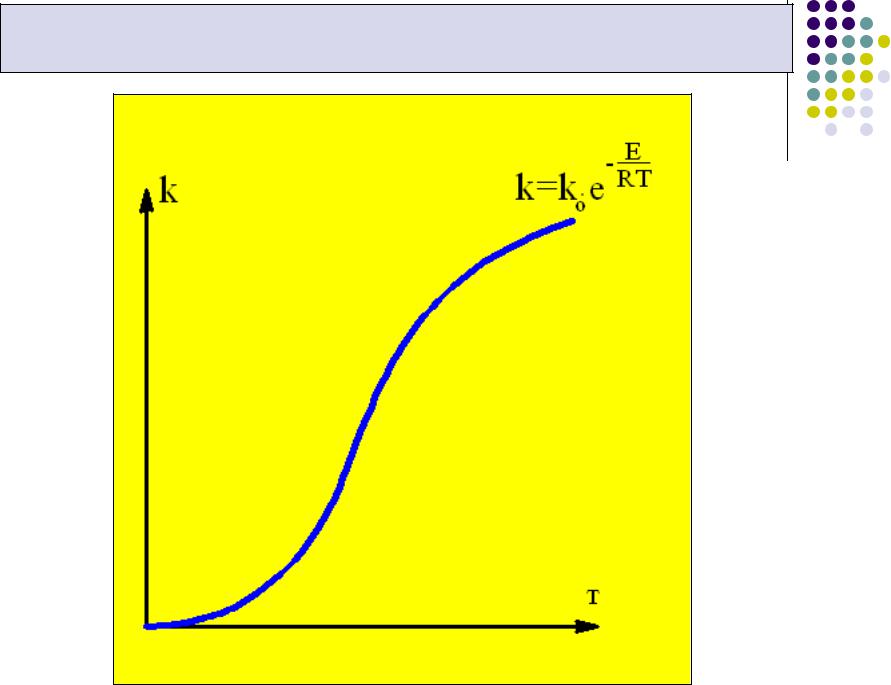
Зависимость скорости реакции от температуры
Закон Максвелла-Больцмана Закон Аррениуса
Закон Максвелла-Больцмана 






Скорость химической реакции в значительной степени зависит от температуры. Чаще всего для начала активной реакции
систему реагирующих веществ необходимо подогреть. При этом увеличивается число так называемых “активных молекул”, имеющих энергию выше энергии активации.
Число молекул, обладающих тем или иным уровнем
энергии Е, определяется статистическим законом
Максвелла – Больцмана
NE = No exp(–E/RT)
No – полное число молекул в единице объёма, R = 8,314 кДж/(кмоль∙К)
Закон Максвелла-Больцмана 






Закон Максвелла-Больцмана 






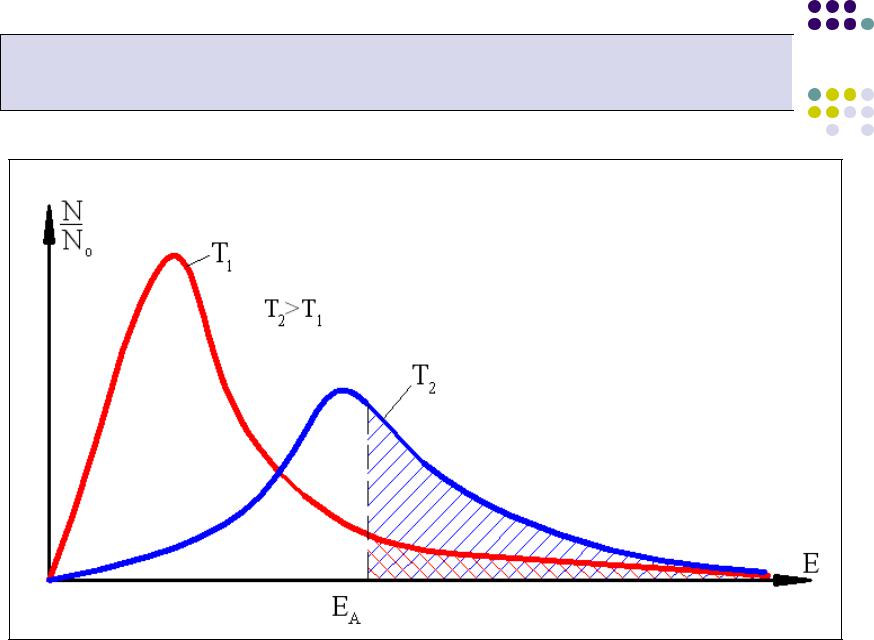
При низкой температуре Т1 лишь малая доля молекул (заштрихованная площадь под кривой Т1) имеет энергию выше энергии активации ЕА. Их так мало, что тепла, выделяющегося в результате отдельных актов реакции,
недостаточно, чтобы заметно повысить температуру смеси.
C повышением температуры до Т2 происходит перераспределение энергий молекул (заштрихованная площадь под кривой Т2), в результате чего становится возможной активная реакция, сопровождающаяся ростом температуры.
Естественно, |
что при более низком уровне |
энергии |
активации ЕА |
химическая реакция может протекать при |
|
более низкой |
температуре. |
|
Одновременно c увеличением числа “активных молекул” растёт и скорость химической реакции.
Закон Аррениуса
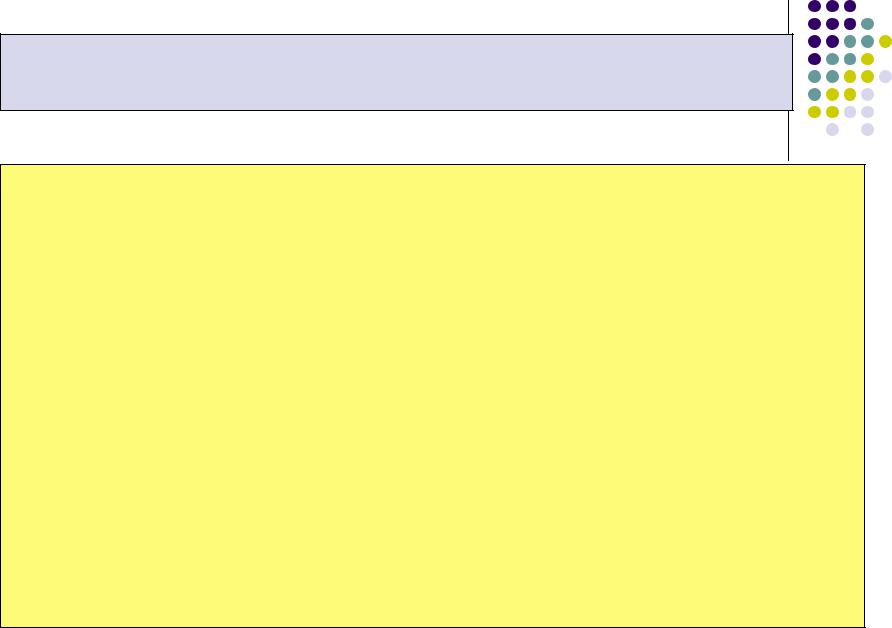
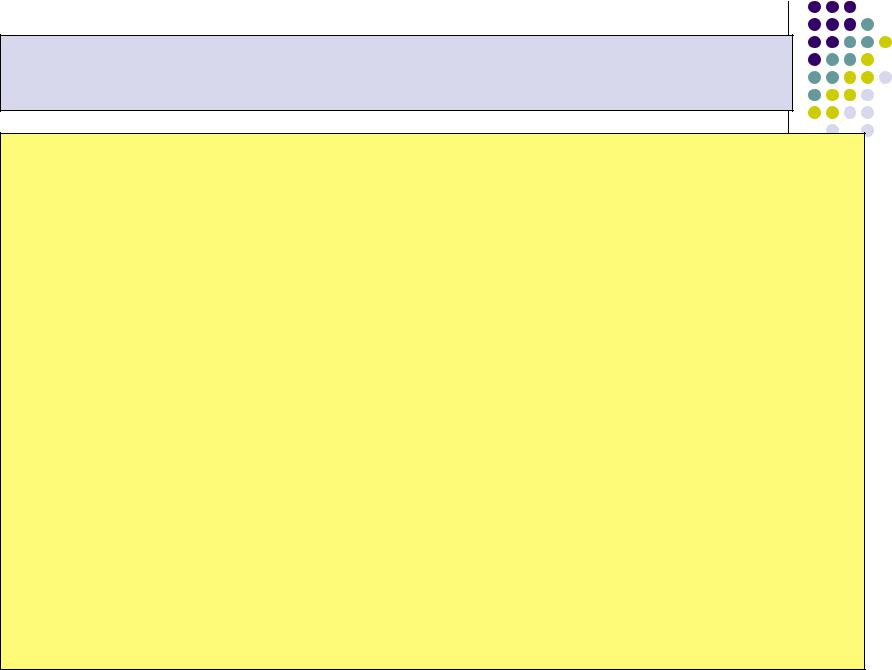
Закон Аррениуса устанавливает зависимость
константы скорости химической реакции от температуры и представляет собой частный случай закона Максвелла - Больцмана применительно к химическим реакциям
|
|
|
E |
A |
|
|
k k0 |
exp |
|
|
|
|
|
|
|
|
||||
|
|
|
R T |
|||
k0 – коэффициент пропорциональности, |
характеризующий |
|||||
частоту столкновений всех реагирующих молекул (активных и неактивных) в единице объёма реагирующей смеси.
Закон Аррениуса
Закон Аррениуса
Частота столкновений зависит от скорости свободного пробега молекул, которая в свою очередь согласно
кинетической теории пропорциональна корню квадратному из температуры, т.е. k0=A∙T0,5 . Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 до 300°C приводит к увеличению частоты столкновений на 10 %.
Множитель exp(Е/RT) отражает долю общего числа столкновений, которые возникают между “активными” молекулами и приводят к реакции.
Таким образом, с повышением температуры константа скорости реакции увеличивается, что при сохранении концентрации исходных веществ приводит к росту скорости реакции.
Пример
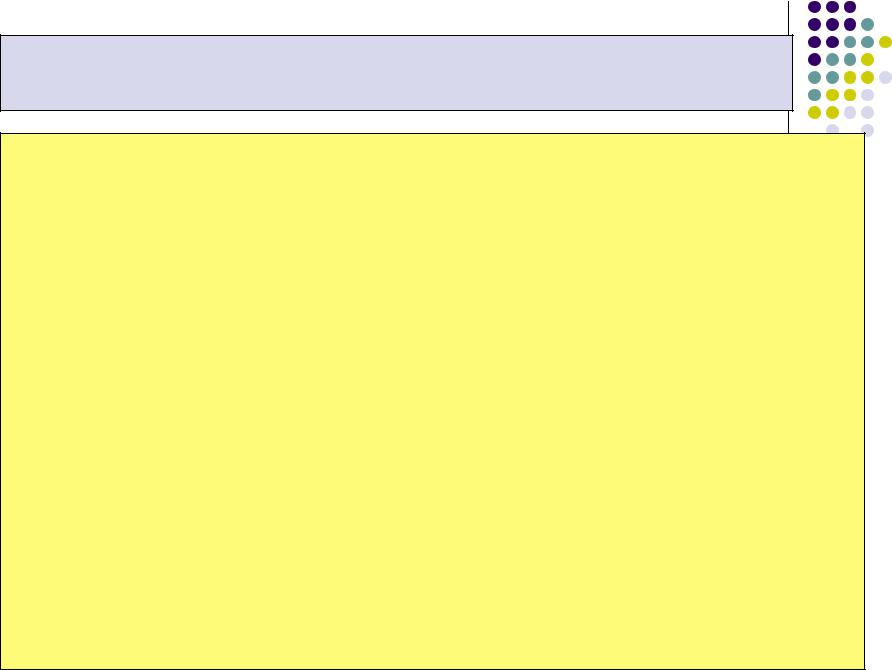
Рассмотрим горение углерода c образованием двуокиси
углерода при энергии активации Е=125000 кДж/кмоль и температурах Т1=1000 К и Т2=1500 К, при этом концентрации кислорода у поверхности горения и в объёме считаем одинаковыми.
При ko=const
W2 / W1 = exp(–125000/8,314∙1500) / exp(–125000/8,314∙1000) = еxp(–10)/еxp(–15) = еxp(5) = 145.
При дальнейшем повышении температуры реакции возрастание скорости ослабевает. Так, при увеличении
температуры ещё на 500°C (Т3=2000 К) отношение скоростей составит:
W3 / W2 = exp(–7,5) / exp(–10) = exp(2,5) = 12,2.
Пример
В то же время за счёт роста температуры увеличиваются и
скорости движения молекул, а, следовательно, и значение множителя k0:
ko2 / ko1 = (1500 / 1000)0,5 = 1,22.
Очевидно, что изменение k0 несоизмеримо c влиянием температуры на рост числа реакционно-способных молекул и их соударений.
C учётом изменения k0 суммарное увеличение скорости реакции cоcтавит:
n = W2 / W1 = 145∙1,22 = 177.
Как видно из примеров, воздействие роста температуры на скорость химической реакции постепенно ослабевает, а скорость реакции стремится к какому-то ограниченному максимуму.

