
- •Основы кинетики процесса горения
- •Скорость гомогенной
- •Скорость реакции
- •Скорость реакции
- •Закон действующих масс
- •Константа равновесия
- •Скорость химической
- •Скорость прямой и обратной реакции
- •Константа скорости
- •Порядок реакции
- •Порядок сложной
- •Порядок сложной
- •Гетерогенное горение
- •Гетерогенное горение
- •Надеюсь, Вы что-то запомнили?!

Основы кинетики процесса  горения
горения
Основу процесса горения составляет
химическое взаимодействие между горючими веществами и окислителем.
Поэтому особое внимание следует уделить изучению химического фактора при горении топлива.
Кинетика - учение о механизме и
общих закономерностях протекания химического процесса во времени.

Скорость гомогенной
реакции
В химической кинетике скорость |
||||||
гомогенной реакции определяется |
||||||
количеством |
вещества, |
которое |
||||
прореагировало в единице объёма |
||||||
за единицу |
времени |
[кмоль/ |
||||
(м3∙c)] : |
|
1 |
dni |
|
||
W |
|
|
||||
|
|
|||||
i |
V |
|
d |
|
|
|
|
|
|
|
|||

Скорость реакции
 В закрытой системе при V = const
В закрытой системе при V = const
|
d |
n |
|
|
dC |
|
|
Wi |
|
|
|
i |
|
d |
i |
|
|
|
|||||
|
d |
V |
|
|
|||
Знак “минус” указывает на уменьшение концентрации вещества в процессе реакции
Для совершения реакции, прежде всего, необходимо столкновение молекул. Число таких столкновений тем больше, чем больше количество молекул в единице объёма, т.е. чем больше концентрация реагирующих веществ.

Скорость реакции
горения
Скорость реакций горения можно охарактеризовать скоростью расхода исходных компонентов или скоростью образования конечных продуктов сгорания:
2Н2 + О2 = 2Н2О
Скорость реакции, измеренная по расходу водорода, не равна скорости реакции, измеренной по расходу кислорода. Чтобы избежать такой неоднозначности, необходимо указывать, по какому компоненту (исходному или конечному) определяется скорость реакции.
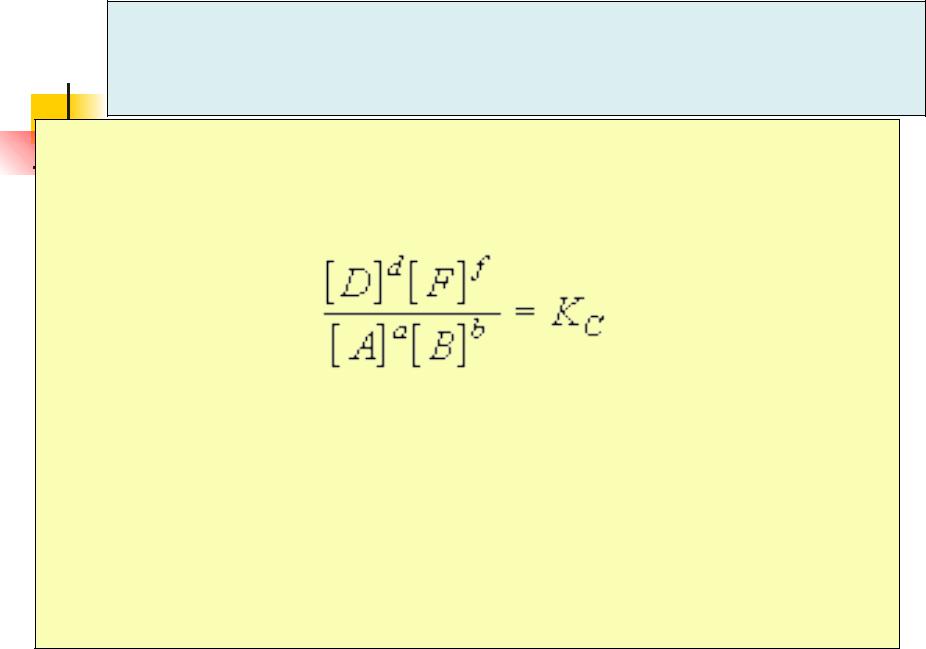
Закон действующих масс
Для обратимой реакции aA + bB ↔ dD + fF
в состоянии равновесия при постоянной температуре соблюдается соотношение:
Закон действующих масс:
При постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.

Константа равновесия
Если константа равновесия KC велика, то
равновесие сдвинуто в сторону продуктов прямой реакции, если мала, то - в сторону исходных веществ.
Если константа равновесия очень велика KC →∞,
то говорят, что реакция "практически необратима", если константа равновесия очень мала KC →0, то реакция "практически”
не идёт.
Константа равновесия - для каждой обратимой реакции величина постоянная только при постоянной температуре.

Скорость химической
реакции
Согласно закону действующих масс, в закрытой гомогенной системе при постоянной температуре
скорость химической реакции в каждый момент времени
пропорциональна |
произведению |
концентраций |
реагирующих веществ: |
|
|
W kCAaCBb
Наравне c прямой реакцией возможно протекание и обратной, скорость которой увеличивается по мере накопления продуктов реакции.

Скорость прямой и обратной реакции
2Н2 + О2 = 2Н2О
W1 k1CH2 2 CO2
W2 k2CH2 2O
k1, k2 - коэффициенты пропорциональности,
называемые константами скорости реакции.

Константа скорости
реакции
Константа скорости реакции k характеризуют
число эффективных столкновений молекул, приводящих к реакции.
Результирующая скорость реакции
Wpез=W1–W2.
В случае, когда W1>>W2, можно пренебречь скоростью обратной реакции и принять
Wpез=W1. Такая реакция называется
необратимой.
При анализе топочных процессов реакции горения считаются необратимыми, если они протекают в области температур ниже 1800- 2000°С, поскольку диссоциация продуктов сгорания CО2, Н2О, SО2 в этих условиях ничтожна.

Порядок реакции
Показатели степени (a и b) при концентрациях
реагирующих веществ в кинетическом уравнении называются порядком реакции по данному веществу.
Сумма порядков реакции по отдельным компонентам называется общим, или полным, кинетическим порядком реакции: n = a + b .
Для элементарных химических реакций порядок реакции
равен молекулярности. Моно-, би- и тpимолекуляpные реакции являются соответственно реакциями первого, второго и третьего порядков.
Так как |
итоговое |
стехиометрическое уравнение |
|
сложной |
реакции |
не отражает |
механизм её |
протекания, то и стехиометрические коэффициенты a и b
не выражают порядок реакции по отдельным компонентам, а их сумма не равна порядку реакции в целом.
