
Магистры Термодинамическое подобие / Термодинамическое подобие / Подобие в критической точке
.pdfКраткое сообщение___________________________________________________ |
Тематический раздел: Физико-химические исследования. |
Регистрационный код публикации: 2tp-b31 |
Подраздел: Теплофизические свойства веществ. |
УДК:536.7. Поступила в редакцию 10 ноября 2002 г. |
|
ОСООТНОШЕНИИ МЕЖДУ ТЕРМОДИНАМИЧЕСКИМИ ПАРАМЕТРАМИ ВЕЩЕСТВА В КРИТИЧЕСКОЙ ТОЧКЕ И ПРИ АБСОЛЮТНОМ НУЛЕ
© Каплун А.Б., Мешалкин А.Б. и Басин А.С.
Институт теплофизики СО РАН. г. Новосибирск. Россия. E-mail: kaplun@itp.nsc.ru, basin@itp.nsc.ru
Ключевые слова: термодинамические параметры, уравнение состояния, критическая точка.
В наших работах, посвящённых разработке уравнения для описания коэффициента вязкости жидкости и газа в широкой области параметров состояния [1, 2], в работах о предпочтительной структуре уравнения состояния жидкости и газа [3, 4], а также в большом числе работ других авторов, одним из важнейших параметров, входящих в соответствующие уравнения,
является объём (или плотность) переохлаждённой до абсолютного нуля жидкости V00 . Параметр V00 имеет смысл объёма,
занятого молекулами термодинамической системы в отсутствие трансляционного движения. Это понятие близко по смыслу к понятию собственного объёма молекул, введённому ещё Ван-дер-Ваальсом, хотя эти два понятия имеют существенные
различия. |
При записи уравнений состояния в безразмерных переменных, в них |
фигурирует |
безразмерная переменная |
|||||||||
x = |
V |
ρ |
c , |
если в качестве соответственной точки выбирается критическая точка жидкость-пар. |
При нулевом давлении и |
|||||||
|
= |
ρ |
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|||
|
c |
|
|
|
|
V 0 |
|
|
|
|
||
температуре |
безразмерная переменная х превращается в безразмерный параметр |
|
|
ρ |
|
. Этот параметр широко |
||||||
|
|
|
|
|
|
x = |
0 |
= |
|
c |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
0 |
|
Vc |
|
ρ 00 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
использовался Филипповым Л.П. в развитом им однопараметрическом методе термодинамического подобия [5-7].
В настоящей работе мы хотели бы привлечь внимание исследователей к соотношению Филиппова-Тиммерманса [7]:
ρ |
c |
|
V 0 |
µ P V |
, |
(1) |
||
|
= |
|
0 |
= Zc = |
c c |
|
|
|
ρ |
00 |
Vc |
RTc |
|
|
|||
|
|
|
|
|
||||
здесь РС, ТС, VС ,ρ C, ZC - давление, температура, удельный объём, плотность и фактор сжимаемости в критической
точке жидкость-пар, µ - молярная масса вещества, R - универсальная газовая постоянная, V00 и ρ 00 - удельный объём и плотность переохлаждённой до абсолютного нуля температуры и нулевого давления жидкости.
Несмотря на то, что со времени появления соотношения (1) прошло много лет (см., например, [6]), в литературе нам не удалось обнаружить никаких физических обоснований соотношения (1), не говоря уже о строгой теории. Судя по всему, сам Л.П. Филиппов придавал не слишком большое значение этому соотношению, поскольку, по-видимому, считал это соотношение сугубо приближённым. В своих статьях и книгах (см., например, [5-7]) Филиппов Л.П. находит некоторое среднее значение отношения ρ 0  ρ C для большого числа неассоциированных органических жидкостей:
ρ C для большого числа неассоциированных органических жидкостей:
=3.95 , (2)
ρc
идалее использует соотношение в расчётах термодинамических свойств веществ в рамках развитого им однопараметрическогоρ
метода термодинамического подобия.
Насколько нам известно, детальной проверки соотношения (1) на веществах различной физической природы не проводилось.
Анализ опытных и табличных данных о термических свойствах индивидуальных веществ в широкой области параметров состояния [3, 4] показал, что соотношение (1) выполняется в пределах погрешности входящих в него параметров для веществ самой различной физической природы (см. таблицу). В это число входят и ряд металлов, для которых известны экспериментальные значения РС, ТС, ρ C [8].
Таблица. Сравнение рассчитанных по уравнению (3) значений критической плотности с литературными данными для некоторых веществ.
|
0 |
1 |
|
1 |
|
|
V0 |
ρ *C , |
|
ρ c − ρ *c |
|
|
|
ρ C = Vc |
|
x = Vc |
|
||||||
|
ρ 0 = |
V 0 |
ZC |
по (3) г/см3 |
|
|
|
||||
Вещество |
|
ρ c |
|
||||||||
|
0 |
г/см |
3 |
|
|
|
|
|
|
||
|
г/см3 |
|
|
|
|
|
100% |
|
|||
|
|
|
|
|
|
|
|
|
|
||
Аргон [9] |
1.852 |
0.536 |
0.291 |
0.289 |
0.537 |
0.2 |
|
||||
Азот [13 ] |
1.105 |
0.313 |
0.290 |
0.283 |
0.317 |
1.3 |
|
||||
Кислород [11] |
1.543 |
0.436 |
0.288 |
0.283 |
0.440 |
0.9 |
|
||||
Аммиак [12] |
0.942 |
0.235 |
0.244 |
0.249 |
0.232 |
1.3 |
|
||||
Диоксид углерода [10] |
1.701 |
0.468 |
0.275 |
0.274 |
0.469 |
0.2 |
|
||||
Тетрафторметан [15] |
2.252 |
0.630 |
0.277 |
0.280 |
0.626 |
0.6 |
|
||||
Тетрахлорметан [15] |
2.125 |
0.558 |
0.270 |
0.261 |
0.564 |
1.1 |
|
||||
Этилен [6] |
0.787 |
0.214 |
0.281 |
0.272 |
0.218 |
1.9 |
|
||||
Этан [6] |
0.753 |
0.204 |
0.282 |
0.271 |
0.208 |
2.0 |
|
||||
Метилпропионат [6] |
1.249 |
0.319 |
0.251 |
0.258 |
0.314 |
1.6 |
|
||||
н-Пентан[6] |
0.898 |
0.237 |
0.262 |
0.264 |
0.235 |
0.8 |
|
||||
Бензол [6] |
1.196 |
0.302 |
0.271 |
0.253 |
0.311 |
3.0 |
|
||||
Фторбензол [6] |
1.380 |
0.357 |
0.266 |
0.259 |
0.358 |
0.3 |
|
||||
Хлорбензол [6] |
1.412 |
0.365 |
0.267 |
0.258 |
0.367 |
0.6 |
|
||||
Бромбензол [6] |
1.876 |
0.485 |
0.264 |
0.259 |
0.486 |
0.2 |
|
||||
Йодбензол [6] |
2.264 |
0.581 |
0.266 |
0.257 |
0.589 |
0.2 |
|
||||
Калий [16] |
0.906 |
0.17 |
0.191 |
0.188 |
0.171 |
0.6 |
|
||||
Рубидий [17,18] |
1.589 |
0.292 |
0.218 |
0.184 |
O.318 |
8.9 |
|
||||
Цезий [17, 18] |
1.971 |
0.379 |
0.202 |
0.192 |
0.389 |
2.6 |
|
||||
Ртуть [16] |
14.265 |
5.8 |
|
0.394 |
0.406 |
5.886 |
1.5 |
|
|||
136 _______________________________ © Химия и компьютерное моделирование. Бутлеровские сообщения. 2002. Приложение к спецвыпуску № 10.
О СООТНОШЕНИИ МЕЖДУ ТЕРМОДИНАМИЧЕСКИМИ ПАРАМЕТРАМИ ВЕЩЕСТВА _________________________________________ 136-137
1,0 |
|
|
|
|
|
|
|
0,9 |
|
|
|
|
|
|
|
0,8 |
|
|
|
|
|
|
|
0,7 |
|
|
|
|
|
|
|
0,6 |
|
- Ar |
|
|
|
|
|
y |
|
- O2 |
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
0,4 |
|
- NH3 |
|
|
|
|
|
0,3 |
|
- CF4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
0,2 |
0,4 |
0,6 |
0,8 |
|
1,0 |
|
0,0 |
|
||||||
|
|
|
|
τ |
|
|
|
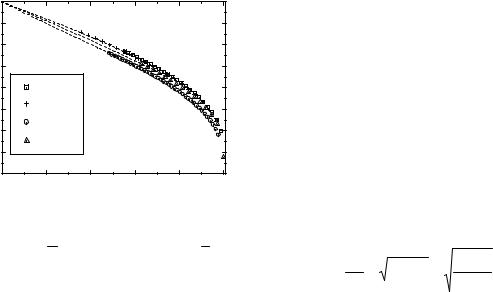
Рисунок. Зависимость величины приведённой плотности |
|||||||
жидкости |
y = |
ρ Zc |
от приведённой температуры τ |
= |
T |
||
|
|
ρ c |
|
|
|
|
Tc |
на линии насыщения для различных веществ. |
|
|
|||||
Плотность вещества, ρ 00 = 1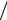 V00 , определялась несколь-
V00 , определялась несколь-
кими способами: по экстраполяции до 0К опытных данных о плотности твердого тела или жидкости на линии насыщения и с помощью правила прямолинейного диаметра для плотности пара и кипящей жидкости на линии насыщения. Все три способа
определения ρ 00 для нормальных |
веществ дают близкие |
по |
||
величине результаты. |
|
|
|
|
Если построить график зависимости комплекса y = ρ ls |
Zc |
|||
|
T |
|
ρ c |
|
от приведённой температуры τ = |
|
по опытным данным по |
||
T |
|
|||
|
c |
|
||
плотности жидкости на линии насыщения ρ |
s , то в соответствии с |
||||||||
соотношением (1) у→ 1 при τ→ |
|
|
l |
|
|||||
0. Рисунок |
иллюстрирует это |
||||||||
утверждение. |
|
|
|
|
|
|
|
|
|
Из (1) следует, что |
|
|
|
|
|
||||
ρ * = |
1 |
= |
Z |
|
ρ 0 = |
µ P |
ρ 0 |
|
(3) |
V* |
|
c |
0 . |
|
|||||
c |
|
|
c |
0 |
RTc |
|
|
||
|
c |
|
|
|
|
|
|
|
|
Выше в таблице приведены результаты проверки справедливости соотношений (1) и (3) для веществ различного класса: одно- и многоатомных газов, углеводородов и металлов.
Вещества с "аномальным" (сильным квантовым взаимодействием, химическими превращениями, фазовыми переходами в области между тройной и критической точками) поведением термических свойств правилу (1) не подчиняются, например, гелий, водород, вода, сера и т.д.
Как видно из таблицы, рассчитанные по правилу (1) значения критической плотности ρ С в пределах погрешностей как опытных данных, так и входящих в уравнение (3) величин совпадают с опытными или наиболее надёжными расчётными данными. Наибольший интерес, по нашему мнению, представляет согласие между рассчитанными по (3) значениями о критической плотности металлических жидкостей с опытными (ртуть, рубидий, цезий) и наиболее надёжными расчётными величинами (калий). Тот факт, что соотношению (1) подчиняется такое аномальное вещество, как ртуть, не говоря уже о большом количестве органических и неорганических веществ, может свидетельствовать о том, что соотношение (1) имеет силу достаточно общего правила или закона (естественно, имеющего определённые ограничения).
Практическая и научная важность правила (1) очевидна, поскольку соотношение (1) позволяет вычислить фактор сжимаемости в критической точке и определить критическую плотность для малоизученных или трудных для эксперимента веществ. И наоборот, если известны критические параметры вещества, то может быть найден объём переохлаждённой до
абсолютного нуля жидкости V00 = 1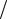 ρ 00 , который входит, например, во многие уравнения для расчёта физических свойств
ρ 00 , который входит, например, во многие уравнения для расчёта физических свойств
веществ в моделях свободного объёма. Тем более удивительным представляется тот факт, что правило (1) до сих пор не имеет научного объяснения.
Литература
[1] Каплун А.Б. Единое уравнение для коэффициента вязкости жидкости и газа. ТВТ. 1989. Т.27. №5. С.884-888.
[2]Kaplun A.B., Meshalkin A.B. The dependence of the liquid and gas viscosity from the state parameters. High Temperature and High Pressure. 2001. Vol.33. P.365-369.
[3]Каплун А.Б., Мешалкин А.Б. О структуре единого уравнения состояния. ДАН. 2001. Т.376. №5. C.624-628.
[4]Каплун А.Б., Мешалкин А.Б. Улучшенное уравнение состояния типа уравнения Ван-дер-Ваальса. ЖФХ. 2001. Т.75. №12. C.2135-2141.
[5]Филиппов Л.П. Использование теории подобия для описания свойств жидкостей. ЖФХ. 1963. Т.37. №1. C.201-204.
[6]Филиппов Л.П. Подобие свойств веществ. М.: Изд-во МГУ. 1978. 256 с.
[7]Филиппов Л.П. Прогнозирование теплофизических свойств жидкостей и газов. М.: Энергоиздат. 1988. 168с.
[8]Басин А.С. К оценке критических параметров рубидия и цезия. В кн.: "Вопросы гидродинамики и теплообмена". Новосибирск: Институт теплофизики СОАН
СССР. 1972. С.168-172.
[9]Рабинович В.А., Вассерман А.А., Недоступ В.И., Векслер Л.С. Теплофизические свойства неона, аргона, криптона и ксенона. M.: Издательство стандартов.
1976. 636 с.
[10]Алтунин В.В. Теплофизические свойства двуокиси углерода. M. Издательство стандартов. 1975. 546с.
[11]Сычев В.В., Вассерман А.А., Козлов А.Д., и др. Термодинамические свойства кислорода. M.: Издательство стандартов. 1981. 304с.
[12]Голубев И.Ф., Кияшова В.П., Перельштейн И.И., Парушин Е.Б. Теплофизические свойства аммиака. M.: Изд-во стандартов. 1978. 264с.
[13]Сычев В.В., Вассерман А.А., Козлов А.Д., Спиридонов Г.А., Цымарный В.А. Термодинамические свойства азота. M.: Изд-во стандартов. 1977. 352 с.
[14]Быстров П.И., Каган Д.Н., Кречетова Г.А. и Шпильрайн Э.Э. Жидкометаллические теплоносители тепловых труб и энергетических установок. М.: Наука. 1988. 263 с.
[15]Теплофизические свойства фреонов. Т. 2. Фреоны метанового ряда. Алтунин В.В., Геллер В.З., Кремневская Е.А. и Перельштейн И.И. М.: Изд-во Стандартов.
1984. 243с.
[16]Ликальтер А.А. Критические точки конденсации в кулоновских системах. УФН. 2000. Т.170. №8. С.831-854.
[17]Rosenfeld Y. Prediction the liquid-vapor critical point from the crystal anharmonicity. Phys.Rev.Lett. 2000. Vol.84. No.19. P.4272-4275.
[18]Jungst S., Knuth B., Hensel F. Observation of singular diameters in the coexistence curves of metals. Phys.Rev.Lett. 1985. Vol.55. No.20б. P.2160-2163.
© Химия и компьютерное моделирование. Бутлеровские сообщения. 2002. №. 9. ______________ E-mail: info@kstu.ru _____________________ 137
