
fizika / Физика билеты на экзамены / б (52) / 52
.docx52..Модель атома. Постулаты Бора. Метод квантования.
Модели атомов
-
Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов[2].
-
Модель атома Томсона (модель «Пудинг с изюмом», англ. Plum pudding model). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
-
Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
-
Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов (формула Бальмера-Ридберга) и квантового характера испускания и поглощения света. Бор исходил из планетарной модели атома Резерфорда.
Постулаты
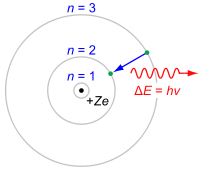
![]()
Модель атома Бора
-
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
-
Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам, для которых момент импульса квантуется:
 ,
где
,
где
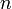 —
натуральные
числа, а
—
натуральные
числа, а
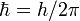 —
постоянная
Планка. Пребывание электрона на
орбите определяет энергию этих
стационарных
состояний.
—
постоянная
Планка. Пребывание электрона на
орбите определяет энергию этих
стационарных
состояний. -
При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии
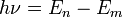 ,
где
,
где
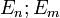 —
энергетические
уровни, между которыми осуществляется
переход. При переходе с верхнего уровня
на нижний энергия излучается, при
переходе с нижнего на верхний —
поглощается.
—
энергетические
уровни, между которыми осуществляется
переход. При переходе с верхнего уровня
на нижний энергия излучается, при
переходе с нижнего на верхний —
поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда.
Уровни энергии
Для получения энергетических уровней в атоме водорода, в рамках модели Бора, записывается второй закон Ньютона для движения электрона по круговой орбите в поле кулоновской силы притяжения:
![]()
где m — масса электрона, e — его заряд, Z — заряд ядра и k- кулоновская константа, зависящая от выбора системы единиц. Это соотношение позволяет выразить скорость электрона через радиус его орбиты:
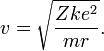
Энергия электрона равна сумме кинетической энергии движения и его потенциальной энергии:
![]()
Используя правило квантования Бора, можно записать:
![]()
откуда радиус орбиты выражается через квантовое число n. Подстановка радиуса в выражение для энергии даёт:
![]()
Комбинация констант
![]() эВ
эВ
называется постоянной Ридберга.
Квантование (англ. quantization) — в информатике разбиение диапазона значений непрерывной или дискретной величины на конечное число интервалов. Существует также векторное квантование — разбиение пространства возможных значений векторной величины на конечное число областей. Простейшим видом квантования является деление целочисленного значения на натуральное число, называемое коэффициентом квантования.
Не следует путать квантование с дискретизацией (и, соответственно, шаг квантования с частотой дискретизации). При дискретизации изменяющаяся во времени величина (сигнал) замеряется с заданной частотой (частотой дискретизации), таким образом, дискретизация разбивает сигнал по временной составляющей (на графике — по горизонтали). Квантование же приводит сигнал к заданным значениям, то есть, разбивает по уровню сигнала (на графике — по вертикали). Сигнал, к которому применены дискретизация и квантование, называется цифровым.
Квантование часто используется при обработке сигналов, в том числе при сжатии звука и изображений.
При оцифровке сигнала уровень квантования называют также глубиной дискретизации или битностью. Глубина дискретизации измеряется в битах и обозначает количество бит, выражающих амплитуду сигнала. Чем больше глубина дискретизации, тем точнее цифровой сигнал соответствует аналоговому. В случае однородного квантования глубину дискретизации называют также динамическим диапазоном и измеряют в децибелах (1 бит ≈ 6 дБ).
