
- •I. Общая химия
- •II. Химия неорганических соединений, биологическая роль, применение в ветеринарии
- •6. Кислородсодержащие кислоты галогенов. Изменение их силы и окислительной способности. Соли кислородсодержащих кислот. Применение.
- •Медицинское применение
- •Соединения железа (II)
- •Соединения железа (III)
- •Соединения железа (VI)
- •Соединения железа VII и VIII
ОТВЕТЫ НА ВОПРОСЫ К ЭКЗАМЕНУ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
I. Общая химия
1. Эквивалент. Эквивалентная масса. Эквивалентный объём (привести примеры). Закон эквивалентов.
Эквивалент – (Д.А. Князев) это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному катиону водорода или в данной окислительно-восстановительной реакции одному электрону.
Эквивалент – (А.Н. Барышев) это масса равная 1/12 массы атома углерода или 1/2 массы атома водорода.
(!)– это такое его количество, которое присоединяет 1 моль атомов водорода или полмоля атомов кислорода
Эквивалент вещества – (П.М. Саргаев) это условная частица, в целое число раз меньшая (или равная), чем соответствующая ей структурная (или формульная) единица вещества (атом, молекула, ион), участвующая в конкретной реакции.
Эквивалент элемента – (Г.Ц. Хомченко) это такое его количество, которое присоединяет или замещает 1 моль атомов водорода.
Эквивалентная масса – масса одного эквивалента, которая выражается в г/моль
А
Ээ = ––––
В
Ээ – эквивалентная масса
А – атомная масса элемента
В – валентность элементов
Э(О) = 16/2 = 8 г/моль
У элементов с постоянной валентностью эквивалентная масса постоянна.
Эквивалентный объём показывает, какой объем (н.у.) заполняет один эквивалент вещества (используется, если вещество находится в газообразном или жидком состоянии)
Vм * Э
Vэ = –––––––
M
Примеры:
22,4 л/моль * 1
1) Vэ (Н2) = ––––––––––––– = 11,2 литра Э(Н) = 1/1 = 1 г/моль
2 М (Н2) = 1*2 = 2 г/моль
22,4 л/моль * 8
2) Vэ (О2) = –––––––––––– = 5,6 литра Э(О) = 16/2 = 8 г/моль
32 М (О2) = 16*2 = 32 г/моль
Закон эквивалентов:
(!) Все вещества реагируют в эквивалентном соотношении. Вещества зависят от параметров окружающей среды (температура, давление, плотность, концентрация). Эквиваленты являются независимыми от данных параметров.
Массы реагирующих веществ относятся между собой как молярные массы эквивалентов
m1 Э1
–– = –––
m2 Э2
Данный закон действует только для масс!
2. Примеры расчёта эквивалента элемента, оксида, основания, кислоты, соли, окислителя, восстановителя.
1. Элемент
А Ээ – эквивалентная масса
Ээ = ––– А – атомная масса элемента
В В – валентность элементов
Э(О) = 16/2 = 8 г/моль
Э(К) = 39/1 = 39 г/моль
2. Оксид
Эокс = Ээ + Эо
Эокс = Ээ + 8
а. Al2O3
Ээл = 27/3 = 9 г/моль
Эокс = 9 + 8 = 17 г/моль
б. SO3
Ээ = 32/6 = 5,33 г/моль
Эокс = 5,33 + 8 = 13, 33 г/моль
3. Основание
Мосн
Эосн = –––––––––––––––––––
ЧислоЗамещенныхОН
а. NaOH
М(NaOH) = 23 + 16 + 1 = 40 г/моль
Э(NaOH) = 40/1 = 40 г/моль
б. Ba(OH)2
М(Ba(OH)2) = 137 + 16 + 1 = 154 г/моль
Э(Ba(OH)2) = 154/2 = 77 г/моль
4. Кислота
Мкис
Экис = –––––––––––––––––––––––––––––––––
ЧислоЗамещенныхКатионовВодорода
а. H2SO4
М(H2SO4) = 1*2 + 32 + 16*4 = 98 г/моль
Э(H2SO4) = 98/2 = 49 г/моль
б. HI
М(HI) = 1 + 127 = 128 г/моль
Э(HI) = 128/1 = 128 г/моль
5. Соль
Мсоли n – количество атомов металла
Эсоли = –––––– B – валентность атомов металла
n * B
а. СuSO4
М(СuSO4) = 63,5 + 32 + 16*4 = 159,5
159,5
Э(СuSO4) = –––––– = 79,75 (≈80)
1 * 2
6. Окислитель
Мox z – число принятых электронов одной молекулой окислителя
Эox = –––––
z
7. Восстановитель
Мred z – число отданных электронов одной молекулой восстановителя
Эred = –––––
z
Пример: найти эквивалентную массу препарата КМnО4, если взаимодействию с восстановителем в кислой среде соответствует полуреакция
МnO4– + 8H+ +5е– → Мn2+ +4H2О
В одной молекуле КМnО4 содержится один ион МnО4–, который принимает 5 электронов, поэтому по формуле эквивалентной массы окислителя эквивалентная масса препарата КМnО4 равна частному от деления молярной массы КМnО4 на 5
Эох = Мох/z = 158/5 = 31,6 г/моль
3. Основные термодинамические характеристики. 1-й, 2-й и 3-й законы химической термодинамики.
Основные термодинамические характеристики
1. Предмет химической термодинамики
- Термодинамика изучает в основном конечные (равновесные) состояния
- Энергетические процессы, протекающие в живом организме, изучает биохимическая термодинамика. Совокупность превращений веществ и энергии в организме называется метаболизмом.
2. Термодинамические системы
- гомогенные (все вещества находятся в одинаковом агрегатном состоянии)
- гетерогенные (состоит из 2х или более областей (фаз))
- открытые (могут изменяться как масса, так и энергия)
- закрытые (масса постоянна, энергия может изменяться)
- изолированные (не обменивается с окружающим пространством ни энергией, ни массой)
3. Термодинамические параметры
- К основным параметрам состояния, которые можно непосредственно измерить, относятся температура, давление, плотность, молярный (удельный) объем, концентрация.
- Такие параметры, как внутренняя энергия, энтальпия (это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении), энтропия и др, рассматриваются как функция основных свойств.
- экстенсивные (параметры, которые зависят от массы или объема вещества (например: внутренняя энергия, энтальпия, энтропия и др))
- интенсивные (параметры, которые не зависят от массы или объема вещества (например: температура, давление, плотность, молярный (удельный) объем, концентрация и др молярные или удельные величины)
4. Термодинамические процессы:
- обратимые (после совершения которого система и окружающая среда могут возвратиться в начальное состояние)
- необратимые (при протекании которого в прямом и обратном направлении в окружающей среде или в самой системе остаются какие-либо изменения)
- равновесные (в котором система проходит через последовательный ряд равновесных состояний)
- неравновесные
- изотермические (протекающие при
постоянной температуре)
изотермические (протекающие при
постоянной температуре)
- изобарные (при постоянном давлении) const
- изохорные (при постоянном объеме)
Первый закон химической термодинамики
Количество теплоты переданное системе, идет на изменение внутренней энергии системы и на совершаемую системой работу против внешних сил
Q – теплота
Q = ∆U + W ∆U – внутренняя энергия системы
W – работа
Первый закон термодинамики является экспериментальным, представляет собой частный случай закона сохранения и превращения энергии в применении к процессам, протекающим с выделением, поглощением или преобразованием теплоты.
Второй закон химической термодинамики
Энтропия (термодинамический параметр) – это функция S, полный дифференциал которой равен отношению элементарного количества теплоты равновесного процесса к абсолютной температуре:
dS = σQ/T σQ – теплота равновесного процесса
Т – абсолютная температура
Энтропия измеряется в Дж/К, а в расчете на 1 моль
В равновесных адиабатических процессах энтропия системы не изменяется, σQ = 0; dS = σQ/T = 0; S = соnst. Такие процессы называются изоэнтропийными
В равновесных изотермических процессах изменение энтропии системы ∆S равно отношению теплоты процесса Q к температуре Т:
∆S = Q/T
Невозможен процесс, единственный результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому.
С использованием понятия энтропии изолированной системы второй закон термодинамики наиболее просто формулируется так:
∆S ≥ 0 (неравенство Клаузиуса)
Энтропия S пропорциональна натуральному логарифму термодинамической вероятности состояния Р системы
S = k * lnP + const k – постоянная Больцмана, k = R/NA = 1,381*10-23 Дж/К
R – универсальная газовая постоянная
NA – число Авогадро
Третий закон химической термодинамики
В конденсированных системах при абсолютном нуле и вблизи него процесс протекает без изменения энтропии.
4. Энергия Гиббса. Направленность протекания самопроизвольных химических процессов.
Для изобарных процессов (р = const) соотношение имеет вид
σW’ ≤ –d (H – T * S) – S * dT
σW’ ≤ –dG – S * dT
σW’ = σW – p * dV – элементарная работа изобарного процесса
G = (H – T * S) – энергия Гиббса, свободная энергия (Гиббса) или изобарно-изотемический потенциал.
Работа изобарно-изотермического процесса связана с изменением энергии Гиббса соотношением
σW’ ≤ –dG; W’ ≤ –∆G; W’ ≤ – (G2 – G1)
Максимальная работа изобарно-изометрического процесса равна убыли свободной энергии системы.
Систему можно вывести из состояния равновесия, если каким-то образом ей становится доступна свободная энергия. Такого рода использование свободной энергии представляет собой выполнение работы.
5. Термохимический закон Гесса. Тепловой эффект реакции.
1840 год
Закон Гесса:
Тепловой эффект химической реакции не зависит от пути реакции, а зависит только от вида и начального и конечного состояния веществ.
Из закона Гесса следует, что изменение энтальпии системы в химической реакции ∆H равно разности между суммарным значением энтальпии продуктов реакции ∆Н2 и суммарным значением энтальпии исходных веществ ∆Н1
∆Н = ∆Н2 - ∆Н1
При расчетах суммарных значений энтальпии учитываются стехиометрические коэффициенты. Так, для реакции, протекающей в изобарно-изотермических условиях
аА + bВ → сС +dD
изменение энтальпии системы вычисляется по уравнению:
∆Н = ( с * ∆Нс + d * ∆НD ) – (a * ∆НA + b * ∆НB)
6. Скорость химической реакции. Закон действия масс (кинетический).
Скорость химической реакции – это изменение концентрации исходного или образовавшегося в реакции вещества за единицу времени.
Скорость реакции (определяют по изменению концентрации одного из исходных веществ):
- средняя (равна -∆С/∆t)
- мгновенная (равна –dC/dt)
Зависимость скорости химической реакции от концентрации реагирующих веществ выражает закон действия масс, являющийся основным законом химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для гомогенной реакции
А + В ↔ С + D
математическое выражение закона действия масс имеет вид:
v = k * [A] * [B]
Для гомогенной реакции, записанной в более общей форме
аА + bB ↔ cC + dD
математическое выражение основного закона химической кинетики содержит стехиометрические коэффициенты (а и b)
v = k * [A]а * [B]b – Формулу иногда называют основным постулатом химической кинетики
Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости реакции k численно равна скорости химической реакции при единичных концентрациях реагирующих веществ.
7. Зависимость скорости химической реакции от температуры. Температурный коэффициент. Закон Вант-Гоффа. Теория активации.
При повышении температуры на каждые 10º К скорость химической реакции увеличивается от 2х до 4х раз
Закон Вант-Гоффа:
νT2 = (νT1) * y(T2-T1)/10
y – температурный коэффициент скорости реакции
Смысл энергии активации и причины зависимости скорости химической реакции от температуры объясняют теория активных столкновения реагирующих частиц и теория активированного комплекса
Согласно теорииактивных столкновений с повышением температуры увеличивается число столкновений активных (возбужденных молекул). Активные молекулы обладают избыточной энергией, необходимой и достаточной для того, чтобы их столкновение привело к химической реакции. Это и есть энергия активации.
8. Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы.
Эффективный способ повышения скорости реакции основан на применении катализаторов.
Катализаторами называются вещества, которые увеличивают скорость химической реакции, но сами при этом не изменяются. Катализом называется процесс ускорения реакции с помощью катализаторов. Вещества, замедляющие реакцию, называются ингибиторами, а процесс замедления реакции – ингибированием.
Механизмы действия катализатора весьма многообразны. Катализаторы могут образовывать промежуточные продукты с реагентами, а по окончании всех стадий реакции такие катализаторы полностью возвращаются в исходную форму.
Так в гомогенной реакции
А + В → АВ
могут протекать следующие стадии с участием катализатора K:
1) А+К → АК
2) АК + В → АВ + К
Большинство биохимических превращений в организме животного являются каталитическими (ферментативными). По химической природе ферменты являются белками. Два фундаментальных свойства присущи биологическим катализаторам – специфичность катализа и способность ускорять реакцию.
9. Химическое равновесие с точки зрения термодинамики. Константа равновесия.
Состояние реагирующих веществ, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химические реакции могут быть обратимыми и необратимыми.
Величина K, равная отношению констант скоростей прямой k1 и обратимой k2 реакции, называется константой равновесия химической реакции:
K = k1/k2
10. Смещение химического равновесия. Принцип Jle Шателье.
Смещение равновесия подчиняется принципу Jle Шателье.
Если на химическую систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в направлении, уменьшающем оказанное воздействие.
Внешние факторы:
- температура (при повышении химическое равновесие смещается в направление эндотермической реакции, при понижении – экзотермической реакции)
- давление (повышение сдвигает равновесие в сторону образования веществ, обладающих меньшим объемом)
- концентрация (при увеличении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции, а при увеличении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ)
11. Агрегатные состояния. Растворы: Понятие, теория. Растворы насыщенные, ненасыщенные, пересыщенные.
Состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями объема и физических свойств вещества, называются агрегатными.
Агрегатные состояния вещества – состояния одного и того же вещества в различных интервалах температур и давлений.
Вещества могут существовать в:
- твердом
- жидком
- газообразном
- иногда еще в плазменном состояниях.
Растворами называются многокомпонентные гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Растворы могут быть:
- твердыми
- жидкими
- газовыми
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ.
По содержанию растворенного вещества раствор разделяют на:
- насыщенный – раствор, находящийся в динамическом равновесии с избытком растворяемого твердого вещества
- ненасыщенный – раствор, содержание растворенного вещества в котором ниже растворимости этого вещества при данных условиях. Такие растворы стабильнее насыщенных, могут иметь различные концентрации, меньшие, чем растворимость.
- пересыщенный – раствор, в котором концентрация растворенного вещества выше, чем концентрация данного вещества в насыщенном растворе при тех же условиях
12. Способы выражения концентрации растворов.
Концентрацией называют отношение количества растворенного вещества или его массы к объему раствора
Соответственно концентрацию выражают в моль/л – молярная концентрация или в г/л – массовая концентрация
Наиболее употребимы следующие способы выражения состава растворов:
1. Молярная концентрация (выражают в моль/л)
м(В)
с(В) = ––––––– 1000
М(В) V
м (В) – масса растворенного вещества В, г
М (В) – молярная масса вещества В, г/моль
V – объем раствора, мл
1000 – коэффициент перевода миллилитров в литры
2. Молярная концентрация эквивалента – отношение количества вещества эквивалента (в молях), содержащегося в растворе, к объему этого раствора.
3. Моляльная концентрация (выражается в г/мл) – отношение количества растворенного вещества В (в молях) к массе м (в кг) растворителя Y,
m(B)
b(B) = –––––––––
M(B) m(Y)
13. Осмос. Закон Вант-Гоффа. Роль осмоса в биологических явлениях.
Процесс односторонней диффузии (самопроизвольный переход вещества) растворителя в раствор называется осмосом. Результатом осмоса является выравнивание концентрации растворенного вещества.
Противодавление, которое препятствует диффузии растворителя через полупроницаемую перегородку в раствор, называется осмотическим давлением.
Для разбавленных растворов неэлектролитов зависимость осмотического давления от его молярной концентрации выражается уравнением Вант-Гоффа:
росм = CМ * R * T
CМ – концентрация неэлектролита
T – температура, К
R = 8,31 Дж/(моль*К) – газовая постоянная
Явление осмоса широко распространено в живой природе. Стенки растительных клеток и клеток живых организмов представляются собой полупроницаемые мембраны, через которые свободно проходят молекулы воды в клетки (и другие структуры) и почти полностью задерживаются вещества, растворенные в клеточном соке. Поэтом осмос является причиной сжатия клеток и тургора – напряженного состояния клеток, тканей и органов вследствие давления содержимого клеток на их эластичные оболочки и обратного давления оболочек на содержимое. Давление тургора у животных достигает 50-100 кПа, у растений – в 10 раз больше.
Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного - гипотоническим.
14. Давление пара растворителя над раствором. Закон Рауля.
Известно, что если стакан с водой не закрыть, то вся вода постепенно испариться. Если стакан закрыт крышкой, то над поверхностью воды образуется насыщенный пар. Его давление – это давление насыщенного пара над чистым растворителем p0
1883г
Закон Рауля:
При постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества N
(p0 – p)/p0 = N
Растворы, для которых выполняется закон Рауля, называются идеальными.
15. Кипение и замерзание растворов.
Присутствие растворëнного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется из раствора (при замерзании) или выкипает (при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это в свою очередь приводит к ещë большему повышению температуры кипения и снижению температуры кристаллизации. Таким образом, раствор кристаллизуется и кипит не при определëнной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения.
Разность между температурами кипения раствора (tк) и чистого растворителя (tок) называют повышением температуры кипения раствора (Δtк). Разность между температурами замерзания чистого растворителя (tОЗ) раствора (tЗ) называют понижением температуры замерзания раствора (ΔtЗ).
Растворы кипят при более высоких температурах, чем растворитель, а замерзают при более низкой.
Δtк = tк – tок; ΔtЗ = tОЗ – tЗ.
Растворы кипят при более высоких температурах, чем растворитель, а замерзают при более низкой.
Δtк=tкр-tк=Е*Сm Е-эбулиоскопическая постоянная р-ля
Δtз=tз-tзр=Кз*Сm К-криоскопическая постоянная р-ля
16. Отклонение поведения растворов электролитов от неэлектролитов . Изотонический коэффициент.
Изотонический коэффициент (фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы
Смысл параметра ясен из определения каждого из коллигативных параметров: они зависят от концентрации в растворе частиц растворённого вещества. Неэлектролиты в растворе не диссоциируют, стало быть, каждая молекула неэлектролита образует в растворе лишь одну частицу.
17-18.Диссоциация слабых электролитов – обратимый процесс.
Константа диссоциации – константа равновесия по отношению к процессу электролитической диссоциации
Связь константы диссоциации и степени диссоциации
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A−] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степени диссоциацииэлектролита.
Тогда:
|
|
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
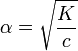
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает.
17. Слабые электролиты. Степень диссоциации. Константа диссоциации.
Слабые электролиты - электролиты, степень электролитической диссоциации которых в растворах значительно меньше единицы и сильно меняется с изменением концентрации раствора.
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д.
Степень диссоциации — это отношение числа молекул, распавшихся на ионы, к общему числу растворившихся молекул.
18.Зависимость степени диссоциации слабого электролита от концентрации раствора. Закон разбавления Оствальда.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
З![]() акон
разбавления Оствальда —
соотношение, выражающее зависимость
эквивалентной электропроводности
разбавленного раствора бинарного
слабого электролита от концентрации
раствора:
акон
разбавления Оствальда —
соотношение, выражающее зависимость
эквивалентной электропроводности
разбавленного раствора бинарного
слабого электролита от концентрации
раствора:
З![]() десь
К — константа диссоциации электролита,
с — концентрация, λ и λ∞ —
значения эквивалентной электропроводности
соответственно при концентрации с и
при бесконечном разбавлении. Соотношение
является следствием закона действующих
масс и равенства
десь
К — константа диссоциации электролита,
с — концентрация, λ и λ∞ —
значения эквивалентной электропроводности
соответственно при концентрации с и
при бесконечном разбавлении. Соотношение
является следствием закона действующих
масс и равенства
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
19. Равновесие в растворах слабых электролитов. Влияние одноимённого и связывающего ионов.
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации - ионами.
Влияние посторонних веществ на степень диссоциации слабого электролита зависит от природы вводимых ионов. Здесь можно выделить 2 случая: присутствие либо одноименных, либо связывающих ионов.
Изменение концентрации одного из ионов, образующегося при диссоциации данного слабого электролита, согласно принципу Ле Шателье смещает положение равновесия. Если в систему вводятся одноименные ионы, то есть увеличивается концентрация одного из образующихся при диссоциации ионов, то равновесие смещается в сторону недиссоциированных молекул этого электролита. Степень диссоциации слабого электролита уменьшается.
Если в раствор слабого электролита вводятся связывающие ионы, то происходит связывание одного из продуктов диссоциации слабого электролита, что приводит к смещению равновесия диссоциации этого вещества в сторону ионной формы. Степень диссоциации слабого электролита увеличивается.
20.Амфотерные гидроксиды с точки зрения теории электролитической диссоциации.
Амфотерные электролиты могут находиться в осадке и в растворе в виде молекул и диссоциировать по типу кислоты и основания. Например, слабыми электролитом является гидроксид цинка. Его диссоциацию можно представить в виде схемы:
Zn(OH)2 (осадок)
↕
2H+ + ZnO22- ↔ H2ZnO2 ↔ (раствор) Zn(OH)2 ↔ Zn2+ + OH-
Добавление кислоты или целочи вызывает растворения осадка, так как и в том, и в другом случае связываются ионы ОН- или Н+, что приводит к образованию слабого электролита Н2О
В первом случае равновесие диссоциации смещается в сторону ионной формы основания (вправо), во втором – в сторону ионной формы кислоты (вправо)
21.Сильные электролиты. Активная концентрация. Ионная сила раствора.
1)Электролиты – это вещества, растворы и расплавы которых проводят электрический ток. Сильные электролиты - это вещества, которые при растворении практически полностью диссоциируют на ионы. К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ва(ОН)2). И.А Каблуков установил причины полной диссоциации сильных электролитов в растворах: в водных растворах сильные электролиты полностью диссоциируют за счет ион-дипольного взаимодействия с молекулами воды. Продукты взаимодействия - гидратированные ионы.
2) Активная концентрация - концентрация свободных гидратированных ионов в растворе.
3)Ионная сила раствора равна полусумме произведений молярных концентраций всех присутствующих ионов на квадраты их зарядов:
μ= 1/2(c1z1² + c2z2² + ... + cnzn²) = 1/2 Σсizi²
Этот параметр нужен для определения коэффициента активности иона. С увеличением ионной силы раствора коэффициент активности уменьшается.
Сильные электролиты – это электролиты, которые в водных растворах диссоциируют практически полностью. Истинная степень их диссоциации близка к 100%, однако экспериментально наблюдаемая находится в пределах от 30% и выше.
22.Диссоциация воды. Ионное произведение воды. Водородный показатель рH.
Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации.
1)Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Вода является слабым электролитом, в малой степени диссоциирует на ионы: Н2О ↔ H+ + OH-
2)Ионное произведение воды, произведение концентраций (точнее активностей) ионов водорода Н+ и ионов гидроксила OH- в воде или в водных растворах: Kв = [Н+] [ОН-], где Kв - постоянная величина, называемая ионное произведение воды.
3) Водородный показатель рH - величина, характеризующая концентрацию ионов водорода; равна отрицательному десятичному логарифму концентрации ионов водорода. В нейтральной среде Ph = 7, в кислых средах < 7, в щелочных >7.
- это функция отрицательного десятичного логарифма концентрации катионов водорода рH = - lg[H+] или [H+] = 10-pH, где [H+] - концентрация ионов водорода, моль/л. Вспомогательные формулы: [H+] = 10-14/ [OH-] . рH может быть выражен через ионное произведение воды: Kw = [H+][OH-] = 10-14 ; рH может быть выражен: [Н+] = См α n[H-] где См - молярная концентрация, α - кажущаяся степень диссоциации, n - количество катионов водорода в кислоте. [OH-] = См α n[ОH-]
23.Гидролиз солей. Роль в живом организме.
1) Гидролиз соли – взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Гидролиз соли на примере ацетата натрия - сильный электролит, при растворении в воде полностью диссоциирует на ионы Na+ и CH3COO- . Суммарное ур-е протекающих процессов имеет вид: CH3COO- + Н2О ↔ CH3COOH + OH- . Cуществует константа гидролиза Кг , равная Кг =Кв/Кк где Kв - постоянная величина, называемая ионное произведение воды, Кк - константа диссоциации слабой кислоты, образованной в результате гидролиза соли.
2) Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием; в) слабым основанием и слабой кислотой.
3) Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ и выделяется при ее гидролизе.
Процесс ферментативного гидролиза играют важную роль в пищеварении и тканевом обмена веществ всех живых организмов, играет важную роль в регуляции кислотной среды и в поддержании в организме кислотно-щелочного равновесия.
24.Современная модель состояния электрона в атоме. Квантовые числа. Принцип Паули.
Атом с более чем одним электроном представляет собой сложную систему взаимодействующих друг с другом электронов, движущихся в поле ядра.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
1) С точки зрения квантовой или волновой механики, электрон - это такое образование, которое ведёт себя и как частица, и как волна, т.е. он обладает корпускулярно-волновым дуализмом (двойственностью). Т.о. электроны могут производить давление, а движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов. Представим корпускулярно-волновой дуализм как частицу и выразим через ур-е Луи де Бройля: λ = h/mv , где λ - длина волны, h - постоянная Планка(6,63х10 в степени -34, Дж с), m - масса, v - скорость микрочастицы.
Электрон находится в пространстве рядом с ядром, но т.к. он постоянно в движении можно рассматривать лишь совокупность его расположений - т.е. электронное облако, т.о. эл. облако - это квантово-механическая модель движения электрона в атоме. Плотность эл. облака неравномерна - часть атомного пространства, где электрон пребывает больше всего, плотней.
Электроны распределяются по энергетическим уровням (слоям/оболочкам).
2) Квантовые числа определяют состояние электрона в атоме, точнее - на каком энергетическом уровне электрон находится.
Главное квантовое число (n) - характеризует энергию электрона и размеры электронного облака. Принимает значения целых чисел от 1 до 7 соответственно номеру периода, в котором находится элемент.
Орбитальное (побочное или азимутальное) квантовое число(l) - характеризует энергетическое состояние электрона в подуровне и форму облака. Принимает значения на единицу меньше, чем n.
Магнитное квантовое число(m) - характеризует орбитали в пространстве и связано с числом l. m = 2l + 1
Спиновое квантовое число (s) - характеризует собственное вращение электрона вокруг своей оси. Это вращение называется спин и принимает только два значения +1/2, -1/2.
3) По принципц Паули на одной орбитали может находится 2 электрона с противоположными спинами: на s-подуровне = 2 электрона, на p-подуровне = 6 эл., на d-подуровне = 10, на f-подуровне = 14. Число электронов на подуровне определяется уравнением Nl = 2(2l + 1).
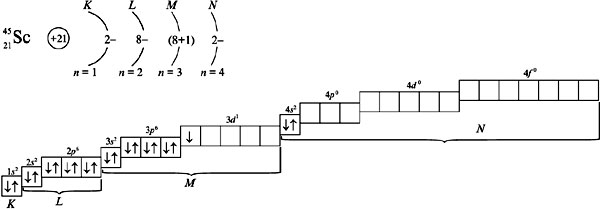
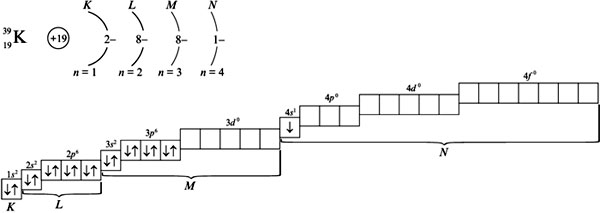
25.Распределение электронов в атоме. Правило Хунда.
Распределение электронов в атоме по уровням и подуровням(орбиталям) изображаются в виде электронных формул. Орбиталь с минимальной энергией - это 1s-орбиталь. Её занимает единственный электрон атома водорода, поэтому электронная формула атома водорода записывается 1s1. У гелия эл. формула 1s² . Т.к. на s-подуровне могут быть только 2 электрона, то эл.формулы последующих элементов записываются уже с заполнением последующих подуровней после s-подуровня, например бериллий 1s²2s², неон 1s²2s²2p6.
Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимальным.
графический пример заполнения эл.орбиталей:
26.Периодический закон с точки зрения строения атома. Причины периодичности.
Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов.
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона. В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
27. s,p,d,f-элементы, положение в периодической системе. Основные химические свойства.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства): 1) s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. 2) р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого). 3) d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами). 4) f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды. В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
Свойства:
энергия ионизации атомов;
энергия сродства атомов к электрону;
электроотрицательность;
атомные(иионные) радиусы;
энергия атомизациипростых веществ
степени окисления;
окислительные потенциалыпростых веществ.
28. Природа химической связи. Метод валентных связей.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга (два или несколько атомов, ионов, молекул или любую комбинацию из них). Каждая химическая связь в структурных формулах представляется валентной чертой, например: H−H (связь между двумя атомами водорода), H3N−H+ (связь между атомом азота молекулы аммиака и катионом водорода),(K+)−(I−) (связь между катионом калия и иодид-ионом).
Химическая связь образуется за счет притяжения ядер атомов к паре электронов (обозначаются точками ··), которую в электронных формулах сложных частиц (молекул, сложных ионов) изображают валентной чертой −, в отличие от собственных, неподеленных пар электронов каждого атома, например:
:::F−F::: (F2); H−Cl::: (HCl);
..
H−N−H
|
H (NH3)
Атомы, образуя связи, приближаются к достижению наиболее устойчивой (т.е. имеющей наиболее низкую энергию) электронной конфигурации. Атомы могут достичь этого двумя способами:
Ковалентной химической связью (образуется путем обобществления пары электронов обоими атомами); Ионной связью (если атомы теряют либо приобретают электроны, образуя ионы); Металлическая связь (относится к металлам, в твердом состоянии металлы состоят из положительно заряженных ионов, плотно упакованных в кристаллическую решетку и удерживаемых вместе свободными электронами, которые «плавают» вокруг ионов в «электронном море»); Водородная связь (существенное участие принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом)
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения: 1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. 2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
29. Обменный и донорно-акцепторный механизмы образования ковалентной связи.
Обменный
за счёт перекрывания одноэлектронных
облаков с противоположными спинами;
донорно-акцепторный
за счет двухэлектронного облака одного
атома и свободной орбитали другого.
Обменный механизм - это когда каждый
из взаимодействующих атомов поставляет
по одному электрону, донорно-акцепторный
механизм - это когда электронная пара
передается в общее пользование одним
атомом (донором) другому атому (акцептору).

К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов.
По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны.
30. Ковалентная связь. Её разновидности и свойства.
Ковалентная связь – химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
Виды:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
1)Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, то такая связь называется неполярной ковалентной связью.
2) Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера).
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
31.Валентность атомов в стационарном и возбуждённом состояниях. Кратность связи. сигма и пи связь.
Валентность характеризует способность атомов элементов к образованию соединений. Валентность определяется как число химических связей, которыми атом соединен с другими. Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента. У Атома в возбуженном состояии электроны перескакивают на другие свободные орбитали и он проявляет валентность равную числу неспаренных электронов.Например, в стационарном состоянии атом углерода проявляет валентность равную 2(имеет 2 неспаренных электрона), а в возбужденном равную 4.(имеет 4 неспаренных электрона).В стационарном состоянии 2s(2)2p(2) ---->2s(1)2p(3).
Химическая связь, осуществляемая более чем одной электронной парой, называется кратной связью. Кратность (порядок) связи — это число общих электронных пар, участвующих в образовании связи. Кратная связь может быть двойной, тройной, иметь более высокую кратность и даже дробную кратность. Кратная связь состоит из одной s-связи, p-связи и иногда d-связи. Сигма- и пи-связи (s- и p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности.
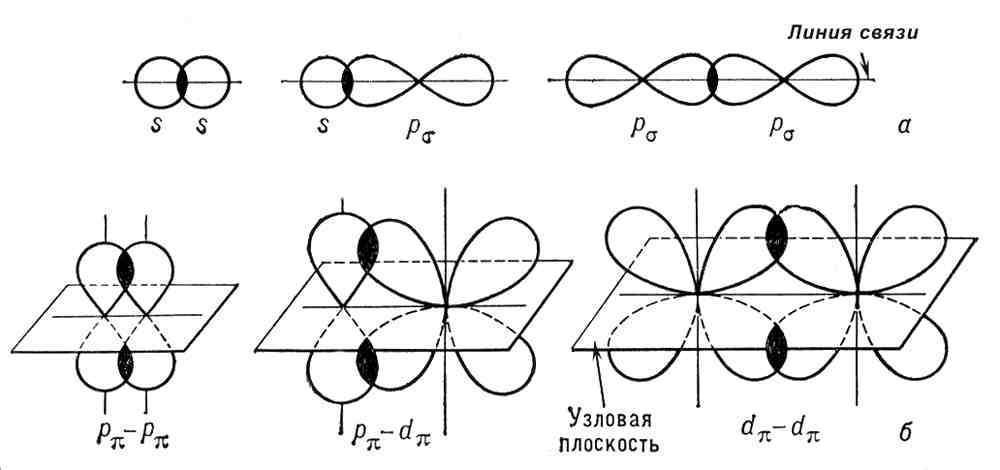
32.Гибридизация атомных орбиталей. Примеры. Пространственная конфигурация молекул с sp, sp², sp3- гибридизацией (примеры).
Гибридизация - это выравнивание атомных орбиталей по энергии с последующим их смешиванием. ΣАО = Σгибр.орб., например s + 3p + d = 5sp3d , s + 3d = 4sd3
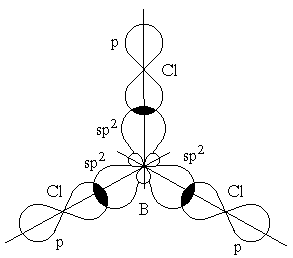
Очень часто электроны, участвующие в образовании ковалентной связи, находятся в различных состояниях, например, один в s-, другой в p-орбиталях. Но связи в молекуле по прочности остаются равнозначны. Это объясняет представление о гибридизации атомных орбиталей, введенное в химию Л.Полингом. Гибридизацию валентных орбиталей рассмотрим на примере образования молекул хлорида бериллия BeCl2 хлорида бора BeCl3 и метана CH4.
В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
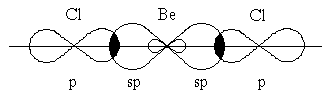
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. Другой пример: в молекуле BCl3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :
 Еще
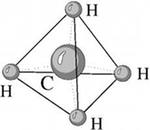
один пример: в молекуле CH4 имеется 4 связи
C—H. Все эти 4 связи расположатся
максимально далеко друг от друга только
тогда, когда молекула примет форму
тетраэдра, у которого в центре находится
атом C, а в вершинах - атомы H. Кстати, в
"квадратной" молекуле расстояние
между атомами водорода было бы меньше,
поэтому реальная молекула CH4 имеет форму
тетраэдра:
Еще
один пример: в молекуле CH4 имеется 4 связи
C—H. Все эти 4 связи расположатся
максимально далеко друг от друга только
тогда, когда молекула примет форму
тетраэдра, у которого в центре находится
атом C, а в вершинах - атомы H. Кстати, в
"квадратной" молекуле расстояние
между атомами водорода было бы меньше,
поэтому реальная молекула CH4 имеет форму
тетраэдра:
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’.
 33
33
Геометрическая фигура, состоящая из 1 вершины - точка (.) если 2(.) - отрезок, 3(.) - плоский треугольник, 4 (.) - либо плоский квадрат и его производные, либо тетраэдр или тригональная пирамида (искаженный тетраэдр).
33.Ионная связь. Ненаправленность и ненасыщаемость ионной связи. Свойства веществ с ионным типом связи.
Ионная или электровалентная связь - это химическая связь между ионами, осуществляемая электростатистическим притяжением. способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Ненаправленность характеризуется тем, что каждый ион, представляющий из себя заряженный шарик, может притягивать ион, противоположного знака по любому направлению. Ненасыщаемость определяется тем, что взаимодействие ионов противоположного знака не приводит к компенсации силовых полей и у них остаётся способность притягивать ионы противоположного знака по другим направлениям.
Ионные соединения образуются при взаимодействии элементов, значительно различающихся по химическим свойствам. Чем больше удалены друг от друга элементы в периодической системе, тем в большей степени проявляется в их соединениях ионная связь.
34.Виды межмолекулярного взаимодействия.
Межмолекулярные взаимодействия (м.в.) - взаимодействия молекул между собой, не приводящее к разрыву или образованию новых хим. связей. М. в. определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От М. в. зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия М. в. связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее М.в. (см. Ван-дер-Ваальса уравнение). Поэтому силы М.в. часто называют ван-дер-ваальсовыми. Различают три типа м.в.: ориентационное, индукционное, дисперсионное. При ориентационном взаимодействии происходит сближение полярных молекул, они ориентируются относительно друг друга противоположно заряженными концами диполей. чем более полярны молекулы, тем прочнее связь. с повышением температуры ориентационное взаимодействие ослабляется, т.к. тепловое движение нарушает ориентацию. Индукционное взаимодействие между полярной и неполярной молекулами: первая деформирует эл.облако второй. В результате у неполярной молекулы возникает временный электрический момент диполя, затем обе молекулы взаимодействуют как диполи. Индукционное взаимодействие не зависит от температуры, оно зависит от напряженности электрического поля полярной молекулы. Дисперсионное взаимодействие между двумя неполярными молекулами. В атомах и молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей. Энергия взаимодействия между неполярными молекулами есть средний результат взаимодействия всевозможных мгновенных диполей с дипольными моментами, которые они наводят в соседних молекулах благодаря индукции. На дисперсионном взаимодействии основан процесс сжижения благородных двухатомных элементарных газов.
1).Энергия
электростатического взаимодействия
Vэл-ст
представляет собой энергию кулоновского
взаимодействие, вычисленную в
предположении, что распределение
зарядовой плотности отвечает изолированным
молекулам (R
=
![]() )
)
2).Поляризационное взаимодействие обусловлено деформацией электронной оболочки одной молекулы под влиянием электрический поля другой, что всегда приводит к понижению энергии (притяжению молекул).
3). Энергия обменного взаимодействия молекул Vобм обусловлена тем, что в соответствии с принципом Паули в одном и том же квантовом состоянии не могут находиться два электрона с одинаковыми спинами. Вследствие этого электронная плотность в пространстве между молекулами при перекрывании их электронных оболочек уменьшается.
35.Водородная связь, её биологическая роль.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.
Такая связь возникает между молекулами, в состав которых входят атомы водорода и элементов с высокойэлектроотрицательностью(F,Cl,O2,N)
Внутримолекулярные водородные связи играют важнейшую биологическую роль, так как определяют, например, спиральную структуру полимерных молекул белков.
С помощью межмолекулярных водородных связей соединены цепи нуклеиновых кислот, образующих двойную спираль. Посредством этой связи взаимодействуют спирали ДНК и РНК, белки, формируются мембраны биологических клеток.
36. Комплексные соединения. Теория Вернера. Роль в живом организме.
Комплексные соединения, координационные соединения, химические соединения, состав которых не укладывается в рамки представлений об образовании химических связей за счет неспаренных электронов. Обычно более сложные К. с. образуются при взаимодействии простых химических соединений.
Теория: Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+) либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.
37. Диссоциация комплексных соединений. Константа нестойкости комплексных ионов.
При растворении в воде комплексных соединений, обычно они распадаются на ионы внешней и внутренней сфер подобно cильным электролитам, так как эти ионы связаны ионогенно, в основном, электростатическими силами. Это оценивается как первичная диссоциация комплексных соединений.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью).
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости
38. Химическая связь в комплексных соединениях (примеры).
Во внутренней сфере между комплексообразователем и лигандами формируются полярные ковалентные связи. Частицы внешней сферы удерживаются около комплекса за счет электростатического ионного взаимодействия, т.е. характер связи преимущественно ионный.
Рассмотрим строение комплекса [Ag(NH3)2]+. Электронная конфигурация иона серебра
Свободные орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака.
5s- и 5p- орбитали иона Ag+ образуют две гибридные sp- орбитали, т.е. находятся с состоянии sp L q - гибридизации.
Комплекс имеет линейное строение.
Таким образом, электронное строение и тип гибридизации АО комплексообразователя определяют к.ч. и геометрическую форму комплекса.
39. Окислительно- восстановительные реакции. Виды окислительно- восстановительных реакций.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Виды: 1) Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
2) Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
3) Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
40. Важнейшие окислители и восстановители. Окислительно- восстановительная двойственность.
|
Восстановители |
Окислители |
|
Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. |
Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
Окислительно-восстановительная двойственность – это способность атома, находящегося в промежуточной степени окисления, быть как восстановителем, так и окислителем, в зависимости от того, с каким веществом он реагирует.
41. Стандартные электродные потенциалы. Направление протекания окислительно восстановительных реакций.
Стандартный электродный потенциал-это потенциал электрода при стандартных условиях, его обозначают символом Е°.
Окислительно-восстановительная реакция будет самопроизвольно протекать в таком направлении, при котором полуреакция с более высоким значением окислительно-восстановительного потенциала выступает в качестве окислителя по отношению к полуреакции с более низким потенциалом.
Стандартные электродные потенциалы
|
Уравнение электродного процесса |
Стандартный потенциалЕ при 25С, В |
|
Li+ + eLi |
–3,045 |
|
Rb+ + eRb |
–2,925 |
|
K+ + e K |
–2,924 |
|
Cs+ + e Cs |
–2,923 |
|
Ca+2 + 2e Ca |
–2,866 |
|
Na+ + eNa |
–2,714 |
|
Mg2+ + 2eMg |
–2,363 |
|
Al3+ + 3eAl |
–1,663 |
|
Ti2+ + 2eTi |
–1,630 |
|
Mn2+ + 2eMn |
–1,179 |
|
Zn2+ + 2eZn |
–0,763 |
|
Cr3+ + 3eCr |
–0,744 |
|
Fe2+ + 2eFe |
–0,440 |
|
Cd2+ + 2eCd |
–0,403 |
|
Co2+ + 2eCo |
–0,277 |
|
Ni2+ + 2eNi |
–0,250 |
|
Sn2+ + 2eSn |
–0,136 |
|
Pb2+ + 2ePb |
–0,126 |
|
Fe3+ + 3eFe |
–0,037 |
|
2H+ + 2e H2 |
0,000 |
|
Bi3+ + 3eBi |
0,215 |
|
Cu2+ + 2eCu |
0,337 |
|
Ag+ + eAg |
0,799 |
|
Hg2+ + 2eHg |
0,850 |
|
Pt2+ + 2ePt |
1,188 |
|
Au+ + eAu |
1,692 |
Направление ОВР можно определять по электродвижущей силе реакции(ΔЕ), которая связана с изменением энергии Гиббса реакции ΔG соотношением:
-ΔG=nFΔE
n–число электронов;F – постоянная Фарадея(9,65 * 104 Кл/моль)
