
- •Введение
- •Общие сведения о методах и средствах исследования пищевых продуктов
- •Тема 1. Отбор и подготовка пробЫ к анализу
- •Тема 2. Погрешности анализа, обработка результатов измерений, методы оценки точности методик
- •2.1. Аналитический сигнал. Методы измерения
- •2.2. Погрешности анализа. Представление результатов анализа
- •2.3. Статистическая обработка результатов прямых равноточных наблюдений (определений)
- •2.4. Оценка грубых погрешностей (промахов)
- •Тема 3. Титриметрический анализ
- •3.1. Характеристика титриметрического метода. Кривые титрования
- •3.2. Классификация титриметрических методов анализа
- •3.3. Кислотно-основное титрование
- •3.4. Комплексонометрическое титрование
- •3.5. Окислительно-восстановительное титрование
- •3.6. Осадительное титрование
- •Тема 4. Радиометрический анализ и радиационный контроль
- •Тема 5. Электрохимические методы анализа
- •5.1. Потенциометрический метод анализа
- •5.2. Кондуктометрический метод анализа
- •5.3. Кулонометрический метод анализа
- •5.4. Вольтамперометрический метод анализа
- •Тема 6. Оптические методы исследования
- •6.1. Рефрактометрический анализ
- •6.2. Поляризационный анализ
- •6.3. Нефелометрический и турбидиметрический анализы
- •Тема 7. Спектроскопические методы исследования
- •7.1. Понятие спектроскопии. Типы спектров
- •7.2. Фотометрический метод анализа
- •7.3. Радиоспектроскопия, ядерный магнитный и электронный парамагнитный резонансы
- •7.4. Инфракрасная спектроскопия
- •7.5. Ультрафиолетовая спектроскопия
- •7.6. Лазерная спектроскопия
- •7.7. Масс-спектрометрия
- •7.8. Атомно-абсорбционная спектроскопия
- •7.9. Атомно-эмиссионная спектроскопия
- •7.10. Люминесцентный анализ
- •Тема 8. Рентгеновские методы исследования
- •8.1. Рентгеновская спектроскопия
- •8.2. Рентгеновский структурный анализ
- •8.3. Рентгеновский фазовый анализ
- •Тема 9. Хроматография и родственные методы
- •9.1. Понятие, особенности и классификация хроматографии
- •9.2. Газовая хроматография
- •9.3. Жидкостная хроматография
- •9.4. Ионная хроматография
- •9.5. Капиллярный электрофорез
- •Тема 10. Микроскопические методы исследования
- •10.1. Понятие микроскопии
- •10.2. Световая микроскопия
- •10.3. Электронная микроскопия
- •Тема 11. Физические методы исследования
- •11.1. Термический анализ
- •Отклонение стрелок гальванометров
- •11.2. Методы измерения тепловых и термоэлектрических характеристик
- •11.3. Методы измерения электрофизических характеристик проводящих материалов
- •11.4. Методы измерения диэлектрических свойств
- •11.5. Электрические измерения неэлектрических величин
- •11.6. Измерение магнитных свойств материалов
- •11.7. Электрические и магнитные методы контроля состава и свойств материалов. Устройства и методы неразрушающего контроля
- •Тема 12. Электронные датчики химического состава (Химические сенсоры)
- •12.1. Классификация датчиков
- •12.2. Химические датчики (сенсоры)
- •12.3. Биосенсоры
- •12.4. Оптические химические сенсоры
- •12.5. Интеллектуальные сенсорные системы («электронный нос» и «электронный язык»)
- •Список литературы
- •Содержание
3.5. Окислительно-восстановительное титрование
Окислительно-восстановительным титрованием, или редоксметрией, называют количественное определение веществ титрованием стандартными растворами окислителей или восстановителей.
В основе метода лежит изменение потенциала окислительно-вос- становительной системы при изменении соотношения концентраций окисленной и восстановленной форм в процессе титрования. Титрант может быть как окислителем, так и восстановителем.
Методы титрования стандартными растворами окислителей называют оксидиметрическими, а стандартными растворами восстановителей – редуциметрическими.
Общий вид кривой окислительно-восстановительного титрования представлен на рисунке 3.2.
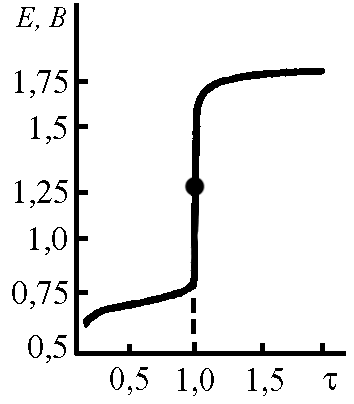

Рисунок 3.2 – Кривая окислительно-восстановительного титрования
Для обнаружения КТТ используют:
·исчезновение или появление окраски титранта или титруемого вещества;
·окислительно-восстановительные и специфические индикаторы;
· инструментальные методы (потенциометрическое титрование и др.).
Специфические индикаторы – это вещества, которые образуют интенсивно окрашенное соединение с одним из компонентов окислительно-восстановительной системы. Например, при титровании йода используют специфический индикатор – крахмал, образующий с ним адсорбционные и комплексные соединения ярко-синего цвета.
Окислительно-восстановительные редокс-индикаторы – это соединения (в основном органические), способные к окислению и восстановлению, причем их окисленная и восстановленная формы имеют разную окраску. В качестве редокс-индикаторов применяют также комплексы органических лигандов с металлами, способными изменять степень окисления.
Так же как и при кислотно-основном титровании интервал перехода окраски индикатора должен лежать внутри скачка титрования. Окислительно-восстановительная реакция с участием индикаторов-комплексов обратима.
К группе редокс-индикаторов относятся также красители, разрушающиеся необратимо при определенном потенциале (например, нейтральный красный, метиловый красный, метиловый оранжевый, которые используются в броматометрии).
Перманганатометрия. Метод перманганатометрии основан на реакциях окисления перманганат-ионами. Рабочим раствором является 0,02–0,01 Н раствор перманганата калия. В кислой среде перманганат-ионы восстанавливаются до Мn2+:
![]()
Нормальный окислительно-восстановительный потенциал пары будет равен:
![]()
и поэтому с увеличением кислотности возрастает его окислительная активность.
При реакции малиновая окраска перманганат-ионов обесцвечивается (ионы Мn2+ бесцветны). Это позволяет проводить титрование перманганатом калия без индикатора.
Перманганатометрические определения проводятся и в нейтральной среде, при этом перманганат-ионы восстанавливаются до Мn+4 (MnO2):
![]()
При этом окраска изменяется от малинового до коричневого цвета (MnO2). Нормальный окислительно-восстановительный потенциал бу- дет равен:
![]()
Это меньше, чем в кислой среде, и количество восстановителей, которые могут быть определены в нейтральной среде, значительно меньше. Безиндикаторное определение момента эквивалентности также затруднено, поэтому перманганатометрические определения в нейтральной среде проводятся значительно реже по сравнению с титрованием в кислой среде.
Перманганатометрия широко используется в товароведной практике для определения редуцирующих сахаров, нитритов, ионов металлов-восстановителей. Метод является одним из лучших способов определения железа в разных объектах. Перманганатометрически прямым титрованием возможно определять V, Mo, W, U, Ti, Nb, Sn, Sb; после растворения образцов эти элементы переходят в высшую степень окисления. Способом обратного титрования или титрования заместителя можно определять ионы, образующие малорастворимые оксалаты (Ca, Mg, Zn, Ba, Pb, Ag, Sr, Co, Th). Окислители определяют перманганатометрически способом обратного титрования.
Дихроматометрия. Достоинством метода является то, что рабочий раствор можно приготовить по точной навеске, поскольку K2Cr2O7 удовлетворяет всем потребностям первичного стандарта. Раствор K2Cr2O7 очень устойчив. Его применяют для определения железа (после предварительного восстановления) и органических компонентов вод или почв (окисляемость по дихромату). Индикатором обычно служат редокс-индикаторы – дифениламин и его производные.
Броматометрия. Реакция титрования броматом калия протекает до точки эквивалентности (в присутствии избытка восстановителя) с образованием бромид-ионов:
BrO3– + 6Н+ + 6е = Br– + 3H2O.
При добавлении лишней капли бромата протекает реакция
BrO3– + 5Br– + 6Н+ = 3Br2 + 3H2O.
По исчезновению окраски красителей судят о конечной точке титрования. Реакцию проводят в кислой среде (pH = 1). Достоинством метода является устойчивость и чистота бромата калия. Броматометрия – лучший метод определения сурьмы, олова, мышьяка, железа и органических соединений. Скорость реакции с восстановителями ускоряется в присутствии солей ртути (II).
Йодиметрия, йодометрия. В основе всех йодометрических определений лежат окислительно-восстановительные процессы, связанные с превращением элементарного йода в ионы I– или обратно:
![]()
Нормальный окислительно-восстановительный потенциал системы (+0,54 В) занимает промежуточное положение между значениями для сильных окислителей и сильных восстановителей. Поэтому существует ряд восстановителей, способных окисляться свободным йодом по указанному уравнению, например, Na2S2O3·5H2O, H2SO3, H2S и их соли и другие восстановители.
Имеется ряд окислителей, способных восстанавливаться йодид-ионами по уравнению
2I– – 2e = I2.
Следовательно, методом йодометрии могут быть определены как восстановители – окислением их свободным йодом, так и окислители – восстановлением их йодид-ионами.
Метод титрования раствором йода иногда называют йодиметрией. Его используют для определения As(III) и As(V) после предварительного восстановления его до As(III). Прямая реакция восстановления йода идет быстро, но обратная реакция окисления йодида протекает медленнее. Поэтому использовать раствор йодида для определения окислителей путем прямого титрования невозможно. К тому же растворы йодида, например KI, неустойчивы, поскольку йодид окисляется кислородом воздуха. Поэтому используют заместительное титрование: добавляют к окислителю избыток йодида, а выделившийся йод оттитровывают стандартным раствором тиосульфата натрия. Этот метод называют йодометрией. Индикатором, так же как и в йодиметрии, служит крахмал. КТТ фиксируют по обесцвечиванию йод-крахмаль- ного комплекса.
Йодометрия – лучший и самый точный метод определения сравнительно больших количеств меди.
