
Конспект_лекцій_Заг.вірусологія_0
.pdfАскоміцети. Вірусоподібні частки виділено із гриба Gaeumannomyces graminis, який спричиняє офіоболез пшениці та ячменю. Якщо культуру вирощують без сівозміни, то ступінь ураження офіоболезом зростає протягом 3-5 років, а потім спадає. Це явище носить назву „спад офіоболезу”.
Французькими дослідниками встановлено кореляцію між спадом офіоболезу і наявністю ізометричних часток діаметром 29 нм у клітинах гриба, ізолятам якого характерний низький рівень патогенності. Рідко утворювали перетеції, у культурі майже не підтримувалися.
Не було виявлено вірусних часток у культурах грибів, вирощених з батьківських аскоспор, які містили вірус.
Із небагатьох вірусоподібних захворювань дріжджів, найбільш повно вивчена здатність декількох штамів Saccaharomyces cerevisiae зумовлювати загибель інших штамів. Штами з такою здатністю назвали штамамивбивцями. Вони продукують позаклітинні білки, токсичні для більшості штамів, які не мають цієї ознаки. Ці білки порушують функції мембран дріжджової клітини аналогічно тим, які індукуються бактеріоцинами у чутливих бактерій. В очищених препаратах штамів-вбивць виявлено токсичні білки з молекулярною масою 2х106 Да.
Є також повідомлення про інфікування S. cerevisiae вірусами,
виділеними з клітин Aspergillus niger і Pénicillium stoloniferum.
Фікоміцети. В одному із видів сапрофітного гриба Thraustochytrium motivum виявлено великі ізометричні частки з суперкапсидною мембраною, що нагадують частинки вірусу герпесу. Опубліковані також роботи про виявлення дрібних ізометричних часток у гриба Labyrinthomyxa marina, який уражує устриці, і більш великі частки, які нагадують іридовіруси.
Незавершені гриби. Добре вивчені також ізометричні частки діаметром 40 нм, які виявлені у клітинах Репісіllит chrysogenum. В інфікованій клітині частки цього типу знаходяться у вільному стані в цитоплазмі або в вакуолях. Коефіцієнт седиментації цих часток 150S. Кожна частка містить одну молекулу дволанцюгової РНК, однак сумарна РНК, екстрагована з препаратів цього вірусу, складається з трьох фрагментів, молекулярна маса яких від 1,9х106 Да до 2,2х 106 Да, містить 51 % ГЦ-пар. У частках наявні також дрібні молекули дволанцюгової РНК з молекулярною масою 1,4х 105 Да, вміст ГЦ-пар становить 38%. Репісіllит chrysogenum синтезує пеніцилін і цей синтез не залежить від інфікованості гриба.
Аналогічні ізометричні частки виявлено в інших видів грибів Репісillит і Aspergillus, які серологічно не споріднені і відрізняються низкою властивостей.
Віруси, іцо інфікують інші групи рослин. Серед папоротей описано дев’ять видів, у тому числі Polipodium аиrеит, чутливих до ВТМ, який нагромаджується в цих рослинах у незначній кількості. У деформованих рослинах папороті з симптомами плямистості виявлено вірусоподібні частки, які не передаються покритонасінним рослинам. Це прямі трубчасті частки розміром майже 320x22 нм; вони передаються з соком молодих спорофітів, у яких з’являються симптоми хвороби.
71
Що ж стосується голонасінних, то досліджено лише один вірус, який передається попелицею, і господарем якого є канадська ялина. Відомо, що деякі віруси покритонасінних інфікують також голонасінні рослини. Наприклад, у разі механічної інокуляції можна інфікувати коріння Pinus sylvestris вірусом некрозу тютюну.
ЛЕКЦІЯ 14. ВІРОЇДИ І ПРІОНИ
Віроїди
Пріони
Віроїди
У природі, крім вірусів, виявлені й інші, дуже дрібні загадкові інфекційні агенти з незвичайними властивостями. До них відносять віро їди і пріони.
Назву "віроїди" було запропоновано в 1971 р. Т. Дінером для назви інфекційних агентів, які побудовані лише з низькомолекулярної одноланцюгової кільцевої РНК, яка не кодує власних білків. Симптоми захворювань, які спричиняють віроїди, подібні до тих, що їх зумовлюють віруси. Однак віроїди відрізняються від вірусів, щонайменше, за чотирма ознаками:
1.Віроїди не мають білкової оболонки і складаються тільки з РНК. Отже, вони не мають антигенних властивостей і не можуть бути виявлені за допомогою серологічних методів.
2.Віроїди мають дуже малі розміри: довжина їхньої РНК становить 10-6 мкм і складається з 300-400 нуклеотидів. Віроїди – найменші інфекційні агенти, здатні до розмноження.
3.Геном віроїдів – це одно ланцюгові, замкнені в кільце РНК. Таку кільцеву структуру має лише один вірус – вірус гепатиту дельта.
4.Молекули РНК віроїдів не кодують власних білків,тому їхнє розмноження може відбуватися або авто каталітично, або залежить від клітини-господаря.
Механізми реплікації віроїдів остаточно не з'ясовані. Вважають, що віро їди в клітинах рослин індукують синтез віроїдних РНК, використовуючи ферменти рослин-господарів. Найбільш вірогідно, що віроїди походять від вирізаних інтронів, які замкнулися в кільце, або від транспозонів, які втратили внутрішні кодуючи області. Очевидно, нові віроїди можуть утворюватися при рекомбінації РНК. Вони самостійно реплікуються у клітинах господарів. Реплікація повністю здійснюється клітинними ферментами. Віроїди не кодують жодних білків, у т. ч. і ферментів реплікації, і не функціонують як матричні РНК. Вони ушкоджують різних господарів, відрізняються за первинною структурою і захворюваннями, які вони спричиняють. Усі описані віроїди побудовані однотипно: 300-400 нуклеотидів формують кільце, що утримується парою нуклеотидів і утворює
72
дволанцюгову паличкоподібну, структуру, перемежовану короткими одно- і дволанцюговими ділянками.
Найліпше вивченим віроїдом є віроїд карликовості хризантем. Хворобу вперше зареєстрували у 1945 р. у США, а віроїд, який її зумовив, ідентифіковано в 1973 р. Його було названо Chrysanthemum stunt virus (вірус карликовості хризантем) і American stunt virus (американський вірус карликовості). Віроїд передається механічно і при вегетативному розмноженні та виявлений у хризантем Dendranthema grandiflorum Kitam у всьому світі. Симптоми захворювання дуже мінливі, залежать як від сорту рослин, так і від умов середовища, особливо від температури й освітленості. Основна ознака – затримання росту, причому зменшення довжини стебла у зрілої рослини становить 30-50% від середніх значень. У інфікованих рослин спостерігається зменшення розміру квіток і більш раннє цвітіння. У сортів з червоним, рожевим і червонувато-коричневим забарвленням квіток простежується зниження інтенсивності забарвлення ("обезбарвлення"). При поєднанні з вірусом хризантем спостерігається зморшкування листків, що супроводжується появою білих штрихів або крапок. У багатьох сортів хризантем до 30% інфікованих рослин залишаються безсимптомними. У природних умовах віроїд здатен заражати Argyranthemum frutescens і Petunia hybrida Surfinia. Експериментально можна інфікувати велику кількість видів родини Compositae. Всі проаналізовані ізоляти віроїда подібні за нуклеотидними послідовностями більше, ніж на 94%. Віроїд зберігає активність у соку хризантем при нагріванні до +95…+98С протягом 10 хв, два-три місяці при +18С і щонайменше п’ять років при +2С. Виявлено у листках і стеблах заражених рослин. Єдина ефективна міра боротьби з хворобою – використання здорового посадкового матеріалу. Техніка меристемної культури з дальшим термічним обробленням не дає змоги позбутися віроїда в заражених зразках.
Досліджено також віроїди, що спричиняють такі захворювання:
1.Екзокортис цитрусових.
2.Веретеноподібність бульб картоплі.
3.Карликовість хмелю.
4.Хвороба каданг-каданг кокосових пальм.
5.Зелена зморшкуватість плодів яблуні.
6.Пухирчастий рак груші.
7.Сонячний опік авокадо.
8.Латентна мозаїка персика.
Віроїди – збудники цих захворювань – мають неоднакову значимість і
небезпеку для сільського господарства. Так, віроїд хвороби каданг-каданг зумовив за останні 50 років загибель мільйонів кокосових пальм на Філіпінах. Віроїд затримання росту хризантем завдав серйозної шкоди промисловому вирощуванню хризантем у США на початку 1950-х рр. Віроїд веретеноподібності бульб картоплі входить до переліку збудників хвороб рослин, що мають карантинне значення в багатьох країнах.
73
Пріони
Пріони – це білкові інфекційні агенти (від англ. Protein infectious particle) паличкоподібної форми довжиною 100-200 нм і діаметром 10-20 нм, які складаються приблизно з 1000 однакових молекул низькомолекулярного білка (сіалоглікопротеїну з мол. масою 27-30 кДа). У екстрактах мозку хворих на трансмісивні губоподібні енцефалопатії людей і тварин (у т. ч. експериментально заражених) виявляють пучки з волокнистою структурою – скрейпіасоційовані фібрили (САФ), що являють собою агрегати "пріонових паличок".
У складі пріонів немає нуклеїнових кислот. Встановлено, що пріонний білок (PrP) наявний у двох ізоформах:
1)нормальна, або клітинна – PrPc (prion protein cellular);
2)аномальна, або патологічна, інфекційна – PrPsc (prion protein scrapie), яка здатна утворювати САФ.
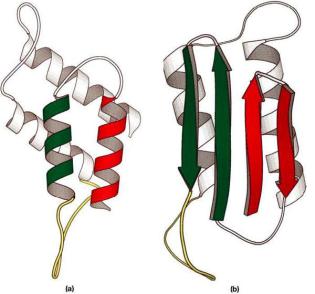
Характерні зміни поліпептидного ланцюга при перетворенні білка РгРс (a) в пріон РгРsc (b)
Ген пріона знаходиться в геномі клітин ссавців і продукує нормальну лізоформу пріонного білка PrPc, що синтезується в багатьох органах і тканинах, але найбільше – у ЦНС. PrPc утворюється на жорстких мембранах ендоплазматичної сітки і транспортується в секреторних везикулах на поверхню плазмалеми клітини. Під час транспортування відбувається процесинг PrPc.
Нормальний пріонний білок має важливе значення для життєдіяльності організму. Він бере участь у передаванні нервових імпульсів, а найголовніше
–відіграє визначну роль у підтриманні т. зв. циркадних ритмів (від лат. circa
–біля й dies – день), регулюючи добові цикли активності та спокою в клітинах, органах і в організмі загалом. Можливо, PrPc відіграє певну роль у процесі старіння організму. Нагромаджені впродовж багатьох років факти свідчать про те, що картина патоморфологічних змін у мозковій тканині при пріонних хворобах людини і тварин дуже схожа з такою, що простежується у
74
процесі старіння. На сьогоднішній день визначені нуклеотидні послідовності гена PrP людини, хом’яка, миші, щура, вівці та ВРХ.
Обидві ізоформи пріонного білка – клітинна та інфекційна – мають абсолютно однакову амінокислотну послідовність, а відрізняється лише за конфігурацією. Встановлено, що PrPc має 24% α-спіральних і 31% β- складчастих структур, тоді як у PrPsc β-складчасті структури становлять 43%, а α-спіральні – 30%. Конверсія PrPc у PrPsc може відбуватися під дією екзогенного інфекційного пріонного білка і при мутаціях гена PrP. Усі ТГЕ (трансмісивні губкоподібні енцефалопатії) людини і тварин є результатом зміни конформації нормального пріонного білка. Глибокі конформаційні зміни PrPc є пост трансляційними,вони лежать в основі розмноження пріонів.
Механізм конверсії PrPc у PrPsc виглядає таким чином. Формується комплекс PrPc-PrPsc, до якого приєднується невідомий наразі білок, який функціонує як шаперон і бере участь у перетворенні α-спіралей у β- складчасті структури. Утворений PrPsc з’єднується з наступною молекулою PrPc і перетворює її в інфекційну ізоформу. Оскільки в заражених клітинах швидкість синтезу PrPc не змінюється, відбувається ланцюгова реакція, нагромаджується PrPsc, який спричиняє дистрофічні зміни і загибель клітин.
Пріони здатні долати видовий бар’єр. Вони є збудниками повільних летальних інфекцій, які вражають ЦНС людини і тварин, об’єднані в групи підгострих трансмісивних губкоподібних енцефалопатій. Група складається зі збудників хвороб людини (куру, хвороби Крейтцфельдта-Якоба, синдрому Герстмана-Штрейслера, аміотрофічного лейкоспонгіозу, хвороби М’ютча) і шести хвороб тварин (скрейпі овець, губкоподібної енцефалопатії корів, трансмісивної енцефалопатії норок, оленів і лосів, губкоподібної енцефалопатії зоопаркових копитних, губкоподібних енцефалопатії котячих).
Куру – рідкісна ендемічна хвороба, виявлена лише серед папуасів племені форе в гірських районах Нової Гвінеї. Механізм виникнення куру пов'язаний із погребальним обрядом, невід'ємною частиною якого був ритуальний канібалізм як прояв трауру до померлих.
Головним чином у цьому ритуалі брали участь жінки і діти, тому захворюваність серед них була в чотири-п’ять разів вищою, ніж серед чоловіків. Зараження відбувалося аліментарно, а також через пошкоджену шкіру, слизову оболонку носа і кон’юнктиву (під час розчленування трупів руками). Короткочасне прогрівання на розпечених каменях у бамбукових циліндрах м’язової тканини, головного мозку та інших внутрішніх органів померлого не інактивувало збудника, оскільки температура всередині циліндрів в умовах високогір’я не перевищувала +95°С.
Інкубаційний період при куру становить 25-30 років і більше. Хвороба характеризується ейфорією, прогресуючим порушенням координації рухів, паралічами і неминучою смертю через 6-24 міс. За 26-річний період (з 1957 по 1982 рр.) від куру померло понад 2500 осіб. У результаті заборони ритуального канібалізму в регіоні поступово знизилася захворюваність. Якщо в 1957 р. було зареєстровано 220 випадків куру, то в 1966 р. - 120. Починаючи з 1980-х рр., смертність від куру різко зменшилася і становить
75
поодинокі випадки на рік, що дає змогу припустити про повне зникнення куру найближчим часом.
Скрейпі (захворювання овець) відома в Європі більше 250 років. Вона трапляється у різних країнах світу. Хвороба характеризується тривалим інкубаційним періодом (до п’яти років), порушенням координації рухів, сильним свербіжем, паралічами і неминучою загибеллю через декілька місяців. У природних умовах можливі різні шляхи зараження:
1.При контакті з хворими тваринами.
2.При утриманні тварин на фермах, де раніше були виявлені випадки захворювання.
3.При поїданні плаценти і на пасовищах, заражених плідними водами.
4.Внутрішньоутробно.
До хвороби є генетична схильність. Чутливість овець коливається від 5 до 78% залежно від породи. Рідко хворіють кози, які мають 100% несприйнятливість.
Трансмісивна енцефалопатія норок (ТЕН) уперше зареєстрована у США в 1947 р. Норки заразилися при поїданні непроварених нутрощів і голів овець, інфікованих збудником скрейпі. Хворі норки виділяють збудник із калом, контамінуючи ним корм. Норки можуть заразитися також при укусах і канібалізмі. Інкубаційний період триває від п’яти місяців до року. Клінічні ознаки ТЕН дуже подібні до скрейпі: сильна збудливість, порушення координації рухів, самопогризання і неминуча загибель через декілька тижнів. Обов’язковим профілактичним заходом при ТЕН є ретельне проварювання субпродуктів овець при згодовуванні норкам.
У 1978 р. і 1982 р. у США в стадах оленів та лосів уперше описано захворювання, подібне до скрейпі овець, - хронічну виснажливу хворобу оленів і лосів. Можливо, тварини заразилися на пасовищах, контамінованих збудником скрейпі.
Губкоподібна енцефагіопатія ВРХ (ГЕ ВРХ, "коров’ячий сказ")
зареєстрована вперше в 1986 р. у Великій Британії набула епізоотичного поширення. До кінця 1997 р. інфікованими виявилися 60% молочного і 16% м’ясного поголів’я Великої Британії, а до грудня 2000 р. було спалено майже 179 тис. корів. Окремі випадки захворювання зареєстровані в 15 країнах світу (всього близько 1 000 станом на вересень 1999 р.). ГЕ ВРХ оголошена як особливо небезпечна хвороба.
Причиною виникнення цієї хвороби стало застосування в раціоні ВРХ м’ясо-кісткового борошна, виготовленого з туш овець, хворих на скрейпі. Важливим чинником стала зміна технології виробництва м’ясо-кісткового борошна з метою підвищення рентабельності (зниження температури і скорочення часу оброблення забитих тварин). За таких умов збудник скрейпі, який характеризується високою стійкістю, зберігся й, очевидно, подолав видовий бар’єр. За біологічними властивостями збудник ГЕ ВРХ відрізняється від збудника скрейпі, проте не можна виключити його походження від якогось штаму пріона скрейпі, який суттєво змінився і стабілізувався у процесі адаптації до організму ВРХ. У результаті заборони
76
згодовувати м’ясо-кісткове борошно різко знизилася кількість випадків захворювання на ГЕ ВРХ. Інших шляхів передавання збудника в природних умовах не встановлено.
Губкоподібна енцефалопатія описана в різних видів антилоп і оленів, які утримувалися в зоопарках та не контактували з великою й дрібною рогатою худобою. У раціон їм теж вводили м’ясо-кісткове борошно.
Інкубаційний період при ГЕ ВРХ триває від двох з половиною до восьми років. Клінічні ознаки дуже подібні до інших ТГЕ: боязливість, агресивність, локомоторні порушення, неадекватна реакція на звук і загибель протягом чотирьох місяців.
Збудник ГЕ ВРХ здатний долати видовий бар’єр. Описані випадки губкоподібної енцефалопатії в домашніх і диких котів, пум, гепардів, оцелотів, тигрів та левів після вживання консервів або сирого м’яса хворої ВРХ. Установлено безпосередній зв’язок між ГЕ ВРХ і хворобою Крейтцфельдта-Якоба в людей. Це спорадичне захворювання, що розповсюджено в усьому світі та реєструється щорічно з частотою один випадок на один мільйон населення. Хвороба уражає людей віком від 30 до 70 років, характеризується тривалим інкубаційним періодом (від 18 місяців до 20 років), локомоторними розладами, прогресуючим недоумством, паралічами і неминуче закінчується смертю через 7-24 місяців після прояву клінічних ознак.
Близько 10-15% випадків захворювання - це родинні вогнища, що генетично детерміновано, а 85% виникає спонтанно, можливо, в результаті мутації гена, що кодує пріонний білок. У 1-5% людей хвороба розвивається як інфекційна, тобто внаслідок екзогенного впливу. Людина може заразитися при споживанні м’яса і головного мозку хворої ВРХ. Можливе проникнення збудника ГЕ ВРХ через мікротравми шкіри і слизових оболонок. Певну небезпеку становлять фармацевтичні й косметичні препарати, виготовлені з тканин інфікованих тварин. Встановлено зв’язок хвороби КрейтцфельдтаЯкоба зі споживанням продуктів харчування із свинини, баранини і морських молюсків.
Особливої уваги заслуговує вивчення ризику передавання збудника хвороби Крейтцфельдта-Якоба від людини до людини ятрогенним шляхом (1% випадків захворювання): при трансплантації органів (зокрема, пересадженні рогівки ока або твердої мозкової оболонки), при хірургічних операціях із використанням контамінованих інструментів або електродів, при гормонотерапії (ін’єкції людського гормона росту, одержаного з гіпофіза померлих).
Синдром Герстмана-Штрейсслера-Шейнкера має клінічний перебіг,
подібний до куру і хвороби Крейтцфельдта-Якоба. Після інкубаційного періоду тривалістю 5-30 років розвивається прогресуюча атаксія, недоумство, і через чотири-п’ять років настає смерть. Аміотрофічний лейкоспонгіоз (хвороба М’ютча) характеризується інкубаційним періодом 3- 14 років, прогресуючими атрофічними парезами скелетних м’язів, порушенням дихання спінального типу і закінчується летально через два-три
77
роки. У виникненні цих ТГЕ суттєву роль відіграють генетичні механізми. Джерела і шляхи передавання збудників інфекції поки що невідомі.
Спадковими захворюваннями є фатальне родинне безсоння, що уражає членів однієї родини і супроводжується стійким порушенням сну (жодні снодійні препарати не допомагають), а також хронічна прогресуюча енцефалопатія дитячого віку (хвороба Альперса), що характеризується головним болем, порушенням зору, епілепсією, ураженням печінки й підшлункової залози.
Усі ці приклади свідчать про спільність збудників ТГЕ тварин і людини, змушуючи приділяти особливу увагу дослідженню чинників ризику зараження людей від тварин або через продукти харчування чи фармацевтичні препарати тваринного походження.
ЛЕКЦЯ 15. ВІРУСИ, ЯК ЗАСОБИ БІОТЕХНОЛОГІЇ
Віруси як засоби доставки генів Віруси як вектори для систем білкової експресії у клітинах ссавців, рослин і комах
Віруси у розробці та доставці вакцин і біотехнологічних препаратів Віруси як специфічні контрастуючі агенти для візуалізації
Дисплей пептидів та білків – розробка промислових, фармацевтичних, біомедичних засобів Віруси як актибактеріальні агенти
З розвитком вірусологічної науки та розумінням молекулярних механізмів життєдіяльності вірусів стало цілком очевидним, що людина мало що може протиставити молекулярній логіці представників царства Vira. Проте набутий досвід у пізнанні біологічної сутності вірусів виявився безцінним, оскільки дозволив використати ці молекулярні машини для вирішення практичних питань. Найповніше цей досвід проявився у сучасній біотехнології - інтеграції природних та інженерних наук, за допомогою якої використання клітин, клітинних та неклітинних структур і окремих біомолекул дозволяє одержати якісніші й дешевші продукти біомедичного та промислового призначення, а також проводити корисні для людини маніпуляції.
Багато вірусних частинок хімічно та/чи генетично модифікуються з метою їх використання у біотехнології, біомедицині чи нанотехнологіях. Хімічний підхід зазвичай включає функціоналізацію зовнішньої чи внутрішньої поверхонь вірусної частинки через хімічно активні групи, які присутні в нативних віріонах чи з’являються внаслідок генетичних маніпуляцій. Генетичний підхід стосується білкової інженерії та грунтується на спрямованих генетичних маніпуляціях з вірусною частинкою, результатом чого виявляється представлення (дисплей) гетерологічних пептидів чи білків на поверхні капсиду (чи внесення їх у порожнину капсиду) як продовження кінцевої ділянки вірусного капсидного білка; заміни у капсидному білку
78
одного чи декількох амінокислотних залишків для створення нових сайтів для ковалентного чи нековалентного приєднання гетерологічних неорганічних, органічних чи біологічних компонентів.
На сьогодні основні сфери і напрямки застосування вірусів у біотехнології можна подати наступним чином:
доставка терапевтичних генів у специфічні клініки (генна терапія);
селективні засоби доставки вакцин / біотехнологічних препаратів, використовуючи віруси як наноносії чи наноконтейнери;
будівельні блоки для побудови наноматеріалів та наноструктур;
антибактеріальні агенти;
засоби пізнання фундаментальних метаболічних процесів у клітині;
специфічні контрастуючі агенти для молекулярної візуалізації;
вектори для систем білкової експресії у клітинах ссавців, рослин і комах;
дисплей пептидів та білків – розробка промислових / фармацевтичних / біомедичних засобів.
Віруси як засоби доставки генів.
Історично склалось, що першими вірусами-транспортерами генів були віруси бактерій. Помірні фаги відіграють важливу роль в обміні генетичним матеріалом між бактеріями. Цей процес дістав назву трансдукція. Розрізняють загальну (генералізовану чи неспецифічну) та специфічну трансдукцію. Механізм загальної трансдукції полягає в тому, що в процесі внутрішньоклітинного розмноження фага в його головку може бути випадково вміщений замість фагової фрагмент бактеріальної ДНК, що дорівнює за довжиною фаговій. Це цілком можливо, оскільки в інфікованій клітині біосинтез її ДНК блокований, а сама ДНК піддається розпаду. Так у процесі репродукції фага виникають дефектні віріони, у яких головка замість власної геномної ДНК містить фрагмент ДНК бактерії. Такі фаги зберігають інфекційні властивості. Вони адсорбуються на бактеріальній клітині, вводять у неї ДНК, яка міститься в головці, але при цьому розмноження фага не відбувається. Введена в клітину реципієнта донорна ДНК, якщо вона містить гени, відсутні в реципієнта, наділяє його новою ознакою.
На відміну від неспецифічної, при специфічній трансдукції переносяться лише визначені гени, а саме ті, які знаходяться у хромосомі лізогенної клітини зліва від attL чи справа від attR. Специфічна трансдукція завжди пов’язана з інтеграцією помірного фага у хромосому клітинигосподаря. Під час виходу хромосоми профаг може захопити ген з лівого чи правого флангу, наприклад gal чи bio. Але в такому випадку він повинен позбутися такого ж розміру своєї ДНК з протилежного кінця, щоб її загальна довжина залишалася незмінною. При цьому утворюються дефектні фаги λdgal та λdbio. Специфічну трансдукцію у Е. coli здійснює не лише фаг лямбда, але і споріднені йому лямбдоїдні та інші фаги. Трансдукуючий фаг у випадку інфікування реципієнтної клітини інтегрується в її хромосому та
79
привносить новий ген (нову ознаку), який опосередковує не лиши лізогенізацію, але й лізогенну конверсію.
З розширенням застосування спектру клітин тварин і рослин в експериментальних дослідженнях розширився і спектр використовуваних вірусів. Проте віруси, які можуть бути використані як засоби доставки генів, перш за все повинні задовольняти наступні критерії:
вірус повинен бути персистентним в організмі та забезпечувати помірний рівень довготривалої генної експресії;
вірус повинен володіти здатністю інтегруватися у чужорідну ДНК та володіти великою клонуючою здатністю / ємністю;
вірус повинен вражати специфічні клітини (повинен володіти здатністю до клітинно-специфічного рецептор-опосередкованого прикріплення і проникнення).
вірус не повинен викликати сильну імунну відповідь, як до власне вірусного вектора, так і до його «вантажу», оскільки це призведе до швидкого виведення вірусу з організму.
На практиці дослідники переконались, що кращими вірусамитранспортерами генів виявляються віруси з рідкісними серотипами, низькою серопревалентністю, низьким рівнем реплікації чи навіть нереплікуючі віруси.
На сьогодні введення чужорідної ДНК шляхом трансфекції стало стандартною процедурою для науковців у галузі біохімії, біотехнології та молекулярної біології. Водночас, поряд із використанням фагів як векторів перенесення ДНК, вчені все частіше використовують аденовіруси (родина Adenoviridae), аденоасоційовані віруси (AAV, родина Parvoviridae) та лентівіруси (родина Retroviridae) для проведення вірусопосередкованої доставки генів.
Використання у дослідженнях представників кожної з цих груп вірусів має свої переваги і недоліки. Наприклад, ікосаедричні безоболонкові аденовіруси з широким спектром тропізму здатні інфікувати як клітини у стані спокою, так і клітини, які діляться. При цьому їх відносно велика молекула дволанцюгової ДНК не інтегрує у клітинний геном, не накладаючи обмежень на можливість проведення послідовних трансфекцій, а експресується за епісомним механізмом. Аденоасоційовані віруси, як представники родини Parvoviridae з одноланцюговою ДНК, природнодефектні віруси, які потребують присутності аденовірусів для завершення своєї репродукції. Ці віруси, подібно аденовірусам, здатні інтегрувати власний геном у клітинний.
Лентівіруси, як представники родини Retroviridae з РНК-геномом, теж можуть інфікувати клітини у стані спокою та клітини, які діляться, забезпечуючи стабільну експресію внесеного гена, інтегрованого у клітинний геном.
Для розширення спектру тропізму вірусів із метою інфікування різних
типів клітин, проводять маніпуляції, спрямовані на зміни вірусних
80
