
- •Глава 1. Атомно-кристаллическое строение материалов
- •1. Электронное строение атомов. Классификация элементов в периодической системе д. И. Менделеева
- •2. Кристаллическое строение твердых тел
- •3. Типы связей между атомами (молекулами) в кристаллах
- •Пояснения к ответам на вопросы
- •2) Правильно.
- •Глава II. Основы теории кристаллизации
- •1. Энергетические условия кристаллизации
- •2. Механизм процесса кристаллизации
- •3. Размер зерна, образующегося при кристаллизации. Строение кристаллического слитка
- •4. Дефекты строения реальных металлов
- •5. Полиморфные превращения металлов
- •6. Методы изучения кристаллического строения металлов
- •Пояснения к ответам на вопросы
- •Глава III. Механические свойства металлов
- •1. Свойства, определяемые при статических испытаниях.
- •2. Свойства, определяемые при динамическом нагружении
- •3. Свойства, определяемые при циклически действующих нагрузках (усталость материалов)
- •4. Свойства, определяемые нагружением в условиях повышенных температур
- •Глава IV. Физическая сущность механизмов деформации и разрушения металлов
- •1. Механизм упругой и пластической деформации металлов
- •3. Факторы, влияющие на хрупкое и вязкое состояние металлов
- •4. Основные направления повышения прочности металлов. Конструктивная прочность
- •Глава V. Наклеп, возврат и рекристаллизация металлов и сплавов
- •1. Наклеп металла
- •2. Отдых (возврат) металла
- •3. Рекристаллизация
- •4. Полигонизация
- •1). Совершенно правильно.
- •3). Ошибаетесь.
- •3). Совершенно правильно.
- •1). Ответ неточный.
- •2). Совершенно правильно.
- •1). Ответ неполный.
- •2). Совершенно правильно.
- •3). Правильно.
- •Глава VI. Строение и свойства сплавов
- •1. Металлические сплавы
- •Характеристика основных фаз в сплавах
- •Особенности кристаллизации сплавов
- •2. Диаграммы состояния сплавов
- •3). Совершенно правильно.
- •2). Правильно.
- •3). Совершенно правильно.
- •2). Правильно.
- •2). Совершенно правильно.
- •3). Правильно.
- •3). Правильно.
- •1). Правильно.
- •3). Правильно.
- •Глава VII. Сталь и чугун
- •1. Диаграмма состояния Fe—Fe3c
- •Глава VIII. Углеродистые стали
- •1. Влияние состава на свойства стали
- •2. Технологические свойства стали
- •3. Основы легирования стали
- •4. Фазы, образуемые легирующими элементами с железом. Влияние легирующих элементов на температуру полиморфных превращений железа.
- •Карбидообразующие легирующие элементы и типы образуемых карбидов
- •5. Влияние легирующих элементов на содержание углерода в перлите, температуру эвтектоидного превращения и свойства стали
- •6. Классификация и маркировка сталей
- •Глава IX. Чугуны
- •1. Процесс графитизации чугунов
- •2. Серый чугун
- •3. Высокопрочный чугун с шаровидным графитом
- •4. Ковкий чугун
- •Марки, основные механические свойства и структуры серых, ковких и высокопрочных чугунов (выборка)
Лекционный материал по материаловедению
(металловедению).
Глава 1. Атомно-кристаллическое строение материалов
1. Электронное строение атомов. Классификация элементов в периодической системе д. И. Менделеева
В современных материалах используются практически все элементы периодической системы Д. И. Менделеева, которая включает 105 элементов (рис. 1).
Для создания новых материалов и использования существующих важно знать, какие факторы и как влияют на свойства элементов, составляющих эти материалы. Свойства элементов в первую очередь определяет электронное строение атомов. Общее количество электронов в атоме равно порядковому номеру элемента в периодической системе. Важнейшей характеристикой электрона является его энергия. Энергетическое состояние электрона определяется четырьмя квантовыми числами n, l, mе, ms.
Главное квантовое число n определяет энергетический уровень электрона, который зависит от расстояния электрона до ядра. Энергия электрона тем выше, чем выше номер уровня, который он занимает.
Максимальное количество электронов N на энергетическом уровне с главным квантовым числом п по принципу Паули определяется из зависимости N=2n2.
Энергия электронов на уровнях распределяется по подуровням, (орбиталям) и зависит от момента количества движения электрона mvr, который называется орбитальным моментом электрона. Величина орбитального момента определяется орбитальным квантовым числом l, имеющего значения от 0 до (n-1). Квантовые подуровни с l=0, 1, 2, 3, ... обозначаются соответственно: s, p, d, f,… Энергия электронов в подуровнях растет в последовательности spdf. Максимальное количество электронов на подуровнях (орбиталях): s — 2; р— 6; d— 10; f— 14. Движение электрона по замкнутому контуру создаёт магнитное поле, вектор напряжённости которого перпендикулярен к плоскости контура - орбитали электрона в атоме.

Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и её импульс. ml может иметь значения от -l до +l, включая 0.
Из-за вращения электрона вокруг собственной оси возникает спиновое квантовое число ms, указывающее на ориентацию вектора спина электрона в пространстве. ms может иметь только два значения +1/2 и -1/2.
Заполнение электронами энергетических состояний происходит в соответствии с принцип Паули, т.е. в атоме не может быть двух электронов в состояниях, характеризующихся четырьмя одинаковыми квантовыми числами.
Повышение энергии электронов на уровнях (1, 2, 3 ... 7) и подуровнях s, р, d, f происходит в последовательности: Is2s2p33p43d4p5s4d5p6s4f5d6p7s5f 6d. В этой же последовательности происходит заполнение электронами энергетических уровней и подуровней. Важно запомнить также, что энергия электронов на заполняемой орбитали выше, чем на заполненной.
Исходя из изложенного и зная порядковый номер элемента, можно построить электронную модель атома элемента. Важнейшее значение для свойств элементов имеет полнота заполнения электронами внешних (валентных) орбиталей.
Внешней орбиталью считается наиболее удаленная от ядра. В зависимости от количества электронов в атоме элемента, может быть заполнено различное количество орбиталей. Следует напомнить, что валентными могут быть как внешние электроны, так и электроны предшествующей орбитали (подуровня).
По окислительно-восстановительным функциям (по склонности отдавать или принимать электроны) элементы подразделяются на восстановители-металлы и окислители-неметаллы. Элементы левее ломаной линии в таблице на рис. 1 являются металлами, правее — неметаллами.
По заполнению электронами внешних электронных орбиталей (подуровней) металлы разделяют на две группы. Металлы, у которых электроны на d-подуровне отсутствуют Li, Na, Са, А1 и др. или у которых d-подуровень полностью заполнен Си, Zn, Gd, Ag и др., называются простыми металлами. Металлы, имеющие частично заполненный d-подуровень, при наличии электронов на внешнем s-подуровне, называются переходными. К числу переходных металлов относятся важнейшие конструкционные металлы (Fe, Cr, Ti, Mo, Ni и др.). Переходные металлы в таблице Д. И. Менделеева (рис. 1), заключены в пунктирную рамку.
№ 1. Напишите электронную формулу, соответствующую атому Ti (№ 22)? К какой группе металлов следует отнести титан? (Ответ см. на с. 25).
Б ольшой
интерес представляют физические свойства
материалов (электропроводность и др.).
По одному из важнейших физических
свойств — электропроводности
(или) электросопротивления
элементы
относят к трем группам: к металлам,
полупроводникам и диэлектрика. Между
металлами и полупроводниками имеется
качественное различие не только в
величине электросопротивления, но,
главное, в характере зависимости
электросопротивления от температуры
(pиc.
2).
ольшой
интерес представляют физические свойства
материалов (электропроводность и др.).
По одному из важнейших физических
свойств — электропроводности
(или) электросопротивления
элементы
относят к трем группам: к металлам,
полупроводникам и диэлектрика. Между
металлами и полупроводниками имеется
качественное различие не только в
величине электросопротивления, но,
главное, в характере зависимости
электросопротивления от температуры
(pиc.
2).
Зависимость
![]() для металлов имеет линейный характер
для металлов имеет линейный характер
![]() (1)
(1)
где
о
-
удельное электросопротивление при 0°К,
а
-
температурный коэффициент
электросопротивления, Т
-
абсолютная температура. Для полупроводников
![]() изменяется
по экспоненциальному закону
изменяется
по экспоненциальному закону
![]() (2)
(2)
где Е - ширина запрещенной энергической зоны электронов, k - постоянная Больцмана, А — коэффициент.
Между полупроводниками и диэлектриками различие в электропроводности только количественное, определяемое шириной запрещенной зоны Е.
На рис. 1 элементы с полупроводниковыми свойствами выделены соответствующей штриховкой клеток, в которых они расположены.
Элементы (кроме водорода), расположенные левее полупроводников — металлы, правее — диэлектрики.
Следует отметить, что такое подразделение элементов, когда они находятся в атомарном состоянии, совершенно несостоятельно. В атомарном состоянии все элементы — диэлектрики, а различие в физических свойствах проявляется, когда вещество находятся в конденсированном (в жидком или твердом) состоянии.
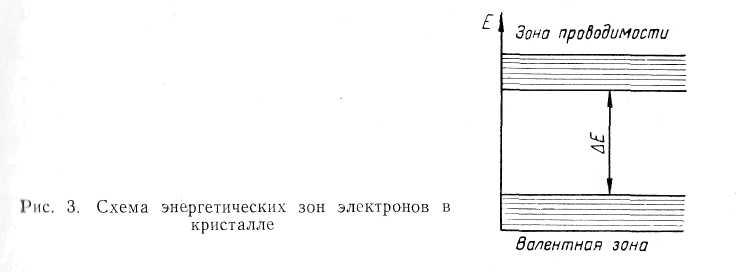
Различие в свойствах металлов, полупроводников и диэлектриков можно понять, если учесть, что электроны в твердом теле (кристалле) располагаются по квантованным энергетическим зонам (состояниям), причем существуют такие области значений энергий, которые не могут быть заняты электронами. Эти области называются запрещенными зонами. Важнейшие свойства (электрические, магнитные, оптические и др.) твердых тел объясняются энергетическим состоянием валентных электронов, поэтому на схемах энергетических состояний, рис. 3, изображают две разрешенные энергетические зоны: валентную зону, соответствующую нормальным (невозбужденным) состояниям валентных электронов и ближайшую к ней зону возбужденных состояний электронов, которая называется зоной проводимости. Такое название связано с тем, что при отсутствии внешних возбуждений в ней нет электронов. Когда же, получив извне энергию (от облучения, нагрева), электрон перейдет в эту зону, то он может в ней свободно изменять свою энергию, двигаясь под действием внешнего электрического поля, т. е. участвовать в проводимости. Е на рис. 3 является энергетической щелью или зоной запрещенных энергий.
Различная электропроводимость разных тел будет понятна, если учесть, что внешнее электрическое поле приводит к изменению энергетического состояния электрона в сторону ее повышения. Это, очевидно, возможно, когда электрон находится в зоне, где есть свободные энергетические уровни. Следовательно, проводниками являются тела, валентная зона энергии электронов которых полностью не заполнена.
№ 2. Для какого материала Аl или Сu можно ожидать большей электропроводности? Почему? Ответ (см. на с. 25): для 1) Сu; мало валентных электронов, которые в валентной зоне занимают минимальное число энергетических уровней; 2) Аl; много электронов на внешнем уровне, которые могут участвовать в проводимости,.
№3. Незаполненные валентные зоны имеют металлы. Какой из металлов К или Fе должен обладать лучшей электропроводностью? Ответ (см. на с. 25): 1) Fe, 2) К.
В полупроводниках энергетические уровни валентной зоны при 0°К уже полностью заняты электронами, а уровни зоны проводимости свободны. Эти зоны разделены энергетической щелью Е = 0,1 ... 3 эв, которую электрон перейти не может. Поэтому при низких температурах такие тела — диэлектрики. Внешнее возбуждение электронов (нагрев, облучение) ведет к повышению энергии электронов до значений энергии в зоне проводимости, (рис. 3).
№ 4. Как должна изменяться электропроводность полупроводников с повышением температуры? Ответ (см. на с. 26): 1) повышаться; 2) понижаться.
Так
как вероятность того, что электрон
получит энергию >Е,
рис. 3. пропорциональна
![]() ,
то понятно, почему электросопротивление
полупроводников с изменением температуры
изменяется по зависимости (2),
с.
16.
,
то понятно, почему электросопротивление
полупроводников с изменением температуры
изменяется по зависимости (2),
с.
16.
Таблица 1
Интервалы значений электросопротивления для разных материалов
|
| |
|
Материалы |
, ом.см |
|
Металлы Полупроводники Диэлектрики |
10—4,,,10-6 1010,,,..10-4 1О2О.,,,..1О10 |
Диэлектрики отличаются от полупроводников только шириной энергетической щели Е, которая у диэлектриков при: Т~-273°С З эв. Таблица 1 дает наглядное представление о порядке величин для трех групп материалов.
На энергетическое состояние валентных электронов атомов кристаллического тела оказывает большое влияние относительное расположение и тип связей между атомами в кристаллическом теле. Эти вопросы рассматриваются в зонной теории твердых тел.
