
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
Федеральное государственное бюджетное образовательное
учреждение высшего профессионального образования
«Дальневосточный государственный технический
рыбохозяйственный университет»
(ФГБОУ ВПО «ДАЛЬРЫБВТУЗ»)
Л.Л. Арбузова
Ихтиотоксикология
Владивосток
2015
УДК
ББК
Авторский знак
Рецензенты:
- Слободскова В. . ?, к.б.н., научный сотрудник лаборатории морской экотоксикологии Тихоокеанского океанологического института им. В.И. Ильичева ДВО РАН
- В.Н. Казаченко, д.б.н., профессор кафедры «Водные биоресурсы и аквакультура» Дальрыбвтуза
Арбузова Л.Л. Ихтиотоксикология. Уч. пос. Владивосток: Дальрыбвтуз, 2015. ???с.
В пособии даны представления о составе сточных вод, их влиянии на гидробионтов. Рассматриваются проблемы биотестирования и биоиндикации водной среды, а также влияние токсических веществ на физиологические, биохимические процессы и поведенческие реакции рыб в условиях загрязнения водной среды.
В пособии приведены сведения о методике сбора и обработки материала при подозрении на отравление рыб.
Учебное пособие предназначено для студентов-бакалавров по направлениям 111400.62 «Водные биоресурсы и аквакультура» и 022000.62 «Экология и природопользование» дневной, заочной и ускоренной форм обучения, магистров экологии, биологии, ихтиологии и рыбоводства.
©Дальневосточный государственный
технический рыбохозяйственный
университет, 2015
Содержание
Введение
1. Предмет и задачи ихтиотоксикологии
2. Основные понятия ихтиотоксикологии
3. Действие чужеродных веществ на рыб и других гидробионтов
4. Методология ихтиотоксикологии
4.1. Биотестирование и биоиндикация
4.2. Методы диагностики отравления рыб
4.3. Методика сбора материала для лабораторных исследований при подозрении на отравление рыб
4.4. Стандартная схема ихтиотоксикологических исследований. Метод функциональных нагрузок
5. Классификация сточных вод
6. Токсикологическая характеристика химических веществ
6.1. Характеристика неорганических веществ. Источники поступления в водоемы, токсичность, диагностика отравления гидробионтов
6.2. Характеристика органических веществ. Источники поступления в водоемы, токсичность, диагностика отравления гидробионтов
7. Чувствительность и устойчивость рыб к токсикантам. Факторы, влияющие на устойчивость рыб к токсикантам
7.1. Характер зависимости «концентрация – время»
7.2. Влияние видовых, возрастных и индивидуальных особенностей, сезонных и некоторых других факторов на токсикорезистентность рыб
7.3. Влияние экологических факторов среды на токсикорезистентность рыб
7.4. Совместное действие токсических веществ
8. Механизм действия токсикантов на гидробионтов
8.1. Влияние токсикантов на обмен веществ и биохимический состав рыб
8.2. Механизм действия токсикантов на центральную и вегетативную нервную систему рыб
9. Трансформация токсикантов в среде и телах гидробионтов
9.1. Превращение токсических веществ в водной среде под влиянием абиотических факторов
9.2. Пути поступления токсикантов в тела гидробионтов. Накопление веществ компонентами водных экосистем. Коэффициент биомагнификации, коэффициент распределения
9.3. Биохимические механизмы трансформации токсикантов в телах гидробионтов
Рекомендуемая литература
Словарь терминов
ВВЕДЕНИЕ
Химические вещества, содержащиеся в промышленных, сельскохозяйственных и коммунальных стоках, оказывают токсическое воздействие на гидробионтов, в том числе на рыб, ее молодь и икру, уничтожают нерестилища и нагульные угодья, уменьшают промысловые запасы и ухудшают качество рыбы как товарного продукта.
Загрязнение водоемов влечет за собой нарушение биологического равновесия среди гидробионтов и процессов самоочищения воды.
Поскольку полная очистка сточных вод от ядовитых веществ в настоящее время невозможна, то необходимо знать от каких веществ и до каких пределов необходимо очищать сточные воды, чтобы они не оказывали губительного воздействия на рыб и экосистему водоема.
Ихтиотоксикология (водная токсикология) как наука, занимающаяся вопросами взаимодействия токсических веществ и гидробионтов, является актуальной отраслью знаний, так как решает важнейшую проблему охраны природы – сохранение экосистем континентальных вод и морских водоёмов.
Основное условие решения проблемы загрязнения рыбохозяйственных водоемов – выявление пороговых и предельно-допустимых концентраций ядовитых веществ в стоках. Понимание механизмов воздействия токсикантов на рыб дает возможность разрабатывать методы определения ПДК для морских и пресноводных рыб.
Решение задач, стоящих перед ихтиотоксикологией, требует знания гидробиологии, гидрохимии водоемов, основ генетики, гистологии и эмбриологии гидробионтов. Ихтиотоксикология методически тесно связана с ихтиопатологией, токсикологией, физиологией и биохимией.
1. ПРЕДМЕТ И ЗАДАЧИ ИХТИОТОКСИКОЛОГИИ
Ихтиотоксикология (водная токсикология) – наука о токсичности водной среды как среды обитания водных организмов. Изучает реакции рыб и других гидробионтов разного систематического положения на токсическое воздействие водной среды, которая приобретает токсические свойства в результате деятельности человека или жизнедеятельности обитающих в воде организмов.
Одной из основных задач ихтиотоксикологии является определение тех границ, при которых внешние факторы среды обитания переходят физиологические пределы и становятся вредными для организма.
В современной ихтиотоксикологии определились несколько направлений в исследованиях как теоретического, так и практического характера. Каждое направление решает свои задачи, которые в конечном итоге являются общими для ихтиотоксикологии.
1. Борьба с загрязнениями водоемов. Основной задачей направления является установление предельно допустимых концентраций сточных вод, а также выдача научно обоснованных рекомендаций, определяющих, до каких пределов надо очищать стоки, прежде чем их спустить в открытый водоем.
2. Диагностика отравления рыб. Центральной задачей является разработка комплексных методов диагностики отравления рыб.
Для диагностики отравления рыб в настоящее время используются клинические, патологоанатомические, гистологические, гематологические, физиологические, биохимические, биофизические методы исследования, метод условных рефлексов, органолептические исследований. Особенно важна в этом аспекте разработка экспресс-методов диагностики отравления рыб. Изучение и подбор индикаторных организмов на различные токсические вещества.
3. Выяснение механизма действия токсических веществ и метаболизм токсиканта в организме гидробионта. Это направление имеет самое непосредственное значение для практики. В теоретической части этой проблемы стоят вопросы воздействия токсических веществ на гидробионты на уровне молекул, организма и популяции.
На уровне организма определяют: а) количественное и качественное изменение обмена веществ; б) узловые процессы, нарушающие регуляцию; в) связь нарушений обмена веществ с размножением, плодовитостью и качеством потомства; г) приспособление, привыкание организма к ядам и степень их накопления; д) метаболизм токсиканта в организме гидробионта; е) особенности действия на рыб сточных вод сложного состава (синергизм и антагонизм ядов); ж) влияние неспецифических факторов водной среды на устойчивость рыб к ядам промышленных сточных вод; з) хроническое действие малых концентраций вредных веществ и отдаленные последствия кратковременного контакта с высокотоксичными водами.
На уровне популяции (или биоценоза) изучают: а) поведение и изменения, претерпеваемые популяциями; б) изменение биоценотических взаимоотношений; в) изменение фауны и флоры водоема.
4. Борьба с ненужными (вредными для человека) гидробионтами. Задача – управление процессами, происходящими в водоемах, чтобы исключить создания условий, неблагоприятных для жизни полезных для человека гидробионтов, бороться с цветением и зарастанием водоемов или обрастанием гидротехнических сооружений.
2. ОСНОВНЫЕ ПОНЯТИЯ ИХТИОТОКСИКОЛОГИИ
Токсичность – способность химических веществ вызывать нарушение жизнедеятельности организма – отравление.
Степень токсичности химических соединений выражают в концентрации, вызывающей гибель 50% гидробионтов в остром опыте. Все вещества, вызывающие в острых опытах гибель 50% рыб, делятся па пять групп:
высокотоксичные вещества, вызывающие гибель 50% рыб при концентрации до 1 мг/л;
сильно-токсичные – в концентрации 1–10 мг/л;
умеренно-токсичные – в концентрации 10–100 мг/л;
слаботоксичные – в концентрации свыше 100 мг/л;
очень слаботоксичные вещества – в концентрации свыше 1000 мг/л.
При установлении степени токсичности химических веществ для гидробионтов различают:
смертельные концентрации (дозы) — вызывают гибель всех (СК100) или половины (СК50) животных при остром или хроническом отравлении;
токсические – максимально переносимые концентрации (СКо), вызывающие клинические признаки отравления, не обусловливая гибели организма;
3) пороговые концентрации – минимальные концентрации, вызывающие достоверно патологические изменения в организме, регистрируемые наиболее чувствительными методами исследования;
4) предельно допустимые концентрации (ПДК) – допустимые концентрации вредных веществ в рыбохозяйственных водоемах, которые не оказывают отрицательного влияния на режим водоемов, не нарушают нормальную жизнедеятельность рыб и других полезных гидробионтов, не создают опасности накопления токсических веществ в объектах водоема.
Отравление (токсикоз) – способность вещества вызывать нарушение жизнедеятельности организма.
По длительности течения различают острые, подострые и хронические отравления (токсикозы).
Острые отравления возникают при одновременном поступлении в организм больших количеств ядовитых веществ, сопровождаются бурным развитием признаков заболевания и завершаются массовой гибелью рыб в течение 3 – 10 суток или выздоровлением.
Подострые отравления протекают замедленно, вызывая умеренно выраженную клиническую картину и постепенную гибель рыб в течение 10–30 дней.
Хронические отравления развиваются при многократном поступлении в организм ядовитого вещества, вызывают медленную гибель рыб в течение длительного времени (месяцы) со стертыми клиническими признаками. В периоды стрессовых состояний хронические токсикозы нередко обостряются и сопровождаются массовой гибелью рыб. Хроническое отравление вызывают те яды, которые обладают способностью к материальной или функциональной кумуляции.
Отравления рыб в естественных водоемах О. Н. Крылов (1980) разделяет на три группы.
Природные токсикозы возникают в районах водораздела пресных и соленых водоемов, когда происходит засоление пресной воды при падении ее уровня и переливе морской воды.
Токсикозы рыб от цветения водорослей. Сине-зеленые водоросли в пресных водоемах при обильном развитии выделяют токсины, а при массовом отмирании поглощают кислород и разлагаются с образованием ядовитых продуктов. Подобное явление может наблюдаться при массовом развитии динофитовых водорослей в море.
Токсикозы рыб от химических веществ антропогенного происхождения являются результатом «залповых» сбросов сточных вод или систематического загрязнения водоемов небольшими количествами токсических веществ.
Кумуляция — способность вещества накапливаться в организме при многократном поступлении. Различают материальную кумуляцию и функциональную.
Под материальной кумуляцией понимают постепенное увеличение содержания ядовитого вещества в организме от недействующих количеств до токсического уровня. Кумулятивные свойства вещества выражают коэффициентом кумуляции (Кн) – отношением содержания токсического вещества в организме рыб или других гидробионтов (мг/кг) к концентрации его в воде (мг/л). Если же происходит суммирование не самого яда, а эффекта его действия, наступает функциональная кумуляция.
Большинство протоплазматических и энзиматических ядов (фториды, цианиды, меркаптаны, фосфорорганические соединения, свинец и др.) обладают функциональной кумуляцией. Функциональная кумуляция встречается чаще, чем материальная. Она более опасна, так как встречается даже при действии быстро разрушающихся препаратов. Большинство солей тяжелых металлов, хлорорганических пестицидов оказывает токсическое действие на организм рыб в малых дозах посредством материальной кумуляции. Следует отметить, что в зависимости от физико-химических свойств токсиканта может быть либо материальная, либо функциональная кумуляция, либо та и другая одновременно (фтор, свинец и др.).
Токсические вещества способны к кумуляции не только в биологическом объекте (рыбе, фито- и зоопланктоне, в водорослях, растениях), но и в грунте, илах. Отмечено, что растения обладают большей способностью накапливать токсические вещества, чем животные. Это относится в первую очередь к хлорорганическим пестицидам и радиоактивным веществам.
Кумуляция токсического агента происходит в том случае, когда скорость выделения или разрушения ею ниже скорости поступления в организм. Длительное поступление малых доз вещества, способных накапливаться в организме, приводит к острому отравлению.
Кумулятивный эффект может иметь существенное значение в определении уровня устойчивости рыб к ядам промышленных сточных вод. Поэтому при установлении ПДК необходимо знать способность вещества к кумуляции и делать соответствующие поправки для ПДК, учитывая как материальную, так и функциональную кумуляцию.
Высокой материальной кумуляцией обладают тяжелые металлы и их соли, некоторые галогены (фтор, селен), хлорорганические пестициды, радионуклиды. Слабой кумуляцией обладают фосфорорганические соединения.
По способности к материальной кумуляции токсиканты делятся на несколько групп:
–вещества со сверхвысокой кумуляцией, (Кн) – 1000 и более;
–вещества с высокой кумуляцией, Кн – 201–1000;
–вещества с умеренной кумуляцией, Кн – 51–200;
–вещества со слабовыраженной кумуляцией, Кн – до 50.
Обратимость отравления. Под действием токсических веществ в организме рыб могут происходить патологические изменения на уровне молекул, на уровне организма и на уровне популяции (или биоценоза). Однако описаны случаи обратимости патологических процессов на уровне функциональных изменений организма, а также на уровне клетки при радиационных повреждениях. Степень обратимости отравления может служить показателем устойчивости рыб к ядам. Обратимость отравления рыб после патологических сдвигов в организме, вызванных токсическими веществами, важна в практическом отношении.
Обратимость отравления зависит от природы и химических свойств яда, времени воздействия, концентрации, степени поражения, видовых особенностей рыб и других факторов. Так, пересадка рыб в чистую воду после пребывания их в токсических растворах солей тяжелых металлов (кадмия, ртути, никеля, кобальта), концентрированных кислот и щелочей не спасала их от гибели, так как в этих случаях наблюдались необратимые поражения жаберного эпителия. В то же время описаны случаи обратимости отравления рыб от ионов меди в том случае, когда рыбу переносили в свежую воду в фазе «опрокидывания». Отмечена обратимость отравления рыб, вызванного цианидами и сульфидами, фенолом и крезолом. В. И. Лукьяненко (1967) установил высокую обратимость фенольной интоксикации, применяя фенол в разной концентрации, при разной экспозиции. Отмечена высокая обратимость отравления рыб (карпа) фосфорорганическими инсектицидами в противоположность хлорорганическими.
При обратимости отравления рыб не до конца ясен вопрос о дальнейшей судьбе такой рыбы. В литературе имеются сведения, что у рыбы после воздействия токсикантов, особенно фенолом и детергентами, понижается сопротивляемость организма к различного рода заболеваниям; часто рыба страдает сапролегниозом.
Адаптация. Адаптация – способность рыб привыкать к определенным ядам и характеризует повышенную устойчивость рыб к ядам. Она зависит от химической природы и концентрации яда: более выражена адаптация рыб к ядам органической природы и почти отсутствует к неорганическим.
Исследования по адаптации рыб показали, что после выдерживания рыб (гольянов, горчаков и верховки) в растворах сублетальных концентраций токсических веществ (KCN, (NH4)2SO, HgCl2, Na2HAs04, Zn04) в течение двух дней, возрастало время выживания у подопытных рыб по сравнению с контрольными рыбами. Разность во времени гибели подопытных и контрольных рыб давала коэффициент приспособления, что указывает на явления адаптации. Установлено, что феномен адаптации рыб к ядам носит временный характер и выражается в повышении устойчивости организма рыб к яду, сменяющейся фазой истощения вследствие нарушения адаптационных механизмов. На ранних этапах онтогенеза адаптация у рыб также носит временный характер.
3. ДЕЙСТВИЕ ЧУЖЕРОДНЫХ ВЕЩЕСТВ НА РЫБ И ДРУГИХ ГИДРОБИОНТОВ
Начальные процессы действия веществ
Проникая в клетку, атомы и молекулы токсических веществ вступают во взаимодействия с молекулами, входящими в состав элементов клетки. Химические компоненты клетки, подвергающиеся непосредственной атаке токсиканта, называют рецепторами или мишенями.
При исследовании первичных механизмов действия не следует исключать чисто механические воздействия. Особенно характерны такие воздействия для соединений железа. Адсорбируясь на поверхности икринок, жабр гидробионтов коллоидные частицы гидроокислов железа нарушают нормальный обмен организма с окружающей средой.
Для того чтобы вещество накапливалось в клетке и проявило биологическую активность, необходимо, чтобы оно вступало в некоторые химические взаимодействия. Динамика токсикологических эффектов часто описывается теми процессами, что характерны для биохимических реакций, где токсикант и рецептор могут выступать в роли фермента и биосубстрата. Явления антагонизма и синергизма могут быть объяснены с этих позиций, как следствие конкуренции за активные центры – рецепторы.
Не каждая молекула токсического вещества вступает во взаимодействия, которые развиваются в процессы поражения на последующих уровнях. Полагают, что минимальная концентрация чужеродного соединения в организме, необходимая для прохождения химических взаимодействий, должна быть около 10 мкм/л или 7-10 молекул на грамм ткани. Эту величину иногда и рекомендуют определять в качестве истинного порога действия вещества. При дальнейшем нарастании концентрации будет повышаться и вероятность взаимодействия и опасность появления нарушений в клетке. Эти первичные взаимодействия называют механизмом действия, а все последующие явления – эффектом действия.
Ионы металлов преимущественно связываются с SH-, NН2,- и С00Н-группами молекул клетки. Особенно характерны реакции с SH-группами белковых молекул, такие яды называют тиоловыми (ртуть, свинец, мышьяк, кадмий и др.). Вступая во взаимодействия с сульфгидрильными группами различных соединений, металлы образуют меркаптиды и необратимо инактивируют ферменты.
Токсичность этих металлов зависит от прочности их связи с серой. С возрастанием прочности связи возрастает токсичность. Помимо прямой инактивации ферментов катионы вызывают агглютинацию белковых мицелл. Мицеллы несут на поверхности отрицательный заряд и за счёт этого взаимно отталкиваются, что способствует стабилизации коллоидов. Катионы нейтрализуют этот заряд и изменяют вязкость среды клеток.
Металлы, как известно, являются в некоторых количественных пределах жизненно важными элементами. Полагают, что это относится без исключения ко всем металлам. Поэтому на состоянии организма, течении нормальных жизненных процессов отражается не только избыток, но и дефицит металлов в тканях. Некоторые пестициды способны связывать и выводить из организма катионы, в том числе и металлы, нарушая нормальное течение биохимических процессов. Этим механизмом в значительной степени объясняют действие, например, диметилдитиокарбаматов и других комплексообразующих веществ.
Что касается неэлектролитов, являющихся химически инертными, то считают, что их действие обусловлено главным образом растворением в липидной фазе клеточных структур, в результате чего происходит набухание мембран и пространственно разобщаются локализованные здесь ферментные комплексы. Однако, не стоит ограничивать действие неэлектролитов только их механическим действием.
По общему характеру действия, таким образом, яды разделяются на неспецифические, слабо вступающие в химические взаимодействия с тени или иными молекулами биосубстрата, и специфические, реагирующие активно с биологически важными молекулами. Однако и неспецифические яды рано или поздно могут трансформироваться в тканях в процессе детоксикации. Такая трансформация возможна только в результате прохождения химических взаимодействий. Очевидно, этим и объясняется тот факт, что наряду с неспецифическим, действием почти все вещества в той или иной степени обладают и некоторыми чертами специфического действия. Специфическое действие таких веществ, как неэлектролиты, может формироваться их сродством с липопротеиновыми структурами разных тканей, за счет чего они способны включаться через транспортные системы мембран и формировать разнообразие токсической активности. Действие неэлектролитов иногда называют физической токсичностью, однако чаще всего их действие называют наркотическим эффектом. Появление этого названия связано с тем, что неэлектролиты, избирательно локализуясь в богатых липидами тканях нервной систем, вызывают нарушение ее нормальной деятельности.
Некоторые вещества оказывают биологическое действие через радикальный механизм. Радикалы – молекулы, обладающие электроном с не спаренным магнитным моментом. Действие их обусловлено как высокой реакционной, способностью, так и способностью инициировать цепные процессы в биосубстратах. Радикалы способны образовывать такие вещества, как четыреххлористый углерод, металлоорганические соединения и др. По радикальному механизму действуют гербициды дикват и паракват. Эти соединения активизируются путем образования радикалов на свету в присутствии хлорофилла и кислорода.
В результате первичных взаимодействий молекул чужеродного агента с молекулами биосубстратов происходит зарождение тех нарушений, которые в дальнейшем проявятся на уровне биохимических, физиологических процессов на уровне организма, популяции и сообщества.
Изменения, определяющие эффект, представляют собой сочетание деструктивных процессов, порожденных вмешательством вещества, и ответных реакций организма (реагирование организма) на интоксикацию. Редко удается вычленить из общей картины отдельно эти деструктивные или защитные реакции. Нарушение структуры и функции организма взаимосвязаны и последовательно трансформируются друг в друга.
Некоторые явления, наблюдаемые при интоксикациях, могут формироваться в результате как первичных, так и последующих процессов действия токсиканта и ответа организма.
Первичное действие токсикантов на организм гидробионтов, таким образом, может быть обусловлено:
- изменением поступления в клетку веществ, необходимых для продукции энергии, реакций синтеза или для поддержания осмотических или электростатических свойств клетки;
- реакцией токсикантов с ферментами или метаболитами энзиматических реакций, влиянием на продукцию энергии или синтез вещества.
Эффекты на процессы метаболизма
Одним из непосредственных последствий взаимодействия токсиканта с биомолекулами является снижение концентраций некоторых биосубстратов и изменение активности ферментов. За счет связывания соответствующих ферментов или образования метгемоглобина в тканях создается гипоксия и дефицит кислорода. При метгемоглобинообразовании трехвалентное железо гемоглобина связывается необратимо токсикантом, в результате чего гемоглобин теряет способность переносить кислород. Образовывать метгемоглобин могут нитросоединения, амины, окислители (хлораты, хиноны, нафталин), окислительно-восстановительные красители, некоторые лекарственные препараты (анальгин). Цианистые соединения взаимодействуют с окисленными молекулами цитохромоксидаз, создавая тканевую гипоксию. Клетки теряют способность усваивать кислород из крови.
Связывание сульфгидрильных и других активных групп, как уже отмечалось, приводит к инактивации ферментов. Ингибирование ферментов может быть обратимым и необратимым, конкурентным и неконкурентным. Обратимое ингибирование характеризуется равновесием между активностями фермента и ингибитора, степень ингибирования зависит от концентрации ингибитора. Пример обратимого ингибирования – действие цианидов на цитохромоксидазы, в результате чего создается тканевая гипоксия. Необратимое ингибирование характеризуется прогрессивным возрастанием со временем до полного ингибирования даже при низкой концентрации ингибитора, но общем его объеме, превышающем количество фермента. Примером такого типа ингибирования служит действие цианидов на ксантиноксидазу и фосфорорганических соединений – на холинэстеразу.
Существенным фактором токсического поражения служит изменение активности трансаминаз. Трансаминазам принадлежит существенная роль в процессах переаминирования аминокислот и в сопряжении аминокислотного и углеводного обманов. Активность трансаминаз изменяется при воздействии токсических веществ различной природа. Изменение активности трансаминаз, содержания свободных аминокислот и уменьшение концентрации SH- групп свидетельствует о нарушении синтеза белков.
Под воздействием токсикантов происходит снижение количестве окисленной и повышение восстановленной форм НАД (никотинаминдинуклеотида), что выражается в изменении соотношения НАД/НАДН. Снижение этого соотношения свидетельствует о повышении доли анаэробного пути расцепления углеводов, который является гораздо менее энергопродуктивным и быстро истощает энергетические ресурсы клетки.
При исследовании биохимических эффектов токсических веществ очень показательны оценки биохимического или физиологического состояния некоторых органелл (лизосом, пероксисом, митохондрии, ядра и др.) и систем, синтезирующих белок и нуклеиновые кислоты. Для митохондрий это – интенсивность окислительного фосфорилирования (поглощение кислорода и утилизация неорганического фосфата), для лизосом – соотношение активности кислых гидролаз (фосфатазы, ДНК-азы, РНК-азы и др.), для пероксисом – соотношение активности каталазы и пероксидазы. Основное внимание уделяется этим органеллам потому, что при детоксикации веществ в клетке основная роль принадлежит окислительным ферментам микросом, каталазе и пероксидазе пероксксом, гидролазам лизосом, гидролизирующим биополимеры. Эти же ферменты разрушают клетку при нарушении ее функции и обмена веществ. Многочисленные биохимические изменения могут быть вызнаны нарушением мембран лизосом и выходом литических ферментов.
Изменение проницаемости клеточных мембран оказывается универсальным функциональным нарушением при токсическом воздействии. Первичным нарушение проницаемости оказывается при действии наркотиков и локальном действии ионов тяжелых металлов. На клетки водорослей и бактерий катионы могут оказывать действие путем снижения отрицательного заряда клеточной поверхности, нарушая при этом транспортные системы мембрам. Наркотические агенты или неэлектролиты нарушают проницаемость за счет изменения активности АТФ-аз, обеспечивающих работу транспортных систем мембран.
Для гидробионтов одним из важнейших следствий изменения проницаемости является нарушение осморегуляции. Ртуть, цинк, медь, свинец, нефть, алюминий и другие вещества вызывают структурные повреждения жабр у гидробионтов и нарушают транспорт ионов, что отражается на ионном составе крови. Возможно, это нарушение связано со снижением активности Nа+, К+ активируемой АТФ-азы, обеспечивавшей работу ионных насосов клеточной мембраны.
Большинство видов, пресноводных и морских, поддерживают осмотическое давление клеток (внутренней среды) на более или менее постоянном уровне. Многие морские беспозвоночные, кроме членистоногих, являются осмоконформерами, т.е. имеют то же осмотическое давление, что и морская вода. Большинство ракообразных и рыб являются гипоосморегуляторами, т.е. осмотическое давление их внутренней среде ниже давления морской воды, а в пресной воде – гиперосморегуляторами, т.е. внутреннее осмотическое давление их выше осмотического давления окружающей среды. Эвригалинные виды могут быть и гипо- и гиперосморегуляторами. Осмотическое давление их плазмы составляет величину в пределах 250-400 mOsm в любой среде. Стабильная осмотичность необходима для сохранения внутриклеточного ионного равновесия в частности – концентрации К+. Постоянство концентрации К+ необходимо для функционирования ферментов, участвующих в синтезе ДНК, РНК и белков. Такие условия создаются, когда результирующее осмотическое давление К+, Nа + и анионов составляет 300-400mOsm. Если осмотичность внешней среда не выходит из этих пределов, то участие органических соединений не является необходимым. Для поддержания соответствующего равновесия морские организмы выделяют избыток Nа+, а пресноводные – воду, поглощая натрий. Если осмотичность внутренней среды повышается, то происходит это за счет увеличения концентрации мочевины и аминокислот. Ртуть в виде хлорида ингибирует включение Nа+ жабрами пресноводных рыб. Ртуть в виде метилртути не накапливается в жабрах, проходя быстро в печень почки, и потому ее эффект на осморегуляцию сохраняется только в период нахождения рыб в растворе токсикакта. Другой осморегулирующий орган рыб – желчный пузырь. Для него отмечено также стабильное нарушение транспорта Ка+ от HgС2 и временное – при действии метилртути. Нарушение Nа+-К+ проницаемости и нарушение работы ионного насоса относят к определяющим путям токсического действия ртути.
Функциональные изменения проницаемости мембран при токсическом воздействии являются одним из симптомов состояния клетки, называемого "паранекрозом". Паранекроз сопровождается уменьшением дисперсности коллоидов цитоплазмы и ядра, увеличением вязкости цитоплазмы, которому в некоторых случаях предшествует ее уменьшение, повышение кислотности внутренней среды клетки. Все это связывают с обратимой денатурацией клеточных белков.
Неспецифическая реакция на воздействие проявляется в изменении вязкости цитоплазмы, изменении структуры элементов клетки (набухание митохондрий), сдвиге ионного баланса. В норме цитоплазма и ядро клеток не прокрашиваются витальными красителями. Прокрашиваются лишь мертвые включения. Раздражение, в том числе и токсическое воздействие, повышает прокрашиваемость цитоплазмы и ядра.
При возбуждении и обратимом повреждении клетки имеет место перераспределение минеральных веществ между клеткой и средой: ионы калия выходят из клетки, а ионы натрия и хлора поступают в клетку. После гибели клетки калий полностью выходит наружу. Так потеря клетками калия и поступление в них натрия описано при действии ядов, подавляющих дыхание и гликолиз.
Фосфорорганические соединения вызывают сокращение митохондрий, а ДДТ - их набухание за счет различий во влиянии на проницаемость мембран. Вещества, нарушающие проницаемость клеточных мембран и работы Na+-K+-насоса как правило, вызывают набухание и обводнение клеточных структур и тканей в целом. Структурные нарушения органелл, которые приводят к освобождению литических ферментов, завершаются лизисом клеток.
Некоторые металлы (Fe, Zn, Pb) обычно оседают в виде гранул в различных тканях гидробионтов, что также находит отражение в изменении структурных элементов клетки.
При действия некоторых ядов развивается анемия за счет подавления эритропоэза (ялан, севин, трихлорметафос) или усиления распада эритроцитов (диурон, пропанид, метилнитрофос, фенилгидразин, бертолетова соль, мышьяковистый водород), повышается число аномальных форменных элементов. Изменение количестве нейтрофилов и фагоцитов может служить специфической реакцией на токсическое воздействие.
Перспективно исследование эффектов токсикантов на ядерные структуры клеток гидробионтов является перспективной областью водной токсикологии. Установлена корреляция действующей концентрации токсиканта и количества хромосомных нарушений.
Изменения, обнаруживаемые на микроскопическом уровне, находят отражение в наглядных нарушениях. Продукты хлорирования сточных вод и другие агенты вызывают у рыб выделение слизи, особенно в жабрах, появление на жабрах признаков некроза, отслоение эпителия, что приводит к асфиксии и гибели. Детергенты, которые действуют преимущественно на жабры, вызывают ограничение газообмена. Нефть приводит к разрушению жабр, плавников, патологию печени. Медь в концентрации 0,5 мг/л вызывает обильное выделение слизи и гибели рыб в результате аноксии.
Фосфор вызывает вздутие тела и ерошение чешуи у рыб, пучеглазие, и является характерным признаком отравления рыб этим элементом.
Ртуть в малых концентрациях вызывает потемнение покровов рыб, у телялий губы и хвостовой плавник приобретали красный цвет.
У личинок хирономид при токсическом воздействии происходит деформация антенн. Характер изменений может зависеть от уровня воздействия.
У моллюсков при действии некоторых токсикантов отмечается деформация раковин.
В клетках водорослей при действии токсикантов различной природы отмечается прежде всего нарушение фотосинтетического аппарата. Обычно это сопровождается уменьшением содержания фотосинтетических пигментов и изменением структуры хлоропластов.
Процессы, находящие отражение в реакции целой ткани, уже оказываются интегральными, результатом взаимодействий многочисленных более частных нарушений. К другим интегральным ответам основных систем организма можно отнести изменения реакций поведения, роста, размножения и пр.
Влияние на поведение гидробионтов
В результате токсического воздействия изменяются реакции поведения водных животных. Изменения отражаются на общей двигательной активности, характере плавания, пищевых, оборонительных реакциях, нерестовом поведении, отношении к естественным факторам окружающей среды. Реакции, выявляющие нарушение поведения, могут быть сходными для гидробионтов из различных групп или носить элементы специфики.
Резко изменяется двигательная активность инфузорий при действии многих веществ. Изменение выражается в последовательных периодах возбуждения и угнетения движения, изменении формы тела. Олигохеты при действии фосфорорганических соединений прекращают волнообразные движения, хирономиды – прекращают строительство домиков и т.д. Разнообразны реакции на токсичность медицинской пиявки, которые выражаются в своеобразии принимаемых поз.
У рыб ртуть в летальных концентрациях вызывает гиперактивность, нарушение ориентации, потемнение покровов, перевертывание. При действии меди рыбы перемещаются к поверхности, отмечается гиперактивность с быстрыми движениями грудных и жаберных плавников, потеря равновесия.
Свинец вызывает потемнение, спорадические движения и потерю активности.
Раздражение эпителия жабр при действии токсикантов вызывает реакцию, называемую "кашлем" рыб.
Общее нарушение высшей нервной деятельности отражается в изменении условнорефлекторных реакций. Так у карасей металлы вызывают изменения условнорефлекторных реакций при концентрациях, в несколько раз ниже, полулетальных. Пестицыды фенитротион и севин в опытах на форели нарушали стайное поведение у рыб: стая рассредоточивалась, рыбы находились в угнетенном состоянии и держались на расстоянии друг от друга.
Известно, что в некоторых концентрациях загрязняющие вещества могут привлекать рыб, как это показано для низких концентраций щелочей, аммиака, солей меди. Растворенный хлор привлекал форелей при концентрации 0,1 мг/л, отпугивая при меньших и больших концентрациях.
Токсиканты изменяют способность гидробионтов реагировать на воздействие других факторов окружающей среды. В частности, показано изменение температурного преферендума рыб. Такая неадекватность реакций может иметь решающее значение в способности гидробионтов реагировать на изменение условий окружающей среды.
Токсичность и размножение
Влияние токсических агентов на размножение может развиваться разными путями. Повышение физиологической нагрузки токсикантом может уменьшать гаметогенез. Нарушение реакций поведения может подавлять нерест и заботу о потомстве. Присутствие токсиканта в среде можете снижать выживаемость спермы и яйца. В процессе развития эмбриона спектр повреждений может быть широким – от появления всякого рода морфологических аномалий (тератогенный эффект) до гибели эмбрионов и личинок.
При слабых токсических воздействиях наблюдается увеличение нерестового периода, как показано для моллюсков и морских ежей. Нарушение формирования половых клеток приводит к снижению их численности, задержке или преждевременному вымету. Влияние на процессы онтогенеза выражается в изменениях процессов дифференцировки и метаморфоза. Нарушаются формы и функции эмбриона. Наиболее чувствительны следующие периоды в развитии эмбриона: гаструляция, ранний органогенез, вылупление.
Высока чувствительность к токсическому воздействию на стадии клеточной пролиферации, когда формируется специализация клеток по будущим органам. В результате часто снижается выклев личинок. В отдельных случаях выклев может быть даже повышенным, но снижается выживаемость личинок.
Влияние на рост гидробионтов
Скорость роста определяется по изменениям размера, веса, интенсивности деления клеток. Скорость роста организма так же, как и рост культуры организмов, изменяется при токсических воздействиях.
Интенсивность деления клеток выражается через митотический индекс – долю делящихся клеток от общего их числа. В зависимости от концентрации и продолжительности действия токсиканта митотический индекс может временно возрастать или угнетаться. Устойчивое снижение индекса отражает торможение роста ткани.
Общее изменение массы и энергии организма находит выражение в понятии обмена. Обмен, связанный с ростом, называется пластическим обменом, который включает прирост, замену отмирающих клеток, отложение запасных веществ. Обмен, связанный с движением, называется энергетическим обменом.
При воздействии неблагоприятных факторов эти показатели могут изменяться и, прежде всего, нарушается пластический обмен, а энергетический обмен при этом может даже возрастать. Часть вещества и энергии расходуется на производство половых продуктов и это явление называется генеративным обменом. При подавлении пластического обмене усвоенное организмом вещество идет на покрытие жизненных трат организма. Половые клетки при этом могут вообще не образовываться, что выражается в снижении репродуктивности, измельчении популяции.
Подавление обмена приводит к снижению сопротивляемости организма к неблагоприятным факторам не только антропогенного, но и естественного характера. Периоды более интенсивного обмена вещества обычно соответствуют большей чувствительности организма к поврежденному агенту.
Отдаленные эффекты токсических веществ
К отдаленным последствиям относят такие эффекты токсических веществ, которые проявляются при длительном воздействии нелетальных концентраций токсикантов в водной среде. Такие последствия связывают, главным образом, с влиянием токсикантов или продуктов их превращения на наследственные структуры клеток. Последствия такого влияния могут выразиться в вида мутаций. Мутагенным действием обладают тяжелые металлы, нитриты, некоторые пестициды, промышленные растворители, полициклические компоненты нефти. Полициклические амины приобретают способность к взаимодействиям с ДНК, РНК и белкам после детоксикационного превращения в гидроксиламины и ортоаминофенолы, полициклические углеводороды – в виде эпоксидных метаболитов, алифатические диалкиднитрозамины за счет превращения в диазоалканы.
Мутации, возникающие при действии химических агентов, могут быть соматическими и гаметическими. Соматические мутации могут порождать новообразования в соматических клетках и, как итог, появление злокачественных и доброкачественных опухолей.
Гаметические мутации на протяжение поколений могут приводить к появлению морфологических и функциональных нарушений, снижающих выживаемость особей или их способность адаптироваться к условиям среды. Морфологические изменения могут принимать разнообразные формы: уменьшение размеров, снижение выживаемости потомства и т.д.
4. МЕТОДОЛОГИЯ ИХТИОТОКСИКОЛОГИИ
4.1. Биотестирование и биоиндикация
Основными методами водной токсикологии являются методы биотестирования и биоиндикации.
Биотестирование представляет собой методический прием, основанный на оценке действия фактора среды, в том числе и токсического на организм, его отдельную функцию или систему организмов.
При оценке биологического действия веществ, загрязняющих водную среду, интактные (in- отрицание) гидробионты или их сообщества специально вводятся в испытуемую среду. Таким образом, режим воздействия задается заранее.
Методы биотестирования могут быть применены для исследования общетоксикологических закономерностей, токсикологического нормирования, токсикологического контроля.
В зависимости от поставленной при проведении биотестирования задачи различными будут подходы к схеме постановки опыта и оценки результатов испытания.
Для исследования общетоксикологических закономерностей применяются разнообразные методы практически из любой сферы биологии и смежных научных областей. Обобщающей основой таких исследований оказывается воздействие химического агента на систему биологического происхождения. Это может быть биохимическая система, выделенный элемент клеточной структуры организма, различные показатели функции и структуры организма, интегральные характеристики организма, параметры, характеризующие состояние популяций, сообществ, организмов и экосистем. Активность переноса и трансформации токсического агента и последствия его действия определяются с применением химико-аналитических и биохимических методов, микроскопической, электрометрической техники, визуальными и вычислительными методами. Степень изменения каждого из параметров служит фактическим показателем токсического действия. Однако ценность каждого из показателей различна. Некоторые изменения со временем исчезают, значение параметра нормализуется. Изменение других хотя и сохраняется, для судьбы особи или популяции существенного значения может и не иметь.
Для целей токсикологического нормирования применяются системы организмов и их характеристик, отбираемых по строго обоснованным принципа. В схему должны быть включены представители таких групп гидробионтов, которые играют ведущую роль в общем круговороте вещества в водоеме. Сюда относятся организмы, ответственные за самоочищение, производящие первичную продукцию, осуществляющие трансформацию вещества и энергии в водных экосистемах – консументы и редуценты.
К группе организмов-редуцентов, ответственных за самоочищение, относятся микроорганизмы (бактерии, простейшие, грибы и пр.). Продуценты в водных экосистемах представлены водорослями и высшими водными растениями, организмы, поглощающие готовое органическое вещество, представлены консументами разного уровня (зоопланктон, зообентос, рыбы). Очень важным элементом с точки зрения токсикологического контроля среды являются организмы, имеющие стадийность в своем развитии, которые характеризуются различной чувствительностью стадий. В результате один вид как будто распадается на группу организмов, обладающих разной чувствительностью.
Помимо живых организмов составной частью водной экосистемы является совокупность параметров, характеризующих качество среды. Прежде всего сюда относятся гидрохимические параметры, в том числе и интенсивность убывания концентрации самого токсического вещества.
Для целей токсикологического нормирования необходимо выбрать наиболее важные функции и структурные элементы, нарушение которых влечет за собой изменения в популяциях и сообществах. Основными показателями токсического эффекта оказываются такие, которые помогают определить судьбу организма, популяции и экосистемы при данном химическом воздействии. Эта судьба прежде всего определяется выживаемостью гидробионтов и качеством их потомства. Исследования параметров должны дать ответ на вопрос о том, насколько токсично данное вещество для организма, какие нарушения происходят в организме и в биосообществах водоемов, при каких максимальных концентрациях вещество не оказывает изменений у гидробионтов.
Определение растворимости вещества, его устойчивости в водной среде и свойства его остатков. Определение проводится с применением химико-аналитических методов, наиболее удобных для данного исследования. Наблюдение за раствором продолжается не менее 30 суток. На основании получаемых данных рассчитывается срок разрушения 95% вещества.
Устойчивость вещества может быть определена по токсичности заданной концентрации (LC50 за 24 часа) для культуры гидробионтов, например, дафний. Это исследование позволяет оценить остаточную суммарную токсичность вещества и продуктов его превращения.
Опыты проводятся
при стабильной температуре в стеклянных
кристаллизаторах, заполненных
профильтрованной водой из чистого

 водоема
куда вносится пептон из расчета 3 мг/л.
Вредным считается действие токсиканта,
вызывающее отклонение от контроля
значения рН более, чем на 1,5 единиц,
уменьшение содержания кислорода до 2
мл О2/л, снижение численности сапрофитов,
количества нитратов или нитритов, более,
чей на 25%.
водоема
куда вносится пептон из расчета 3 мг/л.
Вредным считается действие токсиканта,
вызывающее отклонение от контроля
значения рН более, чем на 1,5 единиц,
уменьшение содержания кислорода до 2
мл О2/л, снижение численности сапрофитов,
количества нитратов или нитритов, более,
чей на 25%.
Исследования на водорослях проводятся главным образом с использованием видов зеленых водорослей, относящихся к родам хлорелла или сценедесмус и сине-зеленых водорослей рода микроцистис. Опыт, который продолжается до 35 суток, ставится с культурой на соответствующей питательной среде при стабильной температуре (19-20°), в колбах 0,5-0,8 мл при 12-часовом световом дне с интенсивностью освещения 3-5 тыс. люкс.
В процессе опыта проводится визуальное наблюдение за общим состоянием культуры, изменением окраски и прозрачности культуры, изменением численности клеток водорослей путем просчета в камере Горяева, изменением интенсивности фотосинтеза кислородным или радиоуглеродным методом, определение живых и мертвых клеток водорослей методом люминесцентной микроскопии, определение pH среды.
Допустимыми считаются отклонения биологических параметров от значений в контроле, не превышающие 25%.
В качестве представителей высшей растительности для токсикологических исследований обычно используется ряска и элодея. По ряду причин преимущество отдается элодее. Опыты на элодее проводятся также в течение 30 суток в кристаллизаторах емкостью 1 л при температуре 17-22° при естественном или искусственном освещении не менее 1500 лк. В процессе опыта учитываются общее состояние растений изменение окраски, повреждение точек роста, потеря тургора, прирост основного побега в длину, число и длина отростков и корней.
Простейшие являются важным компонентом водных экосистем, участвующим в процессах самоочищения водоемов и выступающим в роли кормового объекта. Чаще других в лабораторной практике используются инфузории (Paramecium caudatum). Парамеции могут быть собраны в водоеме и разведены в культуре на минеральной среде в колбах по 25-50 мл при стабильной температура. Кормом служат водоросли или бактерии из культуры. Продолжительность хронических наблюдений не превышает 15 суток. Учитываются выживаемость и размножение. Дополнительно могут быть учтены активность движения, скорость фагоцитоза по среднему числу пищеварительных вакуоле.
Допустимыми концентрациями считаются такие, в которых выживаемость и размножение не отличаются статистически достоверно от контроля.
Из организмов зоопланктона в токсикологической практике наиболее распространены дафнии. Рачки легко культивируются и исследуются. Кормом служат зеленые водоросли, пекарские или кормовые дрожжи, культуры бактерий. Опыты ставят в стаканах емкостью 200 мл, куда помещаются по 10 экземпляров дафний. Продолжительность опыта зависит от числа поколений, за которыми ведется наблюдение. Три поколения обычно занимают срок в 45 дней.
Основными тест-функциями в опыте служат выживаемость, общее состояние рачков, поведение, движение органов. Регулярно просчитывается партеногенетически народившаяся молодь и ее морфологические признаки. Подобные наблюдения проводятся, по крайней мере, за тремя поколениями дафний. Учитываются также скорость созревания, темп размножения, периодичность линек, отражающая скорость роста рачков. В качестве вспомогательных показателей токсичности учитываются скорость сердцебиения и пульсация ножек.
Личинки хирономид относятся к организмам бентоса и их исследование представляет интерес, так как многие токсические вещество в водной среде осаждается или адсорбируются донным грунтом, где создаются повышенные концентрации агента. В токсикологических опытах используются личинки размером 3–4 мм (мотыль), подкармливаемые дрожжами. Опыт ставится в чашках Петри. Учитываются основные показатели выживаемость, сроки окукливания, сроки выхода и процент выживших комаров, доля уродливых особей. Дополнительными показателями служат изменения внешнего вида и окраски личинок, иx поведения и веса, активности имаго. Подобные исследования занимают срок до 30 дней.
Другим представителем группы организмов бентоса служит прудовик Limnaсa stagnalis. При содержании и культивировании в лаборатории моллюсков кормят листьями одуванчика или капустой. Содержат в кристаллизаторах объемом 2–3 л по 3–5 экземпляров. Продолжительность хронических опытов до 60 суток. Показателями состояния организма служат реакция поведения, интенсивность потребления корма, выживаемость, появление первых кладок и их размер по числу яиц, количество вылупившейся молоди. Учитывается также чувствительность ноги при механическом воздействии, характеристики эмбриогенеза, размер раковины, вес тела и раковины.
Критерием токсического действия является снижение выживаемости моллюсков и эмбрионов на 15–25% по сравнению с контролем.
Рыбы являются основным промысловым объектом, лучше других пресноводных организмов изученным на разных стадиях развития.
Для токсикологических исследований используются холодноводные виды, собранные в природных водоемах и адаптированные к лабораторным условиям. Содержатся рыбы в большом объеме воды или в условиях аэрации при концентрации кислорода около 10мг/л. Кормление осуществляется живым или гранулированным кормом. В процессе опыта учитываются выживаемость, прирост, поведение и реакции на раздражители, характер дыхательных движений, внешний вид и состояние внутренних органов (при вскрытии). Из дополнительных показателей заслуживают внимания гематологические характеристики (содержание гемоглобина, количество эритроцитов, РОЭ, подсчет лейкоцитарной формулы, эритропоэз), гистологические и гистохимические показатели тканей органов. Дополнительный органолептический тест заключается в дегустационной оценке запаха и вкуса вареного мяса рыб, находившихся в разных концентрациях испытуемого вещества, и бульона. Изменение запаха и вкуса оценивается по 5-балльной системе. Продолжительность наблюдений - до 90 дней.
Особым вниманием токсикологов, пользуются эмбрионы рыб. Опыты с икрой ставятся в чашках Петри. При наблюдении учитываются темп развитая и дробления, количество оплодотворенных яиц, гибель эмбрионов, гибель предличинок, количество аномалий развития на разных стадиях. Продолжительность наблюдения зависит от специфики вида. В качество допустимой для эмбрионов рыб принимается такая концентрация, при которой развиваются личинки, не отличающиеся достоверно от контрольных по морфофункциональному состоянию.
Помимо указанных в схеме объектов могут дополнительно исследоваться токсикологические эффекты на другие виды, такие, как малощетинковые черви, коловратки, двухстворчатые моллюски, рачки циклопы.
В результате проведеннных по стандартной схеме исследований выявляются концентрации, признаваемые в качестве допустимых для каждого из параметров исследовавшихся гидробионтов. Все допустимые концентрации сводится в таблицу. Наименьшая из отмеченных концентраций рекомендуется в качестве предельно допустимой.
Для оценки токсичности сточных вод в загрязняемых водоемах в целях здравоохранения применяются методы токсикологического контроля. В этом случае водный организм или объект фактически является заменителем химического индикатора или аналитического датчика. В отличие от подходов токсикологического нормирования, где основной задачей является сохранение благополучия всех организмов, включенных в схему, в токсикологическом контроле наряду с чувствительностью tect-функции предъявляется требование быстроты ответа.
Для оценки токсичности растворов и сред используются инфузории, дафнии, кишечнополостные, микроорганизмы. Рекомендованы и другие объекты, например, пиявки, моллюски, рыбы. Применение этих организмов некоторых случаях позволяет проводить качественно-количественный анализ растворов.
В сточных водах предполагается относительно высокое содержание действующего вещества, поэтому действие может быть отнесено к острым.
Наиболее оперативными показателями токсического действия служат поведение и выживаемость. Например, дафнии в токсической среде изменяют характер передвижения, оседают на дно. Оседание предшествует параличу и гибели. Двустворчатые моллюски закрывают створки, стремясь изолироваться от загрязненной среды, а при острых отравлениях перестают реагировать на прикосновение. Рыбы при появлении токсичности также изменяют характер передвижения, локализуясь у поверхности, теряют равновесие. Характерной реакцией на раздражение жабр оказывается "рыбий кашель".
Одиночные виды или показатели могут быть использованы, в том случае, если соотношение химических компонентов в растворе известно и остается постоянным во времени, а для самого показателя известна активность ответных реакций от концентрации. Если же соотношение компонентов в стоке изменчиво или его состав неизвестен, то необходимо постоянное использование нескольких организмов и показателей, так как в растворе может появиться компонент более токсичный для одного или другого гидробионта.
Биоиндикация представляет собой выявление уже состоявшегося неуправляемого загрязнения водоема по функциональным показателям его обитателей или по экологическим характеристикам сообществ.
Биотестирование природных вод должно проводиться с применением достаточно чувствительных объектов из лабораторных культур или заведомо чистых водоемов. Так как при загрязнении природных вод высокий уровень токсичности должен быть исключен, то степень воздействия будет приближаться к тому, что имеет место в токсикологическом нормировании. В связи с этим и оценку токсичности следует проводить с применением тех же организмов и показателей, что используются в нормировании. Основные трудности, возникающие при подобных исследованиях, связаны с проявлением парадоксальных явлений. Зачастую низкие уровни токсикантов вызывают эффект стимуляции функций у гидробионтов, в частности у дафний. Очевидно, при биотестировании природных вод следует обращать внимание не только на угнетение, но и на стимуляцию жизненных функций гидробионтов.
Указанные формы биотестирования основаны на учете проявлений токсикодинамики. Однако в последнее время возрастает значение и показателей токсикокинетики, в частности, исследуются закономерности накопления и распределения веществ в тканях гидробионтов.
Определение содержания загрязняющих веществ и их остатков в тканях гидробионтов дает возможность выявить загрязнение экосистем, если концентрации веществ в воде лежат ниже порога чувствительности метода. Сохранение веществ в тканях позволяет определить уже происшедшее ранее загрязнение, а сопоставление его содержания в разных организмах оценить склонность к накоплению. Наиболее приемлемыми объектами для целей химико-аналитического мониторинга загрязнения служат оседлые организмы (водные растения, моллюски, усоногие раки) или организмы высшего трофического уровня (хищные рыбы, водоплавающие птицы).
Таким образом, методы биоиндикации в системе мониторинга нацелены на оценку тенденций в экологических последствиях загрязнения водоемов. Биоиндикация преимущественно производится по оценке видового состава сообществ для определения общеэкологической ситуации в водоеме, сложившейся в относительно отдаленное время после загрязнения. Применение же методов биотестирования для целей мониторинга может дать сведения только о загрязнении, происходящем в момент взятия пробы.
4.2. Методы диагностики отравления рыб
Отравления рыб диагностировать очень сложно, так как они часто возникают внезапно, протекают в быстро изменяющихся условиях среды, проявляются недостаточно специфичными признаками.
При подозрении на отравление необходимо решить ряд вопросов: произошла ли гибель рыб от токсикоза или от заразного заболевания, от действия неблагоприятных факторов среды, от недоброкачественного кормления и т. п.; от чего и когда наступила смерть животных; каким отравляющим веществом вызвана гибель рыб; каким путем оно попало в водоем и организм; какие факторы способствовали отравлению рыб; известны ли подобные случаи из практики или специальной литературы? Ввиду разнообразия обстоятельств отравления круг вопросов может быть расширен. Чтобы получить максимально полные сведения, диагностику отравлений осуществляют комплексно по следующей схеме:
общее обследование водоема и выявление источника загрязнения;
изучение и оценка клинической картины отравления;
патологоанатомическое вскрытие рыб;
биологические и органолептические исследования;
лабораторные исследования;
оценка результатов комплексных исследований и заключение.
Обследование водоема и выявление источника загрязнения. В случае массовой гибели рыб проводят комиссионное обследование водоема (рыбоводного хозяйства) с участием специалистов ветеринарной и ведомственной ихтиопатологической службы, органов рыбоохраны, водного хозяйства, санэпидемстанции и представителей местной власти. Его начинают с опроса очевидцев, осмотра акватории и берегов водоема, анализа имеющейся документации о масштабах материального ущерба, данных по гидрологии, гидробиологии водоемов и т. п. При этом определяют участки и места концентрации больных и погибших рыб, уточняют время появления болезни и характер ее течения, видовой и возрастной состав заболевших рыб и других гидробионтов. Визуально оценивают состояние водоема, его дна, береговой зоны, степень зарастания.
На месте определяют температуру, рН, прозрачность, запах, окраску воды, содержание в воде кислорода и двуокиси углерода, а также проводят клинические наблюдения и патологоанатомическое вскрытие больных и погибших рыб. Берут пробы воды, рыбы, грунта и других объектов для химико-токсикологических исследований. Уточняют наличие промышленных предприятий, коммунально-бытовых, сельскохозяйственных объектов, сбрасывающих сточные воды в водоем. Собирают сведения о масштабах, ассортименте и сроках применения пестицидов и удобрений в сельском и лесном хозяйствах.
При необходимости обследуют подозреваемые источники загрязнения. От технологов на промышленных предприятиях получают данные о количестве и химическом составе сточных вод, проверяют надежность работы очистных сооружений и чистоту сбросных вод, используя материалы ведомственных химических лабораторий и бассейновых инспекций. Для расчета степени разбавления и установления зоны распространения вредных веществ, возможности сноса и смыва ядохимикатов и удобрений пользуются сводками гидрометеослужбы об уровне, направлении и скорости течения воды, ветровых волнениях водоема, температуре воздуха и воды, осадках и т. д. Учитывают время и места кормовых и нерестовых миграций рыб. Эти сведения позволяют определить условия, способствовавшие отравлению, и объяснить причины массового поражения того или иного вида рыб, возрастной их группы.
Клинический осмотр отравленных рыб проводят по схеме, принятой в ихтиопатологии. Осматривают 50–100 экземпляров рыб, а затем выборочно вскрывают 15–20 штук каждого вида и возраста.
В первую очередь изучают поведение рыб в естественном водоеме или в аквариуме, учитывают реакцию рыб на внешние раздражители, положение тела в воде, подвижность и координацию движений, наличие спазмов мускулатуры и судорог, частоту и ритм дыхания и т. д.
Многие отравления клинически могут протекать сходно с рядом других заболеваний. Поэтому для их дифференциации важное значение имеют последовательность возникновения, определенное сочетание и выраженность симптомов, а также характер течения болезни.
Острые отравления возникают внезапно, характеризуются кратковременным течением, массовой гибелью разных видов и возрастных групп рыб, ракообразных, лягушек, моллюсков и других гидробионтов. Кривая смертности рыб имеет характерную (языкообразную) форму с крутым подъемом в начале (первые 2–3 суток) и пологим спуском в последующие 10–30 суток интоксикации.
По тяжести проявления симптомов условно различают легкую, среднюю и тяжелую степень острого отравления. При легком течении (начальной стадии) интоксикации симптомы слабо выражены, отмечают нарушение возбудимости, ориентации рыб в воде, замедление или ускорение плавания, изменение частоты дыхания, «кашель».
Средняя степень (стадия иммобилизации) отличается бурным проявлением типичных признаков отравления: потерей равновесия, нарушением координации движения (плавание в боковом положении, по кругу, по спирали, и т. п.), тремором мускулатуры и судорогами.
Тяжелая степень (агония) характеризуется угнетением, полной депрессией, потерей рефлексов, замедлением движения, опусканием на дно и гибелью рыб.
Хронические отравления протекают длительно в стертой, иногда бессимптомной форме, сопровождаются постепенной гибелью отдельных рыб. Отмеченные выше симптомы появляются в отдаленные сроки и незначительны. Рыбы перестают питаться, теряют массу, отстают в росте и развитии, ослабляется их устойчивость к инфекционным и инвазионным болезням, а также неблагоприятным факторам среды.
При хронических отравлениях рыбы отличаются низкой упитанностью, обшей анемией и мышечной гидратацией, побледнением и атрофией печени и других органов.
Важное место в диагностике токсикозов занимают гематологические и биохимические показатели, отражающие избирательное действие ядовитых веществ. Так, для отравления фосфорорганическими и частично карбаматными пестицидами характерно сильное угнетение активности ацетилхолинэстеразы (АХЭ) крови и головного мозга рыб. Производные мочевины (диурон, монурон), гербициды вызывают гипохромную или гемолитическую анемию, а нитриты – метгемоглобинемию. Тяжелые металлы блокируют функциональные сульфгидрильные группы (SH-группы) ферментов с образованием соответствующих сульфидов. Неспецифические изменения в морфологическом составе крови, содержании сахара и гликогена, общего белка используют для диагностики в том случае, если они закономерно повторяются и носят стабильный характер.
Патологоанатомическое исследование включает в первую очередь количественный учет трупов рыб и других гидробионтов. При внешнем осмотре устанавливают вид, возраст рыб, регистрируют основные изменения внешних покровов и естественных отверстий. По трупному окоченению и степени разложения судят о времени гибели рыб. Следует иметь в виду, что большинство трупов рыб находятся на дне и там разлагаются. Всплывшие трупы прибиваются ветром к берегам, а больные рыбы являются легкой добычей для рыбоядных птиц. Замечено, что у окуневых рыб трупное окоченение наступает быстро, они всегда лежат брюшком вверх с широко раскрытым ртом и жаберными крышками. Карповые, наоборот, находятся на боку, рот и жаберная полость прикрыты.
При отравлении ядами нервно-паралитического действия (пестициды и др.) трупное окоченение наступает гораздо быстрее и сильнее выражено, чем веществами местно раздражающего и наркотического действия. С повышением температуры воды разложение трупов ускоряется, что затрудняет правильную оценку морфологических изменений. Многие отравления рыб сопровождаются повышением секреции слизи на коже и жабрах. Однако механизм этого процесса и состояние слизи бывает неодинаковым. Так, кислоты и тяжелые металлы способны коагулировать слизь, она становится густой, творожистой, плохо отделяется. Щелочи, соли щелочноземельных металлов, аммиак разжижают ее, в результате чего она быстро смывается, происходит истощение ее запасов и поверхность тела становится суховатой, а чешуя шероховатой.
Дифференцированно следует подходить и к оценке точечных, пятнистых и полосчатых кровоизлияний на туловище, плавниках, жаберных крышках, глазах; их обнаруживают не только при отравлениях, но и ряде других болезней. Так, серповидные кровоизлияния на склере глаз служат одним из признаков асфиксии. Выраженное пучеглазие, ерошение чешуи, брюшная водянка встречаются только при некоторых токсикозах смешанного характера, например при токсической водянке. В этих случаях отмечено помутнение, изъязвление и прободение роговицы глаза. В то же время многие резорбтивные яды (пестициды и др.) не вызывают существенной местной реакции.
Жабры являются важнейшим органом всасывания и выведения ядовитых веществ из организма рыб. Различные токсиканты оказывают на жабры рефлекторное и раздражающее действие. Поэтому к постоянным компонентам большинства токсикозов рыб относят различные формы нарушения кровообращения в жаберном аппарате: застой крови, цианоз, кровоизлияния, анемия, токсический отек. Микрокартина проявляется отслоением и набуханием респираторного эпителия, гипертрофией и пролиферацией слизистых и хлоридных клеток, дистрофией эпителия, что приводит к утолщению лепестков, сглаживанию рисунка, увеличению объема и дряблости жабр, выпячиванию их из-под жаберных крышек. Вещества локального действия в высоких концентрациях вызывают диффузную десквамацию эпителия и некроз ткани. При хроническом отравлении некоторыми веществами (например, аммиаком) наблюдается очаговый некроз жабр.
При вскрытии брюшной полости обращают внимание на ее содержимое, топографию и внешний вид органов, их консистенцию, размеры, степень кровенаполнения, окраску крови, серозных и слизистых оболочек, а также наличие запаха того или иного химического вещества.
В брюшной полости при острых отравлениях нередко обнаруживают прозрачный транссудат, иногда с примесью крови. Брюшина и серозные покровы органов отечны, под капсулой просвечивают инъецированные сосуды и изредка встречаются мелкоточечные кровоизлияния. Внутренние органы, особенно печень и почки кровенаполнены, темно-красного цвета, дряблой консистенции, селезенка не увеличена, темно-вишневого цвета. Околосердечная полость, венозный синус и предсердие нередко (например, при действии пестицидов) сильно переполнены свернувшейся кровью. Заметные изменения в слизистой кишечника наблюдают только при поступлении ядов перорально. В головном мозге обнаруживают отек и дистрофию нейронов, застойную гиперемию.
Поскольку патологоанатомические изменения недостаточно специфичны, а лишь ориентируют на наличие отравления, то для их уточнения и более достоверной оценки проводят гистологические исследования. Это дает возможность дифференцировать отравления от патологических процессов, вызванных другими причинами, а также различать формы токсикозов.
Биологические исследования. Косвенным указанием на наличие отравления могут служить данные гидробиологических исследований: изменение биомассы планктона и бентоса, нарушение поведения и гибель беспозвоночных, исчезновение из биоценоза некоторых видов животных и растений. Например, к инсектоакарицидам очень чувствительны водные ракообразные (дафнии, циклопы) и личинки насекомых; к гербицидам — высшие водные растения; к альгицидам — водоросли и т. д. Поэтому они могут служить тест-объектами для установления загрязнения водоема соответствующими токсикантами.
Для доказательства токсичности загрязненной водной среды ставят биопробы непосредственно в водоемах («рыбная проба») – в делевых садках. Последние устанавливают в водоем, помешают в них чувствительных к токсикантам рыб (окунь, ерш, форель и др.) и ведут наблюдения за их поведением. Подобное исследование можно провести в аквариумах или бассейнах, заполнив их водой из водоемов, сточной водой в разных разведениях и др.
Токсичность нативного патологического материала или экстрактов ядов из органов рыб определяют на лабораторных животных (рыбах, мышах, крысах, кошках, лягушках, насекомых) путем скармливания, парентерального введения или прямого контакта с материалом. Выбор животных и методика постановки биопробы зависят от характера предполагаемого ядовитого вещества. Например, при подозрении на пестицидное загрязнение опыты ставят на комнатных мухах, дрозофилах, комарах, используя следующие методы.
Метод сухой пленки. Пестициды извлекают из исследуемого объекта ацетоном. Экстракт фильтруют в чашку Петри, испаряют и в чашку помещают 20- 30 насекомых. Появление у них нервно-паралитических явлений и отсутствие их у контрольных указывает на наличие ядохимикатов.
Метод кормления. Внутренние органы отравленных рыб растирают в ступке с сахарным песком и скармливают насекомым. Проба считается положительной, если все насекомые погибают с типичными признаками судорог и параличей.
Метод водных взвесей заключается в выдерживании (экспонировании) комаров, дафний, циклопов, инфузорий или рыб в водных суспензиях органов.
Органолептические исследования основаны на свойстве многих химических веществ издавать запахи, которые определяют по пятибалльной шкале. Концентрации большинства сильно пахнущих веществ, оцениваемых органолептически, как правило, находятся на уровне или ниже границы, при которой эти вещества оказывают токсический эффект. Это обстоятельство весьма важно не только для диагностики отравлений, но и для ветеринарно-санитарной экспертизы рыбы.
Исследование рыбы на наличие постороннего запаха и привкуса проводят пробой варки. Желательно установить запахи в мясе и внутренних органах рыб, проваривая их вместе или раздельно. Берут около 100 г мелко нарезанных кусочков непотрошеной рыбы или отдельно мяса и внутренних органов, заливают двойным количеством воды и кипятят до 5 мин в колбе, прикрытой стеклом. После закипания воды проверяют запах, приподнимая стекло, а в конце пробы оценивают запах, привкус и прозрачность бульона. По специфическому запаху можно обнаружить фенол и его производные (хлорфенолы), нефть и продукты ее перегонки (бензин, керосин, соляровое масло и др.), смолы и дегти, канифоль, терпены, камфору, тимол, ментол, эфирные масла, смоляные кислоты, альдегиды (формальдегид, параформ, метальдегид), хлор- и фосфорорганические пестициды и др.
Метод условных рефлексов. Данный метод предложен В. II. Лукьяненко и Б. А. Флеровым. Суть метода: исследование условнорефлекторной активности рыб при воздействии токсических веществ. Достоинства: используются новые стороны жизнедеятельности организма, высокая чувствительность, возможность установления ПДК для нервных ядов. Недостатки: нет критерия биологической нормы.
Метод рыбной пробы. Метод предложен Я. Я. Никитским и В. И. Долговым в 1913 г. Суть метода: рыб помещают в раствор с заданным количеством испытуемого вещества и держат ее до гибели. Достоинства метода: скорость, простота, дешевизна, возможность получить, хотя и приблизительные, сведения о токсичности среды. При этом возможно менять концентрацию вещества и время эксперимента. Недостатки: не дает сведений о хроническом влиянии малых концентраций, так как учитывается преимущественно острое отравление. Не позволяет определять ПДК токсиканта.
Физиолого-биологический метод (разработан Н. С. Строгановым и др., 1937—1967 гг.). У гидробионтов определяют выживаемость, питание и рост, газообмен, показатели крови, дыхательный и сердечный ритм, размножение и выживаемость молоди, плодовитость и качество потомства.
Достоинства метода: получается разносторонняя информация о нарушениях основных жизненных функций организма. Акцент на обмен веществ и тесно связанные с ним размножение, плодовитость и качество потомства.
Лабораторные исследования. Важнейшим условием получения достоверных результатов исследований является правильный и своевременный отбор материала для исследования.
4.3. Методика сбора материала для лабораторных исследований при подозрении на отравление рыб
При обнаружении гибели рыб в водоемах работники рыбоохраны, специалисты, обслуживающие рыбохозяйственные водоемы, должны немедленно сообщить вышестоящим учреждениям о гибели рыб и квалифицированно провести отбор проб воды, грунта, планктона и рыб и немедленно отправить их в соответствующие учреждения для анализа.
Отбор проб воды является важным и ответственным этапом исследования. Ошибки, допущенные при взятии проб, могут совершенно обесценить дальнейшую работу и привести к неправильной оценке. Пробы воды надо брать так, чтобы образец соответствовал составу всей массы исследуемой воды.
Пробы воды в реках отбирают на расстоянии 1–2 м от берегов и на середине реки на быстринах, перепадах, водосбросах и водоспусках. При отборе проб необходимо исключить элементы случайности (временная взмученность воды, поверхностный слой воды со случайными загрязнениями). Пробы следует брать с поверхностных (30–50 см от зеркала воды) и глубинных слоев. Для взятия глубинных проб воды применяют батометры различных конструкций. Наиболее распространенным является батометр Рутнера. Отбор проб из стоячих вод (озер, прудов и водохранилищ) проводят в различных местах и на различных глубинах, пользуясь для этого глубинными пробоотборниками.
Отбор сточных вод. Состав промышленных сточных вод зависит от хода процессов на заводе. Поэтому однократного взятия пробы воды обычно недостаточно. Берут среднюю смешанную пробу (за час, смену, сутки). Объем пробы зависит от числа определяемых компонентов. Для полного анализа следует брать 2 л воды.
Основную пробу берут обычно в бутыли емкостью 2 л. Основным условием при взятии проб воды является чистота тары и пробки. Посуду следует предварительно тщательно вымыть. Стеклянные и полиэтиленовые бутыли моют концентрированной технической соляной кислотой; для обезжиривания используют синтетические моющие вещества. После этого посуду ополаскивают дистиллированной водой. Прежде чем взять пробу, посуду следует ополоснуть несколько раз водой, подлежащей отбору.
Склянки для взятия пробы на кислород объемом 100–150 мл должны быть обязательно с притертыми пробками. Заполняют склянки исследуемой водой следующим образом: резиновую трубку от батометра опускают до дна склянки и заполняют ее водой, не допуская попадания пузырьков воздуха.
Каждая проба воды должна быть снабжена этикеткой, на которой указывают место и время, глубину, горизонт взятия пробы, температуру воды, фамилию и должность лица, проводившего отбор.
В зимнее время при транспортировке проб необходимо предусмотреть их утепление.
Для получения достоверных данных гидрохимического анализа отобранных проб воды исследование должно быть проведено как можно скорее. Ряд определений желательно выполнить на месте: запах, привкус, содержание кислорода, наличие сероводорода, углекислоты, активная реакция среды, кислотность, так как эти показатели могут со временем заметно измениться. Если при пересылке проб воды в лабораторию в теплое время потребуется свыше суток, то рекомендуется пробы воды консервировать.
Консервирование проб. Пробу на кислород в количестве 30–50 мл фиксируют, вливая в нее 1 мл хлористого марганца и 1 мл щелочного раствора йодистого калия. Склянку закрывают плотно пробкой и тщательно перемешивают 25–30 раз. Затем ставят в темное прохладное место. Не позднее чем через сутки следует провести анализ.
Пробу на БПК (биохимическое потребление кислорода) в количестве 30—50 мл берут в склянку из темного стекла, закрывают, держат при температуре 20° в течение 5 суток, после чего фиксируют 1 мл хлористого марганца и 1 мл щелочного раствора йодистого калия и исследуют.
Пробы для определения взвешенных веществ, нитритов, нитратов, фосфатов консервируют, добавляя 2 мл хлороформа на каждый литр, после чего воду хорошо взбалтывают.
Пробы для определения аммиака и хлоридов консервируют 2 мл 25%-ной серной кислоты на 1 л.
Пробы на фенолы при концентрации его ниже 0,5 мг/л не консервируют, при более высокой концентрации прибавляют 4 мл 20%-ной NaOH на 1 л. Исследование следует проводить в течение 48 часов.
Пробы на фториды и хлориды отбирают в полиэтиленовые бутыли и консервируют 2–4 мл хлороформа на 1 л.
Пробы на цианиды консервируют щелочью до рН 11. Пробы, содержащие цианиды, нельзя консервировать кислотами.
Пробы на тяжелые металлы отбирают в бутыли из белого стекла или полиэтиленовые бутыли и консервируют 2–5 мл хлороформа. Пробу на магний не консервируют.
Пробы на железо консервируют, добавляя 5 мл азотной кислоты на 1 л воды. Для определения различных форм железа пробы консервируют ацетатным буферным раствором.
Пробы на анионоактивные синтетические моющие средства (детергенты) консервируют 2–4 мл хлороформа на 1 л воды.
Пробы на нефтепродукты не консервируют.
Пробы на ядохимикаты. При подозрении на пестицидное загрязнение водоема пробы воды берут с разных участков водоема у берегов. Их не консервируют и исследуют в течение суток. В сопроводительном письме указывают вид применяемого пестицида, сроки, кратность и масштабы применения.
Отбор проб грунта. Кроме проб воды, из водоема следует взять пробы грунта. Берут их в количестве 2 кг с поверхности дна дночерпателем Экмана или Кирпич-никова. Затем высушивают на воздухе, растирают в ступке, просеивают через мелкое сито и упаковывают в широкогорлые банки или полиэтиленовые мешочки в количестве 500 г воздушной сухости.
Отбор проб на планктон. Планктон, так же как и грунт, способен кумулировать ряд токсических веществ: соли тяжелых металлов, пестициды и прочие соединения.
Для получения планктона воду в количестве 50–100 л фильтруют через планктонную сетку «мельничный газ» и собирают его.
Рыба. Для исследования пригодна исключительно свежая рыба. Больных или погибших рыб (не менее пяти экземпляров каждого вида), предназначенных для химико-аналитического исследования, доставляют в лабораторию по возможности живыми или недавно погибшими. Для контроля обязательно берут того же вида и возраста рыб из благополучного водоема. Если доставить свежих рыб невозможно, то их консервируют 96°-ным этиловым спиртом. Консервировать материал (рыб) формалином, глицерином, карболовой кислотой, сулемой, денатурированным спиртом и другими веществами нельзя. Вместе с пробами высылают 50–100 г спирта, которым консервировали материал.
Каждый экземпляр рыб снабжают этикеткой с подробными сведениями о месте и времени вылова или гибели.
Весь взятый для исследования материал: пробы воды, грунта, планктона и рыб упаковывают в тару, опечатывают и вместе с актом обследования водоема и направлением высылают нарочным в соответствующее учреждение. Химический анализ может быть проведен только на строго определенное вещество, в крайнем случае – на группу веществ.
4.4. Стандартная схема ихтиотоксикологических исследований. Метод функциональных нагрузок
Многообразие задач, стоящих перед ихтиотоксикологией, и методов их решения приводит к необходимости принятия унифицированной схемы проведения ихтиотоксикологических исследований для получения возможно более полного объема информации и сопоставимых данных по токсичности попадающих и водоемы веществ и определения их ПДК.
В основу такой стандартной схемы ихтиотоксикологического эксперимента положены три последовательно проводимые опыты: острый, подострый и хронический.
Острый опыт. Проводится для предварительной оценки степени токсичности исследуемого вещества и остро токсичной (явно не допустимой) концентрации вещества, поступающего в рыбохозяйственный водоем. Оценка токсичности вещества проводится методом рыбной пробы. Показателем токсичности служит гибель подопытных рыб. При постановке острого опыта необходимо подробно описывать поведение и внешние симптомы отравления рыб данным веществом или группой веществ. После гибели рыб подвергают патоморфологическому обследованию.
При описании результатов острого опыта указываются температура токсического раствора, содержание в последнем кислорода, жесткость и pH воды, а также вид, возраст подопытных рыб, их функциональное состояние и длительность адаптации к экспериментальным условиям. Для пресноводных рыб опыт целесообразно проводить при относительно высокой температуре раствора и относительно низком содержании в нем кислорода, учитывая их естественные колебания в естественном водоеме.
В качестве тест-объекта следует использовать наиболее устойчивый вид рыб ихтиофауны данного водоема.
Продолжительность острого опыта обычно составляет 24 часа. Испытание каждой концентрации вещества целесообразно проводить на одинаковом количестве рыб ( не менее 10 экз.)
Подострый опыт. Ставится для выявления путей действия токсиканта на рыб и механизмов развития отравления организма с тем, чтобы выбрать адекватный метод определения пороговой концентрации исследуемого вещества в хроническом опыте.
Используют обычно концентрации, составляющие 0,5-0,1 летальной концентрации, установленной в хроническом опыте. Опыт проводится на наименее устойчивом виде рыб. Длительность опытов от 10 до 30 сут. Поскольку токсикодинамика исследуемого вещества не известна, проводят исследования показателей, интегрально отражающие состояние организма. Такими показателями являются: прирост живой массы, уровень пищевой возбудимости и интенсивность потребления кислорода, физиолого-биохимические исследования белкового, углеводного и жирового обмена, активность важнейших ферментативных систем, электрофизиологические тесты, характеризующие состояние центральной нервной, сердечно-сосудистой, и дыхательной систем, гематологические показатели, поведенческие реакции и д.т.
Хронический опыт. Это заключительный этап ихтиотоксикологического исследования. Его задача выявить пороговую концентрацию веществ и ПДК.
Исходную концентрацию и диапазон концентраций выбирают, руководствуясь данными острого и подострого опытов. Продолжительность хронического опыта от 1 до 3 месяцев, но не более.
Поскольку фактор времени в ихтиотоксикологических исследованиях приобретает решающее значение, для сокращения продолжительности опытов целесообразно использовать метод функциональных нагрузок и на этом фоне определять состояние индикаторной функции (избирательно поражаемой). Метод функциональных нагрузок позволяет выявить не только уже имеющиеся нарушения в деятельности той или иной функциональной системы, но и возможности организма адаптироваться к стрессирующим воздействиям факторов внешней среды в условиях хронического действия малых концентраций токсических веществ. То есть речь идет об определении патологических сдвигов в организме, физиолого-биохимические показатели функционального состояния которого остаются в «диапазоне нормальных колебаний». Для этого используют различные нагрузки, что позволяет оценить состояние регуляторных систем организма, обеспечивающих сохранение постоянства внутренней среды.
Метод функциональных нагрузок заключается в следующем. После воздействия того или иного токсического вещества на организм резко изменяются условия его существования (температурный и газовый режимы, активная реакции среды и т. д.). Изменение (ухудшение) условий существования рыб выступает в роли дополнительной функциональной нагрузки на организм. В результате скрытые патологические сдвиги в организме, вызванные хроническим воздействием на него малых концентраций токсиканта, проявляются.
В качестве функциональных нагрузок для рыб могут быть использованы экспериментально вызванные инфекции и инвазии, повышенные физические нагрузки, обусловленные длительным вынужденным плаванием, голодание, пребывание в воде повышенной температуры или с пониженным содержанием кислорода и др.
Данные, накопленные отечественными санитарными токсикологами, показывают, что метод функциональных нагрузок обладает высокой эффективностью и позволяет в кратчайший срок выявить ранние патологические сдвиги в организме, обусловленные действием пороговых концентраций токсических веществ.
5. КЛАССИФИКАЦИЯ СТОЧНЫХ ВОД
С ростом промышленности и химизацией различных отраслей в водоемы могут поступать разнообразные по своему химическому составу и токсическому действию сточные воды, содержащие яды.
Яды (токсиканты) – чужеродные вещества (ксенобиотики), способные вступать во взаимодействие с различными структурами организма и вызывать нарушение его жизнедеятельности, переходящее при определенных условиях в болезненное состояние.
Чтобы разобраться в огромной массе токсикантов и целенаправленно осуществлять мероприятия по профилактике отравлений рыб, токсиканты классифицируют.
В настоящее время нет единой, универсальной классификации сточных вод и их компонентов.
Более приемлемой в настоящее время является классификация Е. А. Веселова (по химической природе вещества). Сточные воды в этой классификации по действию их на водоем делят на содержащие органические и неорганические загрязнители.
Органические загрязнители в сточных водах могут представлять собой: 1) первичные продукты животного происхождения; 2) первичные продукты растительного происхождения; 3) продукты термической переработки твердого топлива (каменного угля, торфа, дерева); 4) нефть, нефтепродукты и их компоненты; 5) органические кислоты; 6) кетоны и спирты; 7) фенолы; 8) органические красители и их компоненты; 9) поверхностно активные вещества (в том числе моющие средства); 10) пестициды (в том числе инсектициды, гербициды, фунгициды, нематоциды, зооциды, репелленты, стимуляторы и ингибиторы роста растений и др.).
Из неорганических загрязнителей в водоемах могут быть: 1) сероводород и сернистые соединения; 2) неорганические кислоты и щелочи; 3) неорганические яды; 4) соли натрия, кальция, магния, аммония (хлориды, сульфаты, нитраты); 5) взвешенные минеральные вещества.
Каждая из этих групп, в свою очередь, подразделяется на сточные воды со специфическими ядовитыми свойствами и сточные воды без специфических ядовитых свойств.
Сточные воды без специфических токсических веществ содержат органические загрязнители и, как отмечает автор, являются преимущественно отходами предприятий пищевой промышленности. Они характеризуются большим содержанием нестойких органических веществ и наличием продуктов их анаэробного распада. В результате гнилостных процессов и брожения в водоеме скапливаются ядовитые газы: сероводород, метан, а также уксусная и молочная кислоты. В результате резко падает содержание кислорода в водоеме, что приводит к заморам.
Сточные воды со специфическими токсическими веществами содержат меньшее количество органических веществ, но также могут вызывать гнилостные процессы и создают дефицит кислорода в водоеме. Содержащиеся в таких водах токсические вещества оказывают специфическое действие на гидробионтов.
Классификация Е.А. Веселова не отражает влияние различных сточных вод на гидробионты с физиологической точки зрения, этот пробел восполняет классификация В.В. Метелева (по характеру повреждающего эффекта).
Согласно этой классификации все яды подразделяются на следующие группы:
I. Яды локального действия:
а) неорганические вещества: хлор; перекись водорода, марганцовокислый калий, озон, кислоты и щелочи, соли тяжелых металлов (марганец, никель, хром, мышьяк, кадмий, свинец, железо, цинк, ртуть, медь, серебро), борная кислота;
б) органические вещества: формальдегид, органические кислоты и краски, дубильные вещества, детергенты.
Яды локального действия разрушают респираторный эпителий жабр, вплоть до полного отделения эпителия от нитей жаберных пластинок, иногда вызывают кровотечение из жабр, а также изменения со стороны пигментных клеток-хроматофоров. Кожные покровы и жабры под действием этих ядов обильно покрываются слизью, препятствующей газообмену. В результате всех этих изменений в организме рыб возникает недостаток кислорода, накопление углекислоты. При этом у рыб увеличивается частота и глубина дыхания, но, несмотря на это, прогрессирующее поражение респираторного эпителия вызывает удушье или асфиксию.
II. Яды резорбтивного действия:
1. Нервно-паралитические яды:
а) неорганические вещества: аммиак и соли аммония, углекислота, щелочные и щелочноземельные металлы, фтор, фосфор;
б) органические соединения: нефть и нефтепродукты, фенолы, смолы и дегти, алкалоиды, сапонины терпены, продукты выщелачивания древесины, токсины водной улитки, хлорорганические, фосфорорганические производные карбаминовой кислоты, ряд гербицидов и альгицидов.
2. Гемолитические яды: аммиак и соли аммония, свинец, цианиды, сапонины, селен, некоторые фосфорорганические соединения, диурон, пропанид, токсины некоторых сине-зеленых водорослей.
Протоплазматические яды: фтор, цианиды, моче вина, меркаптаны.
Энзиматические (ферментативные) яды: фосфор органические соединения (хлорофос, карбофос, ацетофос, метилнитрофос, трихлорметафос-3, фосфамид и др.), фториды, цианиды, азид натрия, сульфат натрия, углекислый газ, некоторые детергенты, меркаптаны.
Яды наркотического действия: углеводороды (этилен, пентан и др.), алкилгалогениды (хлороформ, четыреххлористый углерод, дихлорэтан, трихлорэтилен) алкоголи, эфиры, кетоны, альдегиды (параформальдегид, хлоралгидрат, паральдегид, альдол), нитро-соеди нения.
Яды комбинированного действия такие как аммиак и соль аммония обладают локальным, нервно-паралитическим и гемолитическим действием; цианиды – ферментативным, гемолитическим, протоплазматическим и незначительным локальным; фтор – локальным, нервно-паралитическим, протоплазматическим и ферментативным; ФОС – нервно-паралитическим, ферментативным и гемолитическим (в слабой степени); формальдегид — нервно-паралитическим и локальным; сапонины – нервно-паралитическим, локальным и гемолитическим действием.
Симптомы отравления ядами резорбтивного действия проявляются только при определенной концентрации их в организме. Резорбтивными яды называют условно.
Вполне понятно, что разделение ядов по характеру их действия весьма условно, так как один и тот же яд может действовать как на нервную систему, так и обладать гемолитическим либо резорбтивным и локальным действием. В таких случаях говорят о ядах, обладающих комбинированным действием.
Яды резорбтивного действия, симптомокомплекс которых проявляется в преимущественном действии на нервную систему, вызывают у рыб быструю потерю рефлекса равновесия, «бешеное» спиралеобразное плавание, плавание толчками, беспорядочными бросками. Дыхание у рыб вначале глубокое и учащенное, но по мере развития отравления становится аритмичным и поверхностным. При токсических концентрациях яда наблюдается периодическое резкое возбуждение, особенно от внешнего раздражения. Наблюдается дрожание глаз. Судороги могут длиться несколько минут или даже часов и периодически сменяться спокойным состоянием. В периоды покоя рыба лежит вытянувшись, с плотно закрытым или широко раскрытым ртом и веерообразно раскрытыми плавниками. Часто наблюдается легкое, частое дрожание плавников и боковых мускулов. Следует отметить, что симптомокомплекс отравления различных видов рыб может различаться: у более подвижных и чувствительных рыб реакция бывает выражена сильнее, чем у малоподвижных.
Несмотря на некоторые различия в течении отравления рыб ядами нервного действия, как правило, одна за другой следуют стадии.
Начало беспокойства. Рыба ведет себя очень неспокойно: мечется в разные стороны, учащается дыхательный ритм, широко раскрывает рот и отставляет в стороны плавники. Однако уже через 2–3 минуты она успокаивается. Кратковременное беспокойство нельзя принимать за начало токсического действия, но затягивающееся беспокойство заставляет предполагать действие яда.
Первые признаки расстройства чувствительности. После того как пройдет первое беспокойство, рыба спокойно лежит на дне. Для первых признаков расстройства чувствительности характерно поднятие лучей плавников, затем энергичное вздрагивание плавников, судорожное и большей частью поверхностное, но частое дыхание; нередко наблюдается неполное закрытие рта и легкое дрожание челюстей.
Стадия повышения или понижения раздражимости (парадоксальная). Для рыб с повышенной раздражимостью характерно стремительное плавание. Внешне даже слабые раздражения вызывают сильную реакцию у рыб. Так же действует световое раздражение. Наоборот, при пониженной чувствительности рыбы почти не реагируют на раздражение, безразлично относятся к световому раздражению, к прикосновению и инертно движутся вместе с водой при ее переливании.
Первое расстройство равновесия. Наблюдается опрокидывание рыбы на бок или спину. У бычков (р. Cottus, р. Gobius) или налима (Lota lota) опрокидывания на бок не наблюдается.
Различают следующие виды потери равновесия: при повышенном раздражении сильно напрягаются плавники, что вызывает потерю способности к движению; при понижении чувствительности наступает сильное изнеможение и паралич плавников, что вызывает опрокидывание на бок; паралич деятельности плавательного пузыря при сохранности деятельности плавников; полное расстройство «сознания»: нет реакции ни со стороны глаз, ни со стороны плавников. Эти состояния рыб могут комбинироваться и переходить из одного в другое.
Полная потеря равновесия (атаксия). В этой стадии рыбы внезапно опрокидываются на бок или спину. Это состояние, в зависимости от природы яда, может быть вызвано различными причинами. Тщательное наблюдение за потерявшей равновесие рыбой очень важно и может дать материал для заключения. При этом следует обращать особое внимание на следующие моменты: а) дышит ли рыба, как часто и глубоко; б) подвижна ли она (дрожание, стремительное плавание, вялые или затруднительные движения или у нее наступает паралич); в) «сознает» ли рыба свое положение (движение глаз, компенсаторное движение плавников); г) наблюдаются ли судороги челюстей, хвоста или плавников, какова их частота, усиливаются они или ослабевают.
Конечная стадия — агония. Полная потеря равновесия переходит постепенно в конечную стадию: многие яды вызывают смерть путем удушья; нервно-паралитические яды вызывают паралич центра дыхания. Рыба, погибшая от паралича, почти всегда тускло окрашена, туловище после смерти часто изогнуто.
Трупное окоченение представляет собой полное отвердение тела и всех плавников. Иногда, особенно при смерти, от истинного паралича, оно может наступить и тогда, когда дыхание еще продолжается. У таких рыб жаберные крышки и грудные плавники могут двигаться несколько часов, в то время как хвост окоченел. Хроматофоры во время трупного окоченения исчезают и снова появляются; позднее образуются пятна.
Яды протоплазматического действия могут нарушать обмен веществ и незаметно вызывать смерть. Яды гемолитического действия разрушают эритроциты, специфически действуют на гемоглобин, в результате он превращается в гематин, плазма крови окрашивается в красный цвет.
Надо понимать, что такое разделение ядов условно, так как один и тот же яд в зависимости от концентрации может действовать по-разному. Например, фенолы, обладая нервно-паралитическим действием, в больших концентрациям оказывают локальное действие.
По стойкости в водной среде (распад на 95%) токсиканты делят на следующие группы:
малостабильные – время распада до 10 суток;
умеренностабильные – от 11 до 60 суток;
среднестабильные – 2–3 мес.;
высокостабильные – 3–6 мес.;
очень высокостабильные – от 6 мес. до 1 года;
сверхвысокостабильные – более 1 года.
По степени острой токсичности для рыб и водных организмов токсические вещества делят на следующие группы:
особотоксичные – CK50 до 0,5 мг/л;
высокотоксичные – CK50 от 0,5 до 5,0 мг/л;
среднетоксичные – CK50 от 5,0 до 50,0 мг/л;
малотоксичные – CK50 от 50,0 до 500,0 мг/л;
очень слаботоксичные – CK50 более 500,0 мг/л.
6. ИХТИОТОКСИКОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ВЕЩЕСТВ
6.1. Характеристика неорганических веществ. Источники поступления в водоемы, токсичность, диагностика отравления гидробионтов
Кислоты (соляная, серная, азотная, борная и др.) – довольно распространенная группа загрязнителей, поступающих со сточными водами металлургических, машиностроительных, текстильных, химических и целлюлозно-бумажных предприятий. Они выпадают также с атмосферными осадками, загрязненными дымовыми выбросами вышеназванных производств, содержащих окислы серы, азота и др.
Токсичность. Кислоты оказывают на рыб комбинированное действие. Оно основано на снижении рН воды и специфическом ядовитом действии Н-ионов и недиссоциированных молекул кислот. Водородные ионы вызывают дегидратацию тканей, коагулируют белки с образованием кислых альбуминатов, приводят к некрозу тканей.
Острые отравления рыб наблюдают при массированных залповых сбросах сточных вод. При длительном воздействии низких рН у рыб развивается кислотное заболевание.
Смертельные показатели кислой среды для рыб находятся в пределах рН 4,8–4,0 для ракообразных и простейших – рН 3,5–4,0. Безопасным для рыб считается диапазон рН 5,0–9,0. Однако для оптимальной продуктивности водоемов требуется более узкий разброс рН – от 6,5 до 8,5. Установлено, что в озерах, где рН воды ниже 5, примерно в 50% случаев ихтиофауна отсутствует или выпадает из популяции около 80% видов рыб. Наиболее устойчивым оказался окунь. Биологические изменения в озерах начинаются при рН 6, а при рН 4,9 исчезают почти все моллюски, многие организмы бентоса, происходит накопление детрита, заболачивание мелководий.
В кислой среде изменяется токсичность ряда ядовитых веществ. Например, никельцианидный комплекс гораздо токсичнее при рН 7,0, чем при рН 8,0 вследствие диссоциации его на ионы никеля и цианида (недиссоциированная HCN). То же происходит с другими цианидами, сульфидами, сероводородом.
Летальные концентрации кислот для разных видов рыб колеблются: серной кислоты – форель 6,25 мг/л, карась 138 мг/л; соляной – карась 159 мг/л, форель и окунь 8–10 мг/л; азотной — карась 200 мг/л, форель 1,6–15,5 мг/л. Борная кислота и тетраборат натрия в концентрациях 1500–250 мг/л вызывают гибель всей икры и молоди севрюги, а при концентрации 62,5–500 мг/л снижается темп роста предличинок севрюги.
Токсичность кислот усиливается в присутствии тяжелых металлов, особенно алюминия и железа. Показано, что токсическое влияние кислых значений рН усиливается при низких концентрациях натрия и хлоридов. С повышением жесткости воды токсичность кислот ослабевает.
Симптомы и патоморфологические изменения. Кислоты в больших концентрациях действуют на рыб в основном локально, а в низких – резорбируются в кровь и вызывают ацидоз.
При токсических значениях рН рыбы становятся вялыми, плавают по кругу или толчкообразно, выпрыгивают из воды, принимают диагональное положение, дыхание у них резко замедляется. Кожа и жабры обильно покрываются уплотненной слизью молочно-белого цвета. На брюшной стенке встречаются очаговые кровоизлияния. У погибших рыб жаберные крышки плотно прижаты, края жабр имеют коричневую окраску, кожные покровы и жаберные лепестки покрыты крупянисто-беловатым налетом, в котором встречаются остатки крови коричневого цвета. При гистологическом исследовании отмечают гипертрофию слизистых клеток, отслоение, дистрофию и некробиоз респираторного эпителия (при рН ниже 5), а также очаги слущивания эпителия жабр и эпидермиса кожи (при рН 4).
Диагноз ставят на основании симптомов отравления и результатов определения рН воды. В ранние сроки отравления слизь сохраняет кислую реакцию, которую можно установить лакмусовыми бумажками. Дополнительно к этому, особенно при загрязнении водоемов сильными кислотами и их кислыми солями, определяют общую кислотность воды титрованием ее раствором сильного основания. Характерным признаком подкисления озер считают увеличение прозрачности воды и зарастание дна водорослями.
Профилактика. Для повышения рН до нейтральной реакции воду известкуют. При закисленности воды в водоисточнике ставят известковые фильтры на магистральном канале зимовальных прудов, а летом ее нейтрализуют внесением негашеной извести по воде.
Щелочи (едкий натр, едкое кали, негашеная известь).
По своему действию к щелочам близки сода и силикат натрия. Щелочные сточные воды поступают в водоемы с целлюлозных, шерстеобрабатывающих, текстильных и предприятий коммунально-бытового хозяйства. Щелочи экстрагируются из бетона новых бассейнов. При небрежном их внесении в водоемы, а также недостаточной промывке бетонных емкостей водой возможны отравления рыб щелочами.
Токсичность щелочей обусловлена гидроксильными ионами и повышением рН воды. Гидроксильные ионы вызывают набухание, затем расплавление и разжижение белка с образованием щелочных альбуминатов, легко растворимых в воде. Проникая в ткани, они вызывают влажный некроз. Кровь, выходящая из поврежденных сосудов, не свертывается, а гемоглобин ее превращается в щелочной гематин. Резорбтивное действие щелочен невелико. Они могут вызывать алкалоз.
Токсические концентрации едкого натра составляют для форели и лосося 10 мг/л, голавля – 20 мг/л, карпа и леща – 55,5 мг/л, карася и окуня – 50 мг/л.
Симптомы и патоморфологические изменения. При отравлении щелочами рыбы становятся беспокойными, легковозбудимыми, у них учащается дыхание, увеличивается секреция слизи кожей и жабрами, причем она сильно разжижена, тягучая, легко стекает и смывается с поверхности тела. В результате быстрого истощения ее запасов поверхность тела становится тусклой, а чешуя шероховатой. Отравления щелочами сопровождаются сильным расширением кровеносных сосудов в жабрах и плавниках, что приводит к появлению очаговых кровоизлияний и даже кровотечений из жабр. Плавники погибших рыб разволокнены вследствие распада межлучевых перепонок. Респираторный эпителий и эпидермис кожи в состоянии слизистой дистрофии и некроза.
Диагноз ставят по результатам внешнего осмотра рыб, определения рН воды или по щелочной реакции слизи. Дополнительно устанавливают общую щелочность воды титрованием ее раствором сильной кислоты.
Профилактика заключается в недопущении поступления щелочных вод в водоисточники, правильном применении извести в рыбоводстве, обязательной промывке новых бетонных бассейнов проточной водой, регулярном контроле рН воды в рыбохозяйственных водоисточниках, а также в борьбе с их «цветением». Технологическая норма рН для карповых прудов 6,5–8,0, допустимые пределы 6,0–9,0.
Цианистые соединения поступают из металлургических, текстильных, нефтехимических, машиностроительных предприятий, гальванических цехов, газогенераторных станций. В воде они диссоциируют с образованием цианид-ионов и катионов или присутствуют в виде недиссоциированной цианистой кислоты. В кислой среде количество последней увеличивается. При окислении цианидов хлорной известью или другими окислителями образуются цианаты (OCN). Они легко взаимодействуют с двуокисью углерода, что ведет к образованию цианистой кислоты.
Токсичность цианидов определяется недиссоциированной цианистой кислотой и цианид-ионами. Цианиды – это ферментативные яды, блокирующие железосодержащий фермент – цитохромоксидазу, что приводит к нарушению тканевого дыхания и асфиксии.
Наиболее токсичны для рыб простые соединения — цианистая кислота, цианиды натрия и калия. Цианиды и аммиак являются синергистами. При недостатке кислорода чувствительность рыб к цианидам резко повышается.
Токсические концентрации синильной кислоты, цианистого калия и натрия, вызывающие острое отравление, находятся в следующих пределах: для молоди форели – 0,05–0,09, окуней – 0,15, линей – 0,2, карасей – 0,12–0,31. карпов – 0,5 мг CN/л.
Симптомы и патоморфологические изменения. При отравлении рыб цианидами наблюдается расстройство функции нервной системы и нарушение дыхания. Острое отравление рыб сопровождается учащением и аритмией дыхательных движений, потерей равновесия и толчкообразным движением рыб, в атональной стадии – резким угнетением, ослаблением дыхания и постепенной гибелью. Потребление кислорода резко снижается. Обратимость отравления высокая, перемещенные в чистую воду рыбы быстро поправляются. Патологоанатомические изменения недостаточно характерны: жабры имеют ярко-розовую окраску, кровь плохо свертывается, жидкая, иногда в брюшной полости содержится кровянистый транссудат. Паренхиматозные органы набухшие, дряблые с явлениями дистрофии и некробиоза клеток.
Диагноз на отравление затруднен. Наиболее достоверным признаком является обнаружение цианидов в воде или в органах рыб. Для определения цианидов в воде применяют колориметрический метод – пиридин-бензидиновый или пиридин-барбитуратный. В трупах рыб синильную кислоту и цианиды находят с трудом, так как они быстро разлагаются с образованием муравьиной кислоты, роданидов и других соединений. Для определения цианидов в органах рыб можно использовать реакцию с берлинской лазурью.
Рыбохозяйственная ПДК. цианидов – 0,05 мг/л, роданида калия – 0,15 мг/л.
Щелочные и щелочноземельные металлы и их соли (Na, К, Mg, Ca, Sr, Li, Ba). Соли щелочных и щелочноземельных металлов присутствуют в сточных водах машиностроительной, целлюлозно-бумажной, химической, электротехнической, красильной, полиграфической и резиновой промышленностей. Поступление калия происходит в результате вымывания из почв калийных удобрений, а также с атмосферной пылью.
Токсичность. Попадая в водоемы, соли щелочных и щелочноземельных металлов в первую очередь повышают соленость и жесткость воды. Их катионы сравнительно легко проникают через жабры в тело рыб и включаются в биохимические процессы, нередко нарушая их течение.
Гипертонические растворы солей действуют на пресноводных рыб как настоящие яды. Пороговые концентрации хлоридов составляют для карпа и линя 5,0 г/л, окуня – 10,7 г/л, угря и форели – 11,25 г/л. Для большинства пресноводных рыб безвредной границей солености считают 1,0 г/л (1%о).
Щелочные и щелочноземельные металлы относятся к группе слаботоксичных веществ.
Симптомы и патоморфологические изменения. В высоких концентрациях соли натрия и других элементов обладают локальным действием. Кожа и жабры рыб обильно покрываются слизью. При отравлении солями натрия кожа становится темной, а калия — более светлой. В жабрах наблюдается сморщивание и распад эпителия. При снижении концентрации соли действуют на нервную систему, вызывая паралич нервно-мышечного аппарата. Отравившиеся рыбы плавают кругообразно, а затем толчкообразно, слабо реагируют на раздражения, опрокидываются на бок и гибнут с явлениями паралича. Дыхание у них неравномерное, дыхательный ритм ускорен. Смерть наступает от асфиксии. При воздействии нитритов кровь становится темно-шоколадного цвета, сохраняющегося несколько часов после смерти. В ней резко повышено количество метгемоглобина.
Повышение содержания ионов калия в воде и крови рыб сопровождается нарушением осмотического равновесия и увеличением или уменьшением размера ядер эритроцитов.
Диагноз основан на анализе характера течения интоксикации, определении степени загрязнения водоема и выявления источников поступления сточных вод, содержащих соединения металлов.
По результатам определения жесткости воды и содержания хлоридов, сульфатов, нитратов судят о степени солености воды. Для определения концентрации металлов применяют специальные колориметрические и спектрографические методы.
Профилактика заключается в соблюдении установленных для рыбоводства гидрохимических нормативов. Допустимые пределы их составляют: жесткость – более 7 мг-экв/л, сульфат-ионы – 100 мг/л, хлорид-ионы – 300 мг/л, нитрат-ионы – 40 мг/л (9,1 мг/л N), нитрит-ионы – 0,08 мг/л (0,02 мг/л N), катионы Na – 120 мг/л, Са – 180 мг/л, К – 50 мг/л, Mg – 40 мг/л.
Тяжелые металлы и их соли (Сu, Zn, Hg, Cd, Pb, Sn, Fe, Mn, Ag, Cr, Co,. Ni, As, Al) —широко распространенные промышленные загрязнители. В водоемы они поступают из естественных источников (горных пород, поверхностных слоев почвы и подземных вод), со сточными водами многих промышленных предприятий и атмосферными осадками, которые загрязняются дымовыми выбросами. Тяжелые металлы как микроэлементы постоянно встречаются в естественных водоемах и органах гидробионтов. В зависимости от геохимических условий отмечаются широкие колебания их уровня.
Тяжелые металлы довольно устойчивы. Поступая в водоемы, они включаются в круговорот веществ и подвергаются различным превращениям. Неорганические соединения быстро связываются буферной системой воды и переходят в слаборастворимые гидроокиси, карбонаты, сульфиды и фосфаты, а также образуют металлорганические комплексы, адсорбируются донными осадками. Под воздействием живых организмов (микробов и др.) ртуть, олово, мышьяк подвергаются метилированию, превращаясь в более токсичные алкильные соединения. Кроме того, металлы способны накапливаться в различных организмах и передаваться в возрастающих количествах по трофической цепи. Особенно опасны ртуть, цинк, свинец, кадмий, мышьяк, так как они, поступая с пищей в организм человека и высших животных, могут вызвать отравления. Коэффициент материальной кумуляции колеблется у них от сотен до нескольких тысяч.
Считают, что большая часть неорганических соединений металлов поступает в организм рыб с пищей. Через жабры и кожу проникают растворимые диссоциирующие соли и металлорганические соединения. Антропогенные источники многократно (в 2–13 раз) повышают концентрацию тяжелых металлов в воде. С этим четко корелирует содержание металлов в органах рыб.
Токсическое действие большинства тяжелых металлов на рыб обусловлено их ионами. Концентрированные растворы их солей, обладая вяжуще-прижигающим действием, нарушают функции органов дыхания и угнетают активности ферментов.
Медь (Сu) содержится в сточных водах рудообогатительных комбинатов, металлургических, машиностроительных и электротехнических предприятий. В высоких концентрациях соли меди оказывают вяжущее, раздражающее и прижигающее действие, а в низких – инактивируют дыхательные ферменты.
Токсичность меди возрастает при снижении жесткости воды, температуры и содержания кислорода. В присутствии гуминовых кислот, взвешенных веществ и при повышении жесткости она снижается на 1–1,5 порядка. Отмечен синергизм в комбинации меди с цинком и кадмием.
Для гидробионтов более токсичны хорошо растворимые в воде хлориды, нитраты и сульфаты меди. Нарушение эмбрионального развития радужной форели наступает при концентрациях 0,02–0,04 мг Сu/л в мягкой воде и 0,08 мг Сu/л в жесткой.
Симптомы и патоморфологические изменения. При остром отравлении рыбы возбуждены, очень активны, тело их покрывается коагулированной слизью голубоватого цвета. В жабрах и коже наблюдается гиперемия, дистрофия, некробиоз и десквамация покровного эпителия, в печени и почках – зернистая дистрофия и деструкция эритроцитов. При хроническом воздействии сульфата меди количество слизи уменьшено, кожные покровы бледные, шершавые, нарушена целостность плавников, рыбы истощены.
Гистологические изменения характеризуются гиперплазией, вакуольной дистрофией и последующим очаговым слущиванием и некробиозом эпителия жабр, зернисто-жировой дистрофией и некробиозом печеночных клеток и эпителия мочевых канальцев, распадом эритроцитов, гемосидерозом в селезенке и почках, дистрофическими и атрофическими изменениями в скелетной мускулатуре, очаговым десквамативным катаром в кишечника.
Диагноз. Ставят на основании клинико-анатомической картины интоксикации и результатов определения меди в воде, рыбе и других объектах. При этом учитывают фоновое ее содержание, а также то, что при гибели рыб обнаруживается большое количество меди в органах. Например, в мышцах внешне здоровых рыб обнаруживается до 10 мг Cu/кг. Среднее содержание меди в органах леща, плотвы, судака и сазана Волжского бассейна составляет (по сухому веществу) в печени 34–60 мг/кг, чешуе и костях – 12–20 мг/кг и мышцах 1,2–3,4 мг/кг.
Для определения меди в воде и органах рыб применяют колориметрические, спектрофотометрические, атомно-адсорбционные, масс-спектроскопические методы.
Рыбохозяйственная ПДК в пресных водоемах 0,001 мг Cu/л, в морских – 0,005 мг Cu/л. Допустимые остаточные количества меди в рыбных продуктах 10 мг/кг продукта.
Цинк (Zn). Соединения цинка поступают в водоемы из предприятий цветной металлургии, машиностроительной, красильной, химико-фармацевтической, целлюлозно-бумажной, деревообрабатывающей и текстильной промышленности. Хлорид цинка применяют в качестве консерванта древесины.
Токсичность. Ядовитые свойства цинка обусловлены в основном ионами, возможно, суспензиями гидроокиси и карбонатов. При увеличении жесткости, солености и взвешенных частиц его токсичность снижается, так как в этих случаях растворимость солей цинка уменьшается.
Сульфат цинка вызывает острое отравление (5 дней) карпов в концентрации 10 мг/л. Остротоксичные концентрации ионов цинка составляют для молоди форели 0,4, молоди карпа и колюшки 0,5 мг Zn/л, а среднесмертельные (96 часов) для ушастого окуня 3,2 мг Zn/л и тиляпии – 1,6 мг Zn/л. Хроническое отравление молоди форели наступает через 26 суток в концентрации 0,01 мг Zn/л. Сульфат цинка тот же эффект у карпов вызывал в концентрации 0,1 – 0,3 мг/л через 60–80 суток. Для зоопланктона токсичны 0,08 мг Zn/л и выше.
Симптомы и патоморфологические изменения сходны с теми, которые вызывает медь. При остром отравлении отмечают потемнение окраски тела, отек жаберных лепестков, гиперплазию и слущивание респираторного эпителия. У гольяна обнаружено искривление позвоночника после 30-дневной интоксикации нитратом цинка в концентрации 0,06–0,16 мг Zn/л.
Диагноз ставят на основании клинико-анатомической картины отравления и определения цинка в воде и органах рыб. Цинк в воде обнаруживают колориметрическим методом с дитизоновым реактивом и атомно-адсорбционной спектроскопией, а в биологическом материале титрометрически с ферроцианидом калия. Цинк накапливается в слизи, жабрах, почках, скелете и желудочно-кишечном тракте, гораздо меньше — в печени, селезенке и мышцах.
Диагностическим показателем считают увеличение отношения содержания цинка в жабрах и жаберной крышке до 100: 1 против 1 : 1 у контрольных рыб. При диагностике следует учитывать данные о количестве цинка в органах рыб незагрязненных водоемов. Среднее содержание цинка в органах леща, плотвы, судака и сазана Волжского бассейна составляет (по сухому веществу) в жабрах и печени 140–1500, почках и селезенке – 70–150, мышцах – 15–70 мг/кг.
Профилактика основана на общих принципах, рыбохозяйственная ПДК цинка в пресных водоемах 0,01, в морских – 0,05 мг Zn/л. Допустимые остаточные количества цинка в рыбных продуктах 40 мг/кг продукта.
Ртуть (Hg) содержится в сточных водах химических заводов по производству красок, хлора и каустической соды, фармацевтических препаратов, взрывчатых веществ, приборостроительных и электротехнических предприятий, горнодобывающих и целлюлозно-бумажных комбинатов. В сельском хозяйстве ртутьорганические соединения применяют в качестве пестицидов.
Под влиянием микроорганизмов неорганическая ртуть превращается а органическую (этил- и метилртуть), которая и накапливается в гидробионтах. Начиная с концентраций 0,01–0,5 мг/л ртуть тормозит процессы самоочищения водоема.
Токсичность. Загрязнение водоемов ртутью вызывает отравления водных животных и весьма опасно для человека из-за накопления ее соединений в пищевых гидробионтах. Металлическая ртуть и ее неорганические соли менее токсичны для рыб, чем органические соединения. Высокая токсичность органических препаратов ртути объясняется тем, что органический радикал способствует проникновению их в организм, что приводит к тяжелому отравлению, поражению центральной нервной системы, печени, почек и других органов за счет ингибирования тиоловых ферментов и биосинтеза белков. Ртутные препараты обладают гонадотропным и эмбриотоксическим действием. Из неорганических соединений на рыб действуют в основном растворимые соли ртути — хлориды, сульфаты и нитраты. Ртутьсодержащие соединения являются высокотоксичными для рыб и других гидробионтов. Токсичность ртути в мягкой воде выше, чем в жесткой.
При остром отравлении ртуть концентрируется в основном в жабрах, мускулатуре и почках, а при хроническом – в почках, печени, головном мозге и кишечной стенке. Острое отравление карпов и форели наступает при наличии в органах 3,5–10,0 мг/кг, а хроническое – при 37,0 мг/кг ртути во внутренних органах и 3,6–6,8 мг/кг в мускулатуре. Период выделения из организма рыб неорганической ртути составляет около 4 месяцев, а органической 8–12 мес.
Симптомы и патоморфологические изменения. При травлении у рыб наблюдается последовательная смена фаз возбуждения и угнетения, усиления и замедления дыхания, нарушение равновесия и координации движений. Рыбы ложатся на бок и гибнут от удушья. Тело погибших рыб покрыто беловатым налетом, отмечают кровоизлияния в уголках рта, жабры застойно гиперемированы. Жаберный эпителий вначале гипертрофирован, а затем подвергается некробиозу, слущивается, что ведет к деструкции лепестков. Внутренние органы кровенаполнены, обнаруживается некробиоз печеночных клеток, нефроз с тотальным некрозом клубочков и эпителия почечных канальцев.
Хроническая интоксикация сопровождается резкими нарушениями функции нервной системы: толчкообразным движением рыб, судорогами и параличами, а также анемией.
Диагноз ставят на основе комплексных исследований. Клиническая картина и патологоанатомические изменения дают наводящие указания на отравление. Обязательным является химический анализ воды, грунта и органов рыб на наличие ртути. Для определения ртути в воде рекомендуется колориметрический метод с дитизоном. Диагноз считается установленным при обнаружении ртути в воде и в органах рыб в количествах, способных вызвать отравление, снижении сульфгидрильных групп в крови или органах, а также наличии клинических признаков отравления и патоморфологических изменений. Уровень содержания ртути в органах сравнивают с контрольными исследованиями того же вида рыб из благополучного водоема.
Профилактика. Кроме осуществления общих мероприятий, следует строго контролировать наличие остатков ртути в кормах, грунте водоемов и в основных гидробионтах. Запрещается скармливать рыбам зерно, протравленное ртутьсодержащими пестицидами. ПДК гранозана в пресных рыбохозяйственных водоемах 0,00001 мг/л, сулемы – 0,0001 мг/л, в морских водоемах – 0,001 мг Hg/л. Допустимые количества ртути в рыбных продуктах 0,5 мг/кг с учетом естественного уровня, который составляет в мускулатуре промысловых рыб в среднем 0,12 мг/кг.
Кадмий (Cd). Содержится в сточных водах многих промышленных предприятий, особенно свинцово-цинковых и металлообрабатывающих заводов, использующих гальванопокрытие. Он присутствует в фосфорных удобрениях. В воде растворяются сернокислый, хлористый и азотнокислый кадмий, его гидроокиси нерастворимы.
Токсичность. Наиболее токсичны для рыб и других гидробионтов растворимые соединения кадмия. Среднесмертельные концентрации кадмия для лосося, форели и карпа в мягкой воде составляют от 0,05 до 0,24 мг Cd/л (экспозиция 96 ч). Соответствующие концентрации для кумжи и щуки примерно в 2 раза, а для окуня и гольяна в 5 раз выше, чем для форели. В жесткой воде токсические концентрации увеличиваются в 20—30 раз, а с повышением температуры, снижением содержания кислорода и рН воды токсичность кадмия усиливается.
Симптомы и патоморфологические изменения. Кадмий обладает местнораздражающим и резорбтивным действием. При остром отравлении хлористым кадмием обнаруживают гиперплазию и распад респираторного эпителия жабр, эпидермиса кожи, некробиоз кишечника и проксимальных канальцев почек, гемопоэтической ткани. Хроническая интоксикация выражается замедлением роста, некробиотическими изменениями в жабрах, ночках, печени, гемопоэтической ткани, отмечены образование доброкачественной опухоли в почках и деформация позвоночника.
Диагноз. Для определения кадмия в воде применяют колориметрический, дитизоновый и атомно-абсорбционный методы, а рыбе и рыбных продуктах – атомно-абсорбционную спектроскопию или дробный метод с солями дитиокарбамиповой кислоты. Среднее количество кадмия в мышцах промысловых рыб составляет 0,65 мг/кг.
Профилактика та же, что при загрязнении другими металлами. Рыбохо-зяйственная ПДК кадмия в пресных водоемах 0,005 мг/л, в морских – 0,01 мг/л. Допустимые количества в рыбных продуктах 0,1 мг/кг.
Мышьяк (As). Поскольку мышьяк и его соединения широко применяются в народном хозяйстве, он содержится в сточных водах различных отраслей промышленности — металлургической, химико-фармацевтической, текстильной, стекольной, кожевенной, химической по производству инсектицидов, гербицидов, красок. Мышьяковистые ядохимикаты, используемые в сельском и лесном хозяйстве для борьбы с вредителями растений, могут поступить в водоемы с поверхностным стоком. В воде мышьяк обнаруживается в форме арсената или арсенита, а также встречаются метиллированные соединения. Осажденные его формы при повышении температуры могут растворяться и вызывать вторичное загрязнение.
Токсичность. В больших концентрациях соединения мышьяка действуют прижигающе на жабры и кожу рыб. Проникая внутрь организма, мышьяк связывается с ферментами и вызывает сосудистые нарушения и деструктивные изменения во внутренних органах. Смертельные концентрации мышьяковистого ангидрида для форели и окуня 15–19 мг As/л, карася и карпа – 19–25, дафний – 0,5, циклопов – 1–5 мг As/л.
Содержание мышьяка в теле рыб, отравленных неорганическими или органическими соединениями, по данным разных авторов, составляет от 0,9 до 1340 мг/кг. При остром отравлении мышьяк концентрируется в жабрах и внутренних органах, а при хроническом, кроме того, в костях, чешуе и головном мозге.
Симптомы и патоморфологические изменения. Поскольку мышьяк является медленно действующим ядом, картина острого отравления рыб не характерна. Рыбы угнетены, малоподвижны, перед смертью наступает сильное возбуждение и судороги. При хроническом отравлении наступает истощение и анемия. Патоморфологические изменения характеризуются дистрофией респираторного эпителия, водяночно-жировой дистрофией и некробиозом печеночных клеток и эпителия канальцев почек.
Диагноз ставят по результатам определения мышьяка в воде и рыбе. Для установления мышьяка в воде рекомендуются колориметрический метод с диэтилдитиокарбаматом серебра, а в органах рыб – качественные методы Марша или Зингер-Блека и количественное определение фотоэлектроколориметрическим методом. Содержание мышьяка в морских рыбах может достигать 5 мг/кг сырой массы. Мышьяк хорошо сохраняется в биологическом материале и может быть обнаружен в трупах через длительное время после смерти.
Профилактика основывается на предотвращении попадания мышьяка в водоемы со сточными водами промышленных и сельскохозяйственных предприятий, а также в соблюдении правил применения его соединений в качестве пестицидов.
Рыбохозяйственная ЦДК мышьяка в пресных водоемах 0,05 мг/л, морских – 0,01 мг/л, допустимые остаточные количества в рыбных продуктах – 1 мг/кг.
Железо (Fe). В поверхностных водах содержание железа колеблется в широких пределах. В подземных водоисточниках и водах болот его концентрация достигает десятков мг/л. Резкое повышение железа в водоемах происходит при загрязнении их сточными водами рудников, металлургических, машиностроительных и химических предприятий. В воде присутствует закисное (Fe"') и окисное (Fe''') железо. Закисные формы железа нестойки, быстро окисляются, переходя в окисные, а также образуют нерастворимые гидроокиси и карбонаты. Процесс окисления идет не только в воде, но и в теле железобактерий, которые размножаются в болотах, водопроводных трубах, прудах. После отмирания бактерий гидрат окиси железа оседает на дно прудов и бассейнов. В кислой среде растворимость железа увеличивается, а в щелочной уменьшается. В концентрации 0,05 мг/л железо придает воде желтоватую окраску, а в концентрациях 0,3–1,0 мг/л – металлический вкус.
Токсичность железа обусловлена механическим повреждением и асфиксией рыб и икры в результате осаждения хлопьев гидроокиси железа или снижением в воде кислорода, потребляемого на окисление закисного железа. В кислой среде ионы железа проникают в ткани и действуют самостоятельно как токсины.
О величине токсических концентраций железа для рыб имеются разноречивые данные. Это связано с тем, что его токсичность во многом зависит от гидрохимического режима, особенно от рН, жесткости и других показателей. Для рыб более токсичны сернокислое и двухлористое железо, чем его окись и хлорное железо.
По данным одних авторов, острое отравление карпа, карася и леща происходит при концентрации хлорида и сульфата железа 4,3–6,4 мг/л. При рН воды 5–6,7 токсические концентрации железа для лосося, форели, щуки, плотвы и карпа снижаются до 1,0–2 мг/л.
Симптомы и патоморфологические изменения. При остром отравлении соединениями железа жабры, кожа рыб, а также оболочка погибшей икры покрываются бурым налетом. В жабрах, кроме того, отмечается распад эпителия и его десквамация.
Диагноз ставят на основании внешнего осмотра рыб и икры, результатов определения содержания железа в воде, отложения его на растительности и дне водоема.
Наиболее распространенный метод определения железа в воде – колориметрический с роданидом калия или аммония.
Профилактика. Воду, богатую железом, можно использовать для рыбоводных целей после хорошей аэрации и пропускания ее через отстойники. Для рыбоводства в пресных водоемах допустимы концентрации общего железа 1 – 2 мг/л, закисного – не более 0,2 мг/л, в морских водах – 0,05 мг/л.
Марганец (Мn). Большое количество марганца и его соединений содержится в сточных водах марганцевых рудников, обогатительных фабрик, металлургических и некоторых химических заводов. В воде марганец присутствует в растворенной форме (сернокислые, хлористые и азотнокислые соли, перманганат калия – КМnО.,) и в виде нерастворимых гидроокисей. В концентрации 0,1–0,5 мг/л марганец изменяет органолептические свойства воды, придавая ей металлический вкус.
Токсичность. Соединения марганца менее токсичны для рыб, чем других тяжелых металлов. Токсическое действие марганца сходно с железом. Только влияние КМn04, являющегося сильным окислителем, отличается от действия ионов марганца. Летальная концентрация перманганата калия при экспозиции 24 ч составляет для окуневых 6 мг/л, а токсические границы его находятся в пределах 1–3 мг/л. Ракообразные (дафнии и циклопы) погибают при концентрации 1 мг/л КМn04.
Симптомы и патоморфологические изменения. Острое отравление солями марганца характеризуется беспокойством рыб, светлой окраской туловища, уменьшением чувствительности к раздражителям, атаксией. Кожа и жабры рыб, погибших от отравления перманганатом калия, приобретают буро-коричневую окраску. Гистологическими исследованиями устанавливают дистрофию, некробиоз и слущивание эпителия жаберных лепестков и кожи.
При хроническом отравлении соединения марганца действуют как протоплазматические яды, вызывая тяжелые изменения в нервной системе, почках и органах кровообращения.
Диагноз. Для определения общего содержания всех форм марганца в воде рекомендован колориметрический метод, в котором марганец окисляют до перманганата персульфатом. В биоматериале марганец определяют после озоления с перйодатом калия. Естественное содержание марганца (по сухому веществу) у сазана, судака, леща и плотвы составляет во внутренних органах 5–20 мг/кг, мышцах 3–6 мг/кг и чешуе 300–700 мг/кг сухого вещества.
Профилактика основана на недопущении повышенного загрязнения водоемов марганцем путем эффективной очистки сточных вод, а также строгим соблюдением дозировок при применении перманганата калия в ихтиопатологии. Рыбохозяйственная ПДК марганца не установлена.
Хром (Сг). Соединения хрома встречаются в сточных водах многих промышленных предприятий, производящих хромовые соли, ацетилен, дубильные вещества, анилин, линолеум, бумагу, краски, пестициды, пластмассы и др.
В воде встречаются трехвалентные катионы хрома в составе его сульфатов, хлоридов и нитратов или шестивалентный хром в виде анионов гидрохромата (НСгО'4) и хромата (СгО"4). В воде растворяются хлориды, нитраты и сульфаты хрома, хроматы и бихроматы натрия, калия, аммония.
Токсичность. Помимо специфического токсического действия ионов хрома, его соединения (хромовая кислота и бихроматы) влияют на рыб косвенно, снижая рН воды. С повышением жесткости воды токсичность хромовых соединений снижается.
Для рыб и других гидробионтов более токсичны соединения трехвалентного хрома, чем шестивалентного. Смертельные концентрации хромата и бихромата калия: для форели – 50, окуня – 75, карпа и карася – 37,5–52 мг/л.
Симптомы и патоморфологические изменения. При остром отравлении соединениями хрома рыбы обильно покрываются слизью и погибают от асфиксии, которая развивается за счет распада и слущивания респираторного эпителия жабр. Поражается и эпидермис кожи. Хроническое отравление шестивалентным хромом сопровождается скоплением в брюшной полости оранжево-желтой жидкости.
Диагноз ставят на основании клинико-анатомической картины отравления и определения содержания хрома в воде и органах рыб. Хром аккумулируется в жабрах, печени и почках. Для этого применяют колориметрический метод с дифенилкарбазидом.
Профилактика. Рыбохозяйственная ПДК калия двухромовокислого – 0,05 мг/л, хромовых квасцов – 0,01 мг/л, хрома (шестивалентного) – 0,001 мг/л. Допустимые остаточные количества хрома в рыбных продуктах – 0,3 мг/кг.
Другие тяжелые металлы (свинец, олово, кобальт, никель, серебро, селен, титан, ванадий, алюминий). Названные металлы содержатся в стоках свинцово-цинковых рудников, предприятий цветной металлургии, машиностроительной, лакокрасочной, химической промышленности. В воде растворяются в основном их сернокислые, хлористые и азотнокислые соли, а также встречаются металлоорганические соединения. Один из источников загрязнения воды свинцом – выхлопные газы бензиновых двигателей.
Токсичность. Для рыб более токсичны соединения свинца, серебра и алюминия.
Токсичность названных металлов в значительной степени зависит от жесткости воды: с повышением жесткости большинство соединений связывается и их токсические концентрации имеют более высокие значения, чем в мягкой воде. Кормовые организмы, как правило, более чувствительны, чем рыбы.
Симптомы и патоморфологические изменения. Картина острого и хронического отравлений рыб наиболее полно изучена при воздействии свинца. Действие остальных металлов этой группы сходно с действием свинца и других тяжелых металлов. Свинец, кроме того, обладает гемолитическими свойствами.
При остром отравлении названными металлами вначале появляется беспокойство, учащается дыхание, затем развивается общее угнетение и замедляется дыхание. Жабры и кожа покрываются слоем коагулированной слизи, в них обнаруживаются отек тканей, некробиоз и слущивание покровного эпителия, распад клеток кожи. При хроническом отравлении внешние признаки и местная реакция в жабрах и коже выражены слабее, преобладают некробиотические изменения во внутренних органах.
Для действия свинца характерны потемнение хвостового стебля (симптом нейротоксикоза) и искривление тела рыб. Параллельно с этим обнаруживаются очаговый некроз паренхимы печени, почек и селезенки, дистрофия мышечных пучков миокарда, резорбция половых клеток, гемосидероз в селезенке и почках. В крови снижается количество гемоглобина, эритроцитов и лимфоцитов, а также распад эритроцитов и появление эритробластов с делящимися ядрами.
Диагноз ставят так же, как и при прочих отравлениях тяжелыми металлами. При интоксикации свинцом полезны гематологические исследования. Для исследования воды рекомендуют следующие методы определения: свинца – колориметрические с дитизоном или сульфидом натрия; серебра – колориметрический с n-диметиламинобензилиденроданидом; алюминия – колориметрические с применением алюминона, а также атомно-абсорбционную спектрофотометрию для всех металлов.
По данным отдельных исследователей, фоновое содержание свинца в мышцах морских рыб – 0,43 мг/кг.
Профилактика заключается в предотвращении загрязнения рыбохозяйственных водоемов сточными водами. Установлено, что рыбохозяйственные ПДК в пресных водоемах: свинца – 0,1 мг/л, никеля – 0,01 мг/л, кобальта – 0,01 мг/л; в морских водоемах: свинца – 0,01 мг/л. кобальта – 0,005 мг/л. Допустимые количества в рыбных продуктах: алюминия – 30,0 мг/кг, никеля – 0,5 мг/кг, олова – 200 мг/кг, свинца – 1,0 мг/кг.
Соединения азота и фосфора. Азот и фосфор как биогенные элементы постоянно присутствуют в водоемах в виде различных соединений, образующихся при разложении органического вещества. Дополнительно они поступают с бытовыми, индустриальными и сельскохозяйственными стоками, а также в результате смыва минеральных удобрений с обрабатываемых полей. В разных зонах земледелия потери азота достигают 30–70% от количества внесенных удобрений, а в дренажных водах концентрация фосфора и калия увеличивается в 2–3 раза.
Избыточное накопление азота, фосфора и других биогенных элементов в водоемах приводит к интенсивному развитию фитопланктона (цветению воды), нарушению газового режима, отложению донных осадков. При разложении органических веществ образуются токсические продукты: трупные яды, аммиак, нитриты и нитраты, гидразин, сероводород, перекисные соединения, альдегиды и кетоны. Поэтому гибель рыб в таких водоемах, как правило, происходит от комплекса факторов: нарушения газового режима водоемов и отравления названными ядовитыми веществами.
Аммиак и соли аммония (NH3, NH4). В водоемах азот находится в нескольких переходных формах: органического азота, аммонийных солей и свободного аммиака, солей азотистой (нитритов) и азотной (нитратов) кислоты. Они образуются в процессе минерализации органического азота и дополнительно поступают со стоками коксохимической и пищевой промышленности, коммунально-бытового хозяйства, животноводческих ферм, с удобрениями, применяемыми в сельском и рыбном хозяйстве.
Токсичность. Аммиак относится к группе высокотоксичных для рыб соединений. Аммиак образуется в организме рыб как конечный продукт азотистого обмена и выделяется через жабры. Поэтому механизм возникновения отравления рыб аммиаком довольно сложен. Он зависит от концентраций экзогенного и эндогенного аммиака и изменчивости физико-химических свойств воды. При загрязнении водоемов аммиачными сточными водами наступает прямое отравление аммиаком. В период цветения воды, которое сопровождается суточными колебаниями температуры, рН, содержанием кислорода и двуокиси углерода, накоплением продуктов разложения органики, развивается комбинированный токсикоз, так называемый аутотоксикоз. Он обусловлен экзогенным и эндогенным аммиаком, а также дополнительным действием вышеназванных факторов.
Летальные концентрации аммиака при кратковременном воздействии составляют для мальков форели 0,2 мг/л, плотвы – 0,35, взрослой радужной форели – 0,6, ручьевой форели – 0,8, речного окуня – 1,4, голавля – 1, карпа и линя – 2 мг/л (NH4). Гибель икры наблюдалась при 5 мг/л. Минимально токсическая концентрация аммиака для карпов, вызывающая гистологические изменения в жабрах, находится на уровне 0,6 мг/л, а для угря – 0,25 мг/л.
Хроническое отравление лососевых рыб наступает в течение 35 сут при концентрации 0,04–0,1.
Гибель бентосных организмов наступает при концентрациях аммиака 2,7–5 мг/л, зоопланктона – 0,2 мг/л, а солей аммония – в пределах 20–200 и 16 мг/л соответственно.
Симптомы и патоморфологические изменения. Аммиак является типичным нервным ядом, обладающим также гемолитическим и локальным действием. Картина острого отравления довольно характерна. В начальной стадии постепенно повышается возбуждение и обостряется чувствительность рыб к механическим и световым раздражителям. Затем развиваются сильные судороги, проявляющиеся как бы толчкообразными движениями рыб, дрожанием плавников. Рыбы теряют равновесие, опускаются на дно и лежат с широко раскрытым ртом, расставленными плавниками и жаберными крышками.
Трупное окоченение хорошо выражено, поверхность тела и жабры обильно покрыты слизью, видны очаговые кровоизлияния. В высоких концентрациях аммиак вызывает дистрофию, вакуолизацию и некробиоз респираторного эпителия жабр и повышенное кровенаполнение внутренних органов, иногда некробиоз печеночных клеток. При более низких концентрациях сильнее проявляется гемолиз эритроцитов, нарушение функций нервной системы и дегенеративные изменения во внутренних органах.
Признаки хронического отравления солями аммония мало специфичны: рыбы угнетены, не принимают корма.
Диагноз ставят на основании симптомов болезни, патоморфологических изменений и результатов определения аммиака в воде и органах рыб. В воде определяют общий аммонийный азот колориметрическим способом с реактивом Несслера.
В патологическом материале аммиак обнаруживают качественной пробой с помощью трех индикаторных бумажек, смоченных щелочным раствором ацетата свинца, щелочным раствором сульфата меди и влажной лакмусовой бумажки. Посинение лакмусовой и медной бумажек указывает на присутствие аммиака в гомогенате органов, помещенных в коническую колбу с пробкой. Почернение свинцовой бумажки указывает на наличие сероводорода.
Профилактика заключается в запрещении сброса в рыбохозяйственные водоемы неочищенных сточных вод коммунально-бытового хозяйства, стоков из животноводческих ферм и промышленных предприятий и соблюдении правил применения удобрений и аммиачных ванн в рыбоводстве.
Рыбохозяйственные ПДК: свободного аммиака – 0,05 мг/л, аммония солевого (NH4) – 0,5–1,0 мг/л, нитритов – 0,08–0,2 мг/л, нитратов – 2–мг/л.
Фосфор и его соединения. В поверхностные воды фосфорные соединения попадают со стоками химических, пищевых предприятий, спичечных фабрик, смываются с полей, обрабатываемых удобрениями и пестицидами. В воде фосфор присутствует в виде фосфатов, галогенидов, фосфорорганических соединений и даже в форме элементарного фосфора.
Токсичность. Минимальной летальной концентрацией треххлористого фосфора для икры и молоди рыб является 40 мг/л, пятихлористого фосфора – 50 мг/л.
Симптомы и патоморфологические изменения. Картина острого отравления фосфором характерна для нервных ядов. При остром отравлении элементарным фосфором отмечают сильное пучеглазие, а при хроническом – брюшную водянку и ерошение чешуи. Патоморфологические изменения более четко выражены при хронической интоксикации. Они характеризуются обширными отеками, зернистой и жировой дистрофией, а также очаговым некробиозом печеночных клеток и дистрофией эпителия мочевых канальцев.
Диагноз на отравление элементарным фосфором ставят на основании внешних признаков отравления и патоморфологических изменений, а также анализа источников его поступления в водоемы.
Профилактика. Содержание фосфатов в воде карповых прудов не должно превышать летом 2 мг/л и зимой 0,5 мг/л, элементарный фосфор не допускается, ПДК трех- и пятихлористого фосфора – 0,1 мг/л.
Сероводород. Сероводород присутствует в природных водах в небольших количествах и образуются при разложении органических веществ. Он содержится в сточных водах коммунально-бытового хозяйства, металлургических, химических, целлюлозно-бумажных, кожевенных заводов в больших концентрациях.
В воде сера находятся в трех формах: свободного сероводорода, гидросульфид-ионов (HS') и сульфид-ионов (S"). Соотношение этих форм зависит от рН воды. При отклонении рН в кислую сторону, содержание свободного сероводорода резко возрастает, а в щелочную—наоборот. Он придает воде запах тухлых яиц при концентрациях 0,001—0,05 мг/л.
Токсичность сернистых соединений обусловлена главным образом действием неионизированных молекул сероводорода, а также тем, что в его присутствии в водоеме возникает резкий дефицит кислорода. Поэтому обнаружить свободный сероводород в воде очень трудно. Смертельной концентрацией сероводорода является: для форели – 0,86–1, гольяна – 6, карпа – 3,3–6,3 мг/л. Минимальной смертельной концентрацией сероводорода для рыб считают 1,0 мг/л.
Частичная гибель дафний наступает при концентрации сероводорода – 1,0 мг/л.
Симптомы и патоморфологические изменения. Сероводород – сильный нервный яд. Проникая в клетки, он связывается с железом и нарушает тканевое дыхание. На жаберный аппарат и кожу действует раздражающе.
При отравлении рыб сероводородом снижается частота и нарушается ритм дыхательных движений, уменьшается потребление кислорода, отмечаются расстройства координации движений и параличи. Смерть обычно наступает от остановки дыхания. Рыбы, перемещенные в чистую воду на стадии потери равновесия, быстро поправляются.
Патоморфологические изменения изучены недостаточно. Тело рыб обычно покрыто опалесцирующей слизью, внутренние органы кровенаполнены, эпителий жабр в состоянии некробиоза.
Диагноз устанавливают по внешним признакам интоксикации и результатам определения содержания сероводорода и сульфидов в воде. Количество сероводорода в воде определяют колориметрическим или йодометрическим методом. При высоком содержании сероводорода в воде и теле рыб можно пользоваться качественной пробой со свинцовыми бумажками или органолептическим определением по запаху.
Профилактика заключается в недопущении заиления дна водоема, а также исключении загрязнения их сточными водами.
Сульфиты и сульфаты. Вещества этой группы поступают в водоемы главным образом из целлюлозно-бумажных комбинатов.
Токсичность. Действие сточных вод целлюлозно-бумажной промышленности на водные организмы и водоемы двоякое. Органические компоненты сточных вод изменяют физико-химические свойства воды, резко снижая содержание в ней кислорода и образуя большое количество разлагающихся донных отложений. Ядовитые вещества сточных вод (сернистые соединения, меркаптаны, смолы, фенол и др.) оказывают на водные организмы комплексное токсическое действие, которое усиливается вследствие снижения в воде кислорода.
Соли сернистой кислоты в подкисленной воде вызывают гибель рыб в концентрации 0,5–1 мг/л. Сульфаты менее токсичны. Смертельные концентрации сульфатов калия, натрия, магния и кальция при экспозиции 4 суток колеблются от 800 до 3200 мг/л.
Симптомы и патоморфологические изменения. Сернистая кислота и сульфиты в высокой концентрации оказывают локальное действие, а в малых действуют резорбтивно. При остром отравлении сернистой кислотой вначале наблюдается сильное беспокойство рыб, учащение дыхания, затем наступает угнетение и развиваются параличи. Рыбы опрокидываются на бок, теряют равновесие. Отравление сопровождается усиленным выделением слизи и побледнением плавников. Кожный покров лососей, отравленных сульфитным щелоком, темнеет, пятна становятся незаметными. При отравлении сульфатами рыбы чаще угнетены, симптомы сглажены.
Диагноз ставят путем определения в воде сульфитов, сульфатов и других токсических веществ в зависимости от происхождения сточных вод.
Сульфиты устанавливают йодометрическим методом, а сульфаты – титрованием нитратом свинца с дитизоном в качестве индикатора.
Профилактика заключается в предотвращении поступления токсических продуктов и взвешенных веществ на станции биологической очистки сточных вод, использовании очищенных вод для оборотного водоснабжения. Рыбохозяйственная ПДК сульфатов 100 мг SO"мг/л, ПДК сульфитов не установлена.
Хлор и его соединения. Свободный хлор и его соединения (хлорамин, хлорная известь) широко используются в текстильной и бумажной промышленности, а также в качестве дезинфектантов в медицине и ветеринарии. В водоемы он может поступать с хлорированными промышленными и хозяйственно-бытовыми сточными водами, а также вноситься непосредственно с хлорной известью, применяемой в ихтиопатологии для дезинфекции водоемов и антипаразитарной обработки рыб.
Токсичность. В воде растворенный хлор присутствует в виде недиссоциированной хлорноватистой кислоты (HOCl) и ионов гипохлорита (ОСl-1), которые разлагаются с выделением атомарного кислорода и иона хлора. Хлор в виде НОCl более токсичен, чем ион гипохлорита. В нейтральной среде они находятся в равновесии. При рН 6 и ниже происходит сдвиг в сторону увеличения НОС1 (до 96%), а в щелочной среде преобладают гипохлорит-ионы. Свободный хлор мало стабилен и вызывает острые отравления, а вышеназванные соединения сохраняются длительно и действуют хронически.
Токсичность хлора тесно связана с температурой воды. Средне смертельная концентрация активного хлора при температуре 1,5–5° и экспозиции 24 ч составляет для сеголетков карпа 5,6, пестрого толстолобика 3,5 и белого амура 2,9 мг/л. При температуре 15–20° карповые рыбы погибают через 1–2 ч.
Хроническое отравление большинства карповых рыб наступает при концентрациях 0,02—0,2 мг/л.
Гибель зоопланктона наступает при концентрации хлора 2–5 мг/л, бурых и зеленых водорослей – при 1,4–2 мг/л.
Симптомы и патоморфологические изменения. Хлор обладает выраженным местно-раздражающим действием на жабры и кожу, а при всасывании в кровь вступает в прочную связь с SH-группами и необратимо блокирует активность тиоловых ферментов. Поэтому отравленные рыбы не выживают при перемещении их в чистую воду. Высокие концентрации хлора вызывают вначале сильное возбуждение рыб. Они выпрыгивают из воды, совершают круговые движения, перевертываются на бок, у них отмечают судорожные подергивания плавников и хвостового стебля. Затем наступает фаза угнетения и паралича, рыба становится малоподвижной, лежит на дне. Поверхность тела и жабры покрываются слизью, по краям плавников и жаберных лепестков видны белые полосы шириной 2–3 мм. При гистологическом исследовании обнаруживают отек тканей, дистрофию, некробиоз и слущивание респираторного эпителия жабр и эпидермиса кожи. Слизистые клетки сильно гипертрофированы.
При воздействии низких концентраций внешние признаки отравления менее заметны.
Диагноз ставят на основании клинических признаков, патоморфологических изменений и результатов определения в воде активного хлора йодометрическим методом. В органах рыб хлор не обнаруживается.
Профилактика. Для рыбоводных целей должна использоваться дехлорированная вода, наличие свободного хлора не допускается. Для освобождения от хлора сточные воды подвергают аэрации, пропускают через отстойники или сооружают установки-дехлораторы.
Фтор и его соединения. Содержание фтора в поверхностных водах невелико – в пресных 0,01–0,4, морских – до 1 мг F/л. Фтор может поступать со сточными водами предприятий стекольной и металлургической, промышленности, заводов по производству цемента, суперфосфата, а также со смывами с сельскохозяйственных полей, обработанных удобрениями. Из соединений фтора наиболее распространены фтористый и кремнефтористый натрий, плавиковая кислота и др.
Токсичность. Фториды относятся к группе средне- и малотоксичных для рыб соединений. Поскольку фтор легко связывается с кальцием, с повышением жесткости воды токсичность фторидов резко понижается.
Смертельная концентрация кремнефтористого натрия в мягкой водопроводной воде для карпа равна 22 мг/л (12,5 мг/л фтор-иона). Границей выживаемости карпов в растворах плавиковой кислоты является 6 мг/л фтор-иона.
Высокая смертность морских гидробионтов (моллюсков, криля и камбалы) отмечена при концентрации в воде 50–100 мг/л фтор-иона.
Симптомы и патоморфологические изменения. Фторсодержащие соли – протоплазматические яды, действующие в основном на различные ферменты, а также на углеводный обмен и тканевое дыхание. Кроме того, фтор связывает кальций, что приводит к нарушению кальциевого и фосфорного обмена.
При остром отравлении они действуют в основном на нервную систему и на жабры. Симптомы острого отравления характеризуются возбуждением, повышенной подвижностью рыб, учащением дыхания, потерей равновесия и координации движений, а также судорожными подергиваниями плавников к хвостового стебля. Иногда отмечается ерошение чешуи, экзофтальмия.
При хроническом отравлении преобладают дегенеративно-некробиотические изменения в паренхиматозных органах, возможно размягчение костей.
Диагноз. При диагностике интоксикации рыб фтористыми соединениями, помимо анализа клинико-патоморфологической картины, определяют содержание фтор-иона в воде и органах рыб (жабрах, чешуе и мышцах) методом С. К. Гущина.
Профилактика заключается в предотвращении попадания фторсодержаших сточных вод, ПДК фтор-иона 0,05 мг/л в дополнение к фоновому содержанию фторидов, но не выше их суммарного содержания 0,75 мг/л.
6.2. Характеристика органических веществ. Источники поступления в водоемы, токсичность, диагностика отравления гидробионтов
Нефть и нефтепродукты. Нефть и нефтепродукты (бензин, керосин, мазут, дизельное топливо, смазочные масла и др.), в состав которых входят разнообразные углеводороды, циклические соединения, нафтеновые кислоты и др., относятся к числу широко распространенных загрязнителей воды. Нефть и нефтепродукты попадают в водоемы со стоками с нефтепромыслов и нефтеперерабатывающих предприятий, с нефтеналивных судов, смываются талыми и дождевыми водами с территорий различных промышленных, сельскохозяйственных и транспортных предприятий, нефтебаз.
Токсичность. Нефть и нефтепродукты действуют на водную фауну в нескольких направлениях:
поверхностная пленка нефти задерживает диффузию газов из атмосферы в воду и нарушает газовый обмен водоема, создавая дефицит кислорода;
маслянистые вещества, покрывая поверхность жабр тонкой пленкой, нарушают газообмен и приводят к асфиксии рыб;
водорастворимые соединения легко проникают в организм рыб;
донные отложения нефти подрывают кормовую базу водоемов и поглощают кислород из воды.
Токсичность нефти и нефтепродуктов для рыб колеблется в широких пределах. Острое отравление большинства видов рыб наступает при концентрации эмульгированных нефтепродуктов 16–97 мг/л. Бензин и дизельное топливо токсичны для молоди форели в концентрациях 40–100 мг/л.
Токсичность водорастворимых нефтепродуктов также зависит от химического состава. Для дафний губительны концентрации выше 0,1 и хирономид – выше 1,4 мг/л.
При длительном воздействии углеводороды нефти могут накапливаться до токсического уровня в жировой ткани, внутренних органах и мышцах рыб, а также способны передаваться по трофической цепи. Потребление в пищу таких продуктов, особенно содержащих канцерогенные бензопирены, опасно для здоровья человека.
Симптомы и патоморфологические изменения. При остром отравлении рыб нефтью преобладают признаки расстройства функций нервной системы и нарушения дыхания, вызванного локальным действием нефти на жабры. В ранних стадиях интоксикации рыбы очень подвижны, стремятся выпрыгнуть из воды, затем перевертываются на бок, теряют равновесие, совершают круговые движения, дыхание учащенно в 1,5–2 раза. Затем наступает фаза угнетения, рыбы переходят в наркотическое состояние и гибнут с явлениями паралича центра дыхания.
Трупы погибших рыб тусклые, с признаками очагового дерматита, проявляющегося пятнистой гиперемией кожи, распадом и слущиванием эпидермиса и иногда образованием язв.
При подостром и хроническом отравлении в паренхиматозных органах (печени, почках, поджелудочной железе) ярко выраженные некробиотические изменения паренхиматозных клеток сочетаются с пролиферативной реакцией, выражающейся увеличением количества макрофагов и меланоцитов селезенки и почек. Во всех случаях погибшие рыбы имеют сильный «нефтяной» запах и привкус.
Диагноз ставят на основании клинико-анатомических признаков отравления, определения нефтепродуктов в органах рыб, а также органолептических показателей
Профилактика заключается в периодическом контроле чистоты водоисточников, установлении защитных приспособлений, препятствующих распространению нефти по поверхности воды.
Рыбохозяйственные ПДК нефти и масел в пресноводных водоемах 0,001 мг/л.
Спирты, эфиры, галогениды попадают в водоемы из предприятий химической и пищевой промышленности.
Токсичность. Спирты, эфиры и галогениды мало токсичны для рыб. Они обладают четко выраженным наркотическим действием. Рыбы впадают в состояние наркоза при следующих концентрациях: метилового спирта – 31,7 г/л, этилового спирта – 13 г/л, пропилового спирта – 2,8–5,6 г/л, бутилового спирта 1 – 1,6 г/л, дихлорэтилового эфира – 302,0–646,0 мг/л, хлороформа – более 60 мг/л.
Симптомы и патоморфологические изменения. Наркотическое действие проявляется возбуждением рыб, которое вскоре сменяется резким угнетением, сопровождающимся замедлением подвижности рыб, потерей равновесия, замедлением дыхательных движений и гибелью от паралича центра дыхания.
Диагноз ставят по характерной клинической картине, а также определением их содержания в воде и рыбе методами, применяемыми в медицине.
Профилактика основывается на общих принципах.
Альдегиды и кетоны (формальдегид и параформальдегид, ацетон и др.) встречаются в сточных водах промышленных предприятий по производству пластмасс, красителей, смол и др. Формалин используется в ихтиопатологии для борьбы с эктопаразитами.
Токсичность. Альдегиды и кетоны обладают нервно-паралитическим действием, а формальдегид действует еще и раздражающе. К формальдегиду более чувствительны лососевые, чем карповые. Смертельные концентрации формальдегида для карпа при экспозиции 24–48 ч составляют 50–80 мг/л, параформальдегида – 1,0–2,0 г/л. Ацетон для водных организмов мало токсичен — гибель рыб наблюдается при концентрациях более 15 г/л.
Симптомы и патоморфологические изменения. Симптомы отравления рыб ацетоном, параформальдегидом не специфичны. Более выражены они при интоксикации формалином. Острое отравление проявляется сильным возбуждением рыб. Кожный покров их темнеет, наблюдается коагуляция слизи. В жабрах обнаруживаются отек, набухание, дистрофия и распад респираторного эпителия.
Диагноз ставят на основе внешних признаков и патоморфологических изменений, а также определения формальдегида в воде.
Профилактика. При обработке рыб формалином следует строго соблюдать рекомендованные терапевтические концентрации.
Ароматические углеводороды и их производные (бензол, толуол, ксилол, нафталин, анилин др.) могут поступать с различных предприятий — нефтеперерабатывающих, по производству пластмасс, каучука и др.
Токсичность. Эти вещества относятся к группе нервно-паралитических ядов, для рыб они средне токсичны.
Симптомы и патоморфологические изменения. При остром отравлении наблюдают сильное возбуждение, повышенную чувствительность к внешним раздражителям, судороги, потерю равновесия, нарушение координации движений и параличи. Хроническое отравление характеризуется истощением рыб, повышением уровня гемоглобина и числа эритроцитов, лейкопенией. Нитросоединения и анилин вызывают метгемоглобинемию.
При гистологическом исследовании обнаруживают в печени и почках очаговые кровоизлияния, дистрофические и некробиотические изменения. Мышечная ткань и органы рыб приобретают специфический запах.
Диагноз основывается на комплексе клинико-анатомических признаков, органолептическом исследовании органов рыб, определении углеводородов в воде.
Профилактика, см. общую профилактику. ПДК бензола и толуола – 0,5 мг/л, ксилола – 0,05, анилина – 0,0001, нафталина – 0,004 мг/л.
Фенол. Фенольные сточные воды — наиболее распространенная группа органических загрязнителей, образующихся при термической переработке твердого топлива, производстве пластмасс, синтетических тканей, красителей, бумаги и др. Фенолы широко используются для синтеза различных ароматических соединений, дезинфекции, пропитки древесины, в качестве пестицидов и многих других целей.
Токсичность. Соединения фенольного ряда в зависимости от физико-химических свойств и структуры молекул значительно отличаются одно от другой по степени токсичности для рыб и других гидробионтов. В порядке повышения токсичности они располагаются следующим образом: резорцин, фенол, крезолы, нитрофенолы, нафтолы, гидрохинон, хлорфенолы.
Остро летальные концентрации фенола для карповых рыб колеблются в пределах 3–25 мг/л.
Из производных фенолов, содержащих гидроксильные группы, наиболее токсичен гидрохинон. Для окуневых и карповых рыб гидрохинон токсичен в концентрациях 0,2–1 мг/л.
Фенолы способны накапливаться в рыбах и передаваться по трофической цепи. В наибольшем количестве они обнаруживаются в печени, а затем (в порядке уменьшения) в жабрах, почках, селезенке, мышцах и кишечнике.
Обратимость фенольной интоксикации высокая. Рыба приобретает фенольный запах и вкус при содержании в воде смеси фенола и крезолов 0,02–0,03 мг/л.
Симптомы и патоморфологические изменения. Соединения фенольного ряда – нервно-паралитические яды, вызывающие резкие нарушения функций центральной нервной системы.
Тело рыб после смерти дугообразно изогнуто, боковые стенки туловища светлые, а голова и спина темные. При высоких концентрациях на брюшке видны пятнистые кровоизлияния, тело обильно покрыто слизью, кровь плохо свертывается, густая.
Диагноз ставят на основании клинических признаков, патоморфологических изменений, анализа токсикологической ситуации и результатов определения фенольных соединений в воде и органах рыб.
ПДК фенола – 0,001 мг/л.
Пестициды – собирательное название химических средств защиты растений от болезней, вредителей и сорняков, а также регуляторов роста и других веществ, используемых для борьбы с вредными организмами. В сельском и лесном хозяйствах применяется широкий ассортимент пестицидов, относящихся к различным классам химических соединений: мышьяксодержащие препараты (парижская зелень и др.); хлорорганические (ДДТ, гексахлоран, алдрин и др.); фосфорорганические (хлорофос, карбафос и др.); сероорганические (каптан и др.); ртутноорганические (меркузан и др.) и прочие соединения.
Большое распространение получили хлор- и фосфорорганические соединения.
Благодаря кумулятивным свойствам ряда пестицидов (ДДТ, ГХЦГ, гептахлор, алдрин, дилдрин и др.) они могут накапливаться в объектах внешней среды. При переходе пестицидов из воды в другие звенья биологической цепи увеличивается их содержание в сотни и даже тысячи раз. Рыба из таких водоемов представляет потенциальную опасность для человека при употреблении ее в пищу.
Наиболее токсичны для водной фауны хлорорганические соединения, особенно алдрин, ДДТ, гептахлор.
Хлорорганические соединения (ХОС) широко применяют в качестве инсектицидов, акарицидов и фунгицидов для борьбы с вредителями зерновых, технических и овощных культур, лесонасаждений, плодовых деревьев
ХОС обладают высокой химической стойкостью к воздействию различных факторов внешней среды, относятся к группе высокостабильных и сверхвысоко стабильных пестицидов. В почве ДДТ сохраняется 12 и более лет
Токсичность. Рыбы и другие водные организмы более чувствительны к ХОС, чем наземные животные. Особенно чувствительны к ХОС водные ракообразные и насекомые.
В организм рыб ХОС поступают осмотически через жабры и через пищеварительный тракт с кормом. Интенсивность поглощения ХОС рыбами увеличивается при повышении температуры воды. Гидробионты способны концентрировать ХОС в больших количествах, чем в окружающей среде (воде, грунте), коэффициент накопления этих веществ составляет в грунте 100, зоопланктоне и бентосе – 100–300, рыбах – 300–3000 и более.
В первую очередь ХОС накапливаются в органах и тканях, богатых жирами или липоидами. У рыб их больше всего находят во внутреннем жире, головном мозге, желудочной и кишечной стенке, гонадах и печени, меньше — жабрах, мышцах, почках и селезенке. С возрастом рыб отмечено увеличение концентрации ХОС.
Симптомы и патоморфологические изменения.
Несмотря на различие в химической структуре, картина отравлений рыб хлорорганическими пестицидами однотипна. В первую очередь они действуют на рыб как нервные яды.
Сроки появления признаков отравления зависят от величины концентраций препаратов и времени их воздействия. При остром отравлении они наступают через несколько часов после начала контакта с ядом, а при хроническом – через 7–10 дней.
Наиболее бурно симптомы проявляются при остром отравлении и характеризуются они повышенной возбудимостью, резким повышением подвижности рыб, отсутствием реакции на прикосновение к телу, нарушением координации движения (плавание по кругу, спирали, опрокидывание на бок) и полной потерей равновесия, замедлением дыхания. В стадии агонии развиваются параличи, гибель наступает от паралича центра дыхания. При вскрытии погибших рыб обнаруживают выраженное полнокровие внутренних органов, особенно печени и предсердия, иногда встречаются мелкоточечные кровоизлияния в жабрах.
При хроническом отравлении рыбы перестают потреблять корм, угнетены или ведут себя беспокойно, интенсивно плавают у поверхности воды, затем они теряют равновесие, перевертываются на бок и погибают в состоянии депрессии. Печень погибших рыб набухшая, увеличена в объеме, с бледноватым оттенком.
В случаях острого и особенно хронического отравления устанавливают снижение уровня гемоглобина и количества эритроцитов (на 10–20%), лейкопению (число лейкоцитов снижено на 60%).
Диагноз ставят на основании комплексных исследований; анамнестических данных, клинико-анатомической картины интоксикации и обнаружения пестицидов в воде, грунте, органах рыб и других гидробионтах. Хлорорганические пестициды в этих объектах определяют газохроматографическим методом.
Профилактика заключается в недопущении внесения ХОП в водоохранной зоне, склоновых участках и основной водосборной площади водоемов, соблюдении правил применения, хранения, транспортирования и утилизации пестицидов, периодическом контроле их остатков в воде, грунте, гидробионтах.
Фосфорорганические соединения (ФОС) – это большая группа пестицидов различного назначения (акарицидов, инсектицидов, фунгицидов, нематоцидов, гербицидов). Для борьбы с эктопаразитами рыб используют хлорофос и карбофос, остальные попадают в водоемы такими же путями, как ХОС.
Фосфорорганические соединения, за исключением некоторых (хлорофос), плохо растворимы в воде и хорошо — в органических растворителях.
Токсичность.
В организм рыб они поступают в основном осмотически через жабры и частично кожу, распределяются по всем органам и тканям, концентрируясь в наибольших количествах во внутренних органах (печени, почках, стенке кишечника, селезенке). В процессе метаболизма ФОС в органах рыб могут образовываться более токсичные метаболиты.
Способность к материальной кумуляции у ФОС выражена слабее, чем у ХОС.
Наиболее токсичны для рыб производные фосфорной кислоты. Токсичность дихлофоса при 24 ч экспозиции составляют для форели 0,5, карпа – 1, молоди севрюги – 1 мг/л.
Остро токсические концентрации хлорофоса для форели, щуки, окуня составляют 0,75–1,0 мг/л, а для карповых они более высокие: для карпа – 100 мг/л, плотвы – 300, гольяна – 180 мг/л. Дафнии и водоросли погибают при концентрации 0,5 мг/л через 24 ч
Симптомы и патоморфологические изменения. Признаки отравлений рыб фосфорорганическими пестицидами отличаются только некоторыми особенностями в зависимости от препарата. С повышением концентрации и увеличением экспозиции воздействия интенсивность их проявления усиливается. Для отравлений рыб ФОС характерен нервно-паралитический синдром.
Острое отравление характеризуется постепенным переходом от фазы возбуждения рыб с наличием судорог и мышечных фибрилляций к резкому угнетению и параличам. При длительных спазмах туловище рыб со временем искривляется. Этот признак отмечен при действии хлорофоса.
Хроническое отравление проявляется аналогичными признаками, которые возникают в более отдаленные сроки (через 10–15 дней) и слабее выражены. Искривления туловища становятся необратимыми. Рыбы не питаются, худеют вплоть до истощения.
Патологоанатомические изменения в органах отравленных рыб не специфичны.
Диагноз. Определяют активность ацетилхолинэстеразы (АХЭ) в крови или головном мозге отравленных рыб. Однако следует помнить, что угнетение АХЭ вызывают и некоторые другие пестициды, например карбаматы.
Количество большинства ФОС в воде, грунте и органах рыб определяют методами тонкослойной или газо-жидкостной хроматографии.
Химические исследования на наличие ФОС следует проводить как можно раньше, но не позднее чем через 3–5 дней. Материал не консервируют, а хранят на льду или в холодильнике.
Детергенты – моющие синтетические поверхностно-активные вещества (СПАВ). Поступают в водоемы с коммунальными и частично промышленными водами. В состав детергентов входит 20–40% поверхностно-активных веществ и 60–80% различных добавок.
СПАВ делят на три группы:
а) анионоактивные вещества – щелочные соли (алкилбензосульфонаты, алкилсульфонаты), легко окисляются в воде с образованием анионов;
б) катионоактивные вещества – соли органических оснований (нитрилы, амины), ионизируются в водных растворах, обладают бактерицидными и дезинфицирующими свойствами;
в) неионогенные вещества – простые и сложные эфиры жирных спиртов, жирных кислот, наиболее устойчивы.
Биологически «мягкие» СПАВ разрушаются в очистных сооружениях на 80—90%. а в природных водоемах – в течение 1–4 дней. Биологически «жесткие» при биологической очистке распадаются на 35—40%, а в водоемах сохраняются 2–3 мес и более.
В концентрациях 0,1–0,5 мг/л СПАВ образуют пену, при 0,6–180 мг/л придают воде специфический запах, а при 60–11000 мг/л горький привкус.
Токсичность. Детергенты относятся к группе высоко- или среднетоксичных для рыб соединений. Минимально токсичные концентрации анионоактивных веществ при 10—20-дневной экспозиции и температуре воды 15–18 °С для разных видов рыб колеблются от 1,5 до 15 мг/л, а неионогенных детергентов – 1–10 мг/л. Катионоактивные СПАВ токсичны для линей и форели в разведениях 1 : 30 000–1 : 40 000.
Детергенты локализуются в основном в жабрах, стенке пищеварительного тракта и частично в гонадах рыб.
Симптомы и патоморфологические изменения. Анионоактивные вещества обладают резорбтивным и местным действием, неионогенные – преимущественно локальным, а катионоактивные – нарушают в основном функциональную активность нервной системы. Острые отравления разными детергентами проявляются примерно одинаково. При высоких концентрациях СПАВ наблюдается сильное беспокойство или, наоборот, угнетение рыб, нарушается координация движения, реакции на внешние раздражители подавлены, туловище обильно покрывается слизью, отмечаются типичные симптомы удушья. У погибших рыб жаберные крышки широко раскрыты, хвостовой стебель иногда загнут вверх.
Диагноз ставят на основании клинической и патологоанатомической картины отравления с обязательным определением содержания детергентов в воде. Детергенты определяют колориметрическими методами в присутствии следующих реактивов: при определении анионоактивных веществ – метиленового синего, неионогенных – хлористого бария и катионоактивных – бромфенолового синего.
Поскольку СПАВ образуют пену в более низких, чем токсичные для рыб, концентрациях, приближенное количество их в воде можно определять по пенообразованию. Для этой цели используют цилиндровый метод. В цилиндр с притертой пробкой емкостью 1 л наливают 500 мл исследуемого раствора СПАВ или воды из водоема, производят 15 умеренно резких опрокидываний цилиндра в течение 15 с и определяют количество образовавшейся пены. Слой мелкой пены высотой 1,0—1,5 мм соответствует пороговой концентрации ПАВ (0,1–0,7 мг/л). Стабильная крупная пена появляется при концентрациях 0,4 – 2,8 мг/л.
Профилактика. Наиболее эффективной мерой по охране водоемов от загрязнения и предотвращению отравлений рыб детергентами является замена «жестких» веществ более «мягкими» СПАВ. Поскольку существующие методы очистки не обеспечивают полное удаление детергентов из сточных вод, использование в различных отраслях должно строго контролироваться, а спуск сточных вод регламентироваться соответствующими нормативами.
Яды растительного происхождения. Из сплавной древесины и других растительных продуктов в воду экстрагируются алкалоиды, гликозиды, терпены, эфирные масла, смолы, дубильные вещества, биотоксины сине-зеленых водорослей.
Токсичность. Растительные яды относятся к веществам нервно-паралитического действия, многие из них высокотоксичны для гидробионтов. Например, ротенон – вещество, получаемое из корней тропических растений и используемое в качестве ихтиоцида, вызывает гибель рыб в концентрации 0,01 – 0,02 мг/л. Сапонины, постоянно присутствующие в сточных водах сахарных заводов, в концентрации 4–5 мг/л губительны для большинства пресноводных рыб. Продукты выщелачивания древесины токсичны для рыб при соотношении к воде 1:4 (2–10 мг/л экстрактивных веществ). При массовом развитии сине-зеленых водорослей создается дефицит кислорода, наблюдаются резкие колебания рН и накапливаются в воде токсичные продукты: аммиак, индол, специфические токсины водорослей и др.
Симптомы и патоморфологические изменения не отличаются специфичностью и свойственны действию нервно-паралитических ядов.
Диагноз ставят комплексно на основании выявления нарушений гидрохимического режима водоемов, подтверждения токсичности воды и рыбы в биопробе на рыбах и лабораторных животных, а также определения предполагаемых ядов.
Профилактика. Основным в профилактике являются очистка водоемов от вредной растительности, механическое и химическое удаление сине-зеленых водорослей, рациональное регулирование лесосплава, подъем затонувшей древесины и очистка дна от излишнего ила.
7. ЧУВСТВИТЕЛЬНОСТЬ И УСТОЙЧИВОСТЬ РЫБ К ТОКСИКАНТАМ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА УСТОЙЧИВСТЬ РЫБ К ТОКСИКАНТАМ
Устойчивость – это способность организма как можно дольше выживать при длительном воздействии на него малых концентраций токсического вещества или при краткосрочном действии больших концентраций этого вещества за счет различных регуляторных механизмов. Понятно, что чем раньше будут включены регуляторные механизмы (изменение проницаемости клеток и тканей, метаболические превращения, снижающие токсичность токсиканта или выведение чужеродного вещества),тем выше будет время выживания (выше устойчивость) рыб. Очевидно, что регуляторные механизмы будут включены тем раньше, чем более чувствителен данный организм к токсиканту.
Чувствительность – это способность организма воспринимать токсикант. По физиологическому содержанию понятие «чувствительность» близко к понятию «возбудимость». Мерой возбудимости является минимальная сила раздражителя, в данном случае химического, которую называют порогом раздражения, чем больше минимальная сил химического раздражителя, необходимая для вызова какой-либо реакции, тем выше порог раздражения, тем ниже возбудимость, тем ниже чувствительность организма к данному веществу. Отсюда понятно, что чем выше возбудимость организма, тем выше его чувствительность.
Экспериментальные исследования по сравнительному изучению устойчивости и чувствительности к фенолу 21 вида рыб показала, что ведущую роль в определении устойчивости рыб к токсикантам играют видовые особенности рыб. Вместе с тем, установлено, что токсикорезистентность рыб к токсикантам обусловлена целым рядом факторов: возраст рыб, экологические факторы, концентрация и время действия токсиканта и др.
7.1. Характер зависимости «концентрация – время»
Известно, что реакции животного на токсическое раздражение возникают при определенной концентрации или дозе токсического агента, а интенсивность их нарастает параллельно увеличению концентрации токсиканта. Иными словами, реакции организма, обусловленные, воздействием токсических агентов, носят градированный характер, что позволяет весьма полно характеризовать токсикодинамику испытуемого вещества, но чрезвычайно затрудняет количественную оценку токсической активности. Для преодоления этого препятствия было предложено использовать не всю гамму возникающих в организме сдвигов а лишь конечный эффект, то есть гибель или выживание животного. Такой способ оценки токсического эффекта в альтернативной форме по принципу все или ничего получил в настоящее время широкое распространение и позволил наиболее точно на основе математических методов проводить количественную оценку токсических свойств изучаемого соединения и сопоставлять получаемые результаты.
Фактор времени наряду с концентрацией яда играет решающую роль в определении степени токсичности исследуемого вещества. Время является одним из составных элементов отношения «концентрация – время», на котором базируется вся математическая функция, объясняющая токсический процесс. Известно, что при одной и той же концентрации токсиканта выраженность и исход токсического процесса меняются в зависимости от времени действия яда на организм. Следовательно, продолжительность наблюдений оказывает решающее влияние на оценку степени токсичности того или иного вещества.
Данные, полученные в опытах с различными группами химических токсикантов, убедительно свидетельствуют о ведущей роли фактора времени в определении степени токсичности различных групп веществ. Особое значение длительность опытов приобретает при изучении малотоксичных соединении, вредное действие которых проявляется только после длительного контакта рыб с ними.
В качестве показателя токсичности того или иного соединения и уровня устойчивости рыб к нему часто используют такие понятия как:
время погружения;
время развития токсического эффекта;
время выживания.
Время погружения – по своему содержанию близко к понятию «латентный период», т. е. промежуток времени между началом контакта рыбы с ядом и первыми признаками отравления. Первоначальные признаки отравления и длительность латентного периода интоксикации будут различны в зависимости от природы испытуемого вещества и вида рыб. Так, большинства видов рыб первыми признаками отравления фенолами являются бурная двигательная активность и неориентированное плавание, а у угря и налима – судорожные подергивания мышц туловища. При испытании токсичности растворов тяжелых металлов в качестве первого признака отравления рыб может быть использовано расстройство дыхания. Вполне попятно, что время погружения или латентный период будут весьма различны по абсолютной величине и определяются главным образом механизмами реализации токсического действия яда. Яды, оказывающие преимущественное действие на центральную нервную систему, имеют короткий латентный период, исчисляемый секундами, а те из них, которые оказывают локальное воздействие на рыб, имеют более длительный латентный период (минуты, часы и даже сутки).
Критерий «время погружения» весьма ценен с точки зрения оценки латентного периода интоксикации, который может быть использован для характеристики степени чувствительности рыб к яду. Именно поэтому он мало полезен в качестве показателя степени устойчивости рыб к яду или степени токсичности испытуемого вещества.
Время развития токсического эффекта представляет собой время наступления одного из наиболее показательных признаков отравления. Чаще всего в качестве такого признака используют потерю рефлекса равновесия, т. е. время опрокидывания, именуемое также временем проявления (manifestation time). Под временем проявления подразумевается время, в течение которого рыба теряет способность к движению и не может долго удерживать равновесие в проточной воде. Широкое использование этого критерия для оценки токсичности вещества встречает ряд общих и частных затруднений. Так в случае испытания токсичности веществ, не влияющих на нервную систему рыб (большинство солей тяжелых металлов, щелочи, неорганические кислоты), потеря рефлекса равновесия наступает обычно незадолго до их гибели. Кроме того, при действии на рыб других веществ в качестве наиболее характерного признака отравления могут быть использованы иные показатели, скажем, изменение интенсивности потребления кислорода.
Однако даже при воздействии на рыб ядов, вызывающих потерю рефлекса равновесия, едва ли имеет смысл использование времени проявления в качестве критерия токсичности. Опыты показывают, что при изучении токсичности ядов фенольного ряда в растворах концентрацией от 10 до 50 мг/л (в зависимости от вида) имеет место волнообразное течение интоксикации, при котором периоды потери равновесия и полного обездвижения чередуются с кратковременными появлениями у рыб способности к импульсивным перемещениям в боковом положении.
Время выживания – представляет собой время, необходимое для развития летального отравления и является одним из наиболее полноценных критериев токсичности различных веществ и динамики изменения токсичности в зависимости от концентрации вещества в опытах с острым отравлением.
В настоящее время в ихтиотоксикологии большую популярность приобрели кривые зависимости «концентрация – время» (concentration – time).
Если составить график, в котором по оси абсцисс откладывается концентрация, а по оси ординат – время выживания, то при интерполяции с экспериментальными данными график имеет более или менее сигмоидную форму и лишь его средняя часть будет прямой (рис.1). Если продолжить эту прямую линию до пересечения с осью абсцисс, то точку пересечения условно можно назвать теоретическим порогом токсичности.
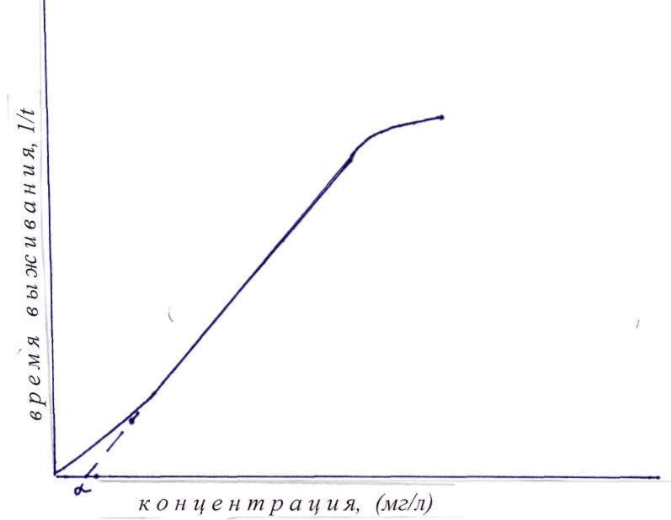
Рис. 1. Отношение между временем выживания и концентрацией: α- теоретический порог токсичности
Форма кривых «концентрация – время» весьма вариабельна для различных ядов и в известной мере зависит от механизма их действия на организм. Время выживания рыб в токсических растворах, вероятно, определяется механизмом их действия и большим разнообразием других факторов, поэтому следует с известной осторожностью оценивать попытки определять токсичность неиспытанных концентраций, исходя из предположения о математическом характере связи концентрация – время.
Необходимо с осторожностью подходить к определению пороговых концентраций ядов только на прямолинейной части кривой и экстраполяции этих данных за пределы, в которых имеет место прямолинейное отношение.
В опытах по определению токсичности фенола для рыб установлено, что в области концентраций 800–200 мг/л время гибели рыб с разведением возрастало, но при дальнейшем разведении (от 200 до 100 мг/л) время гибели резко уменьшалось, и в растворе фенола концентрацией 100 мг/л караси погибали значительно раньше, чем в растворе концентрацией 200 мг/л (рис.2).

Рис. 2. Отношение между временем выживания (по оси ординат – среднее время выживания рыб в часах) и концентрацией фенола (мг/л), логарифмическая шкала: сплошная – теоретически ожидаемая кривая, пунктиром – опытная кривая
Из сказанного выше следует что, установление ПДК и особенно пороговых концентраций промышленных сточных вод – задача весьма сложная и никто не может предполагать без риска только путем умозрительных заключений и экстраполяцией на графиках без соответствующих экспериментов, что время выживания животных всегда будет увеличиваться с разведением, сточных вод, а их токсичность – уменьшаться.
Описываемая связь между концентрацией и временем действия часто нарушается. В реальности эта закономерность имеет более сложный характер и выражается в фазности. В диапазоне относительно малых концентраций или кратковременных воздействий отмечаются диапазоны как угнетающие, так и стимулирующие. Выявляются следующие временные фазы реакции организма на токсическое воздействие:
- период безразличия или некоторого нарушения функций, иногда довольно существенного;
- период нормализации или даже стимуляции жизненных процессов;
- период финальных нарушений.
В общих чертах эта последовательность реакций перекликается с концепцией адаптационного синдрома, в котором выделяются фазы «тревоги», «компенсации» и «истощения» в ответе организма на неблагоприятное воздействие.
Такого же характера зависимость удается получить для реакции на разные концентрации при постоянном времени учета ответа. Оказывается, что зависимость ответа от концентрации и времени воздействия сходны. Диапазон концентраций или сроков воздействия, в которых с возрастанием воздействия эффект не только не возрастает, но может наблюдаться и обратная картина - видимое улучшение состояния организма и даже стимуляция функций, как для отдельных функций, так для общего состояния.
Причину описываемого явления можно понять, если вспомнить, что в организме проходят одновременно две категории процессов - развитие деструктивных процессов под влиянием вещества и ответных компенсаторных, адаптивных и репарационных реакций организма на разных уровнях. Процессы, приводящие к поражению, и ответные реакции организма сопряжены между собой по времени и по интенсивности. Активность реагирования зависит от уровня токсического воздействия. Эта сопряженность характеризуется следующими основными закономерностями:
- на начальном этапе токсического воздействия ответные реакции каждой из функций организма отстают по времени от развития вызвавших их деструктивных процессов;
- для формирования ответной реакции функций организма необходимо достижение определенного порога токсического повреждения этой функции;
- ответная реакция функции развивается с упреждением по принципу избыточного реагирования.
Вероятно, ответная реакция функций имеет некоторый предел интенсивности или изменяется дискретно, переходя с одного уровня на другой.
Повреждение развивается только тогда, когда скорость процессов повреждения (инактивация, дегенерация и др.) превышает скорость процессов приспособления и восстановления.
При остром воздействии токсический эффект может частично ослабляться, но полностью не компенсируется. При более слабом воздействии первичный эффект затем может быть полностью погашен компенсацией. Если воздействие продолжается, то может наступить и такой период времени, когда продолжающаяся кумуляция повреждений выходит за пределы компенсаторного потенциала организма и может развиваться без ограничения.
Чаще всего в основе гибели при токсическом воздействии лежит поражение одного из жизненно важных органов или систем. Поэтому динамика гибели организма во времени определяется соотношением рассмотренных выше процессов в этой чувствительной системе или органе. В зависимости от времени воздействия может последовательно выявляться роль других органов или систем. Таким образом, в динамике суммарного эффекта возможно проявление кумуляции и компенсации в этих органах и системах.
Взаимосвязь этих двух процессов делает возможным существование таких периодов времени, когда результирующий повреждавший эффект меньшей концентрации проявляется сильнее, чем большей, что объясняет причину возникновения различных парадоксальных эффектов.
7.2. Влияние видовых, возрастных и индивидуальных особенностей, сезонных и некоторых других факторов на токсикорезистентность рыб
Знание видовых особенностей чувствительности рыб к ядам имеет важное значение как для распознавания загрязнения водоема, так и направленного изменения видового состава в рыбохозяйственном водоеме под влиянием токсических веществ. Отмечено, что организмы с низким уровнем обмена веществ, мирные рыбы, обитающие в слабопроточных или стоячих водоемах, более резистентны к различным факторам внешней среды, в том числе и к ядам, чем виды с высоким уровнем обмена веществ, обитающие в сильно проточных водоемах. К первой группе относятся такие рыбы, как карп; ко второй – форель.
На основании опытов с фенолом В. И. Лукьяненко разделил рыб по устойчивости на следующие группы:
высокоустойчивые – карась, сом, плотва, лещ, осетр;
малоустойчивые – ёрш, налим, чехонь, судак, радужная и ручьевая форель.
По степени чувствительности к фенолу эти виды рыб идут в следующем порядке:
высокочувствительные – радужная форель, ручьевая форель, плотва, ёрш;
низкочувствительные – щука, окунь, лещ, налим, синец, карась.
Высокая чувствительность вида не всегда сопровождается низкой устойчивостью, и наоборот. Следовательно, нельзя упрощать взаимоотношение между устойчивостью и чувствительностью рыб к ядам. Сопоставление чувствительности и устойчивости рыб к яду (в частности к фенолу) позволило выявить четыре основные группы:
высокая чувствительность и низкая устойчивость (радужная и ручьевая форель, ёрш);
низкая чувствительность и высокая устойчивость (карась, лещ, синец);
высокая чувствительность и высокая устойчивость (плотва);
низкая чувствительность и низкая устойчивость (налим).
Полученные данные по устойчивости и чувствительности рыб на примере фенольной интоксикации, можно использовать к разным компонентам промышленных сточных вод, которые обладают сходным механизмом действия на организм или объединены химическим родством.
Установлено, что устойчивость рыб к аммиаку в большей мере определяется экологическими особенностями вида, чем его систематическим положением. По отношению к аммиаку изученные рыбы можно разделить на три группы:
высокоустойчивые (вьюн, карась, уклейка);
среднеустойчивые (гольян, линь, плотва, лещ, красноперка);
малоустойчивые (бычок, голец, щиповка, голавль, пескарь и окунь).
Уровень устойчивости к аммиаку тесно связан с экологией вида рыб. Следует отметить, что многие из представителей зоо- и фитопланктона более чувствительны к токсическим веществам, чем рыбы. Как правило, более устойчивы к токсическим веществам водные объекты, снабженные хитиновым панцирем, чем животные с незащищенной поверхностью тела (моллюски, черви, губки). Однако инсектициды особенно токсичны для насекомых и ракообразных, в то время как моллюски и черви более устойчивы к ним. Личинки насекомых более чувствительны к влиянию токсических веществ, чем взрослые особи. Отмечена большая устойчивость водных насекомых и их личинок, дышащих атмосферным воздухом. В опытах с хлором установлена большая повреждаемость токсическими веществами форм, свободно живущих в воде, чем донных и зарывающихся в ил.
Загрязнение водоемов создает неблагоприятные условия для развития объектов, служащих кормом для рыб, вследствие этого в водоеме снижается и количество рыб. Если в какой-либо части водоема в результате пагубного влияния токсических веществ погибают все без исключения водные организмы, то такой участок водоема называют зоной уничтожения. Если же гибнут только наиболее чувствительные организмы, в то время как устойчивые формы не повреждаются или повреждаются незначительно, то говорят об опустошенной или обедненной зоне.
Возрастной фактор также немаловажен в определении путей воздействия яда в естественном водоеме как на популяцию в целом, так и на отдельные стадии развития организма. По вопросу о чувствительности рыб в зависимости от возраста в литературе имеются разноречивые мнения. Одни авторы отмечают, что устойчивость рыб к токсикантам увеличивается с возрастом.
Опытами других ученых установлено, что развивающаяся икра и только что выклюнувшиеся личинки более устойчивыми к эндрину, чем взрослая рыба. В опытах на примере гексахлорана отмечена большая устойчивость икры и личинок, чем взрослых рыб.
Разноречивые данные по уровню токсикорезистентности рыб в зависимости от возраста следует объяснить природой токсического вещества. Установлено, что к неорганическим ядам (соли тяжелых металлов, аммиак и соли аммония и другие соединения) устойчивость рыб с возрастом увеличивается, а к ядам органической природы – падает. Степень устойчивости рыб на разных этапах онтогенеза зависит как от стадии развития, так и от природы яда.
Данные о влиянии массы рыб на устойчивость к яду противоречивы: одни исследователи считают, что размеры рыбы играют незначительную роль в устойчивости ее к ядам, другие устанавливают прямую зависимость между величиной рыбы и устойчивостью к ядам. Опытами В. И. Лукьяненко (1967) на сеголетках и трехлетках форели установлено, что фактор массы в устойчивости рыб к ядам становится реальным только при различиях в массе более чем в три раза, а у сеголетков только по достижении 19–22-кратных различий. Однако эти данные нельзя перенести на другие виды рыб и даже другие возрастные группы этого вида.
Большую роль при определении устойчивости рыб к ядам играют видовые и индивидуальные особенности рыб. Они являются частой причиной нарушения постоянства экспериментальных результатов и тем самым затрудняют установление связи между концентрацией яда и его действием. По-видимому, индивидуальная изменчивость устойчивости рыб к яду зависит от природы яда.
Время года также играет роль в устойчивости рыб к ядам. Рыбы очень чувствительны к токсическим веществам сразу после икрометания, в период же перед икрометанием их устойчивость к ядам максимальная. Зимой отмечена наибольшая устойчивость рыб к ядам, но в то же время низкие температуры могут маскировать токсичность препаратов.
Токсикорезистентность рыб в значительной мере зависит от физиологического состояния рыб. Голод, скученность, поражение паразитами значительно ослабляют организм рыб и снижают их устойчивость к токсическим веществам. В свою очередь, сточные воды, особенно содержащие детергенты, даже при незначительном содержании в них ядов понижают резистентность рыб, способствуют развитию на них паразитических грибов и других эктопаразитов.
7.3. Влияние экологических факторов среды на токсикорезистентность рыб
Токсическое воздействие сточных вод промышленных и других предприятий на гидробионтов зависит от ряда экологических факторов. Важнейшими из них являются температура воды, содержание растворенных в воде кислорода, углекислоты, минеральных веществ (жесткость воды), содержание органических веществ, концентрация водородных ионов (рН воды), скорость течения воды, свет и др.
По влиянию на токсикорезистентность рыб экологические факторы можно разделить на две группы (Wuhrmann и Woker, 1955):
факторы, оказывающие прямое влияние на физиологические функции организма (изменение проницаемости жабр, кожных покровов и других биологических мембран) и способствующие быстрому проникновению яда;
факторы, влияющие на яд, изменяя его концентрацию или физико-химические свойства.
Температура воды. Токсикорезистентность рыб к токсикантам тесно связаны с температурой воды. Экспериментально установлена зависимость уровня обмена веществ у рыб от температуры воды. Wuhrmann и Woker в своих экспериментах определили так называемый температурный коэффициент, равный от 1,9 до 3,4. Температурный коэффициент указывает, что при снижении температуры воды на 10° отдаляется время проявления симптомов отравления в 1,9–3,4 раза (табл. 4).
Величина температурного коэффициента больше, если речь идет о повышении температуры, то есть с увеличением температуры воды на 10° время проявления симптомов отравления ускоряется более чем на 1,9–3,4 раза.
Доказана роль температурного фактора в устойчивости рыб к сероводороду, к солям тяжелых металлов, к ядам органической природы. С повышением температуры воды сокращается время проявления симптомов отравления и ускоряется гибель рыб. Физиологически это явление объясняется тем, что при повышении температуры воды увеличивается проницаемость тканей для ядов, увеличивается скорость обмена веществ и потребление кислорода. Следовательно, концентрация токсиканта, действие которого не выявляется при низких и средних температурах, может оказаться летальным при повышении температуры в водоеме. Поэтому низкие температуры воды часто маскируют наличие токсических веществ в водоеме. Отравление рыб в водоеме может наступить с повышением температуры воды при условии сохранения токсических свойств токсикантом.
Исключением из этого правила являются некоторые хлорорганические пестициды, токсическое действие которых проявляется независимо от температуры. Установлено, что ДДТ более токсичен при низких температурах.
Следует коснуться и того факта, что вода при известных температурных диапазонах может быть причиной гибели рыб. Особенно неблагоприятен резкий перепад температур, встречающийся в естественных водоемах или обусловленный сбросом нагретых сточных вод или сбросных вод тепловых электростанции. Резкие изменения температуры воды в естественных водоемах часто приводят к массовой гибели промысловых.
Бурное строительство электростанций, в частности ТЭЦ, вызывает резкое нарушение тепловых режимов рек и водохранилищ, приводит к гибели рыб и представляет собой серьезную угрозу рыбному хозяйству. Сброс нагретых сточных вод в рыбохозяйственные водоемы опасен как зимой, так и летом, даже для рыб, адаптированных к летним температурам. Неблагоприятное действие нагретых сбросных вод на рыб значительно усиливается зимой.
Содержание растворенного в воде кислорода. Установлено, что дефицит кислорода в воде влияет на интенсивность обмена веществ, снижает устойчивость рыб ко многим ядам органической и неорганической природы. Так, при 30%-ном насыщении воды кислородом устойчивость рыб к токсическим веществам снижается в 7 раз по сравнению со 100%-ным насыщением.
Снижение устойчивости рыб при дефиците кислорода в большей степени зависит от видовых особенностей рыб, чем от природы яда. Физиологически это явление объясняется тем, что при дефиците кислорода в крови рыб возрастает уровень гемоглобина и увеличивается скорость циркуляции крови через жабры и яды более интенсивно поступают в организм рыбы. Снижение устойчивости рыб при дефиците кислорода обусловлено и тем, что кислород, являясь химически активным веществом, образует слаборастворимые окислы, которые оседают на дно, тем самым токсичность среды снижается. С некоторыми ядами кислород образует комплексные соединения.
Концентрация водородных ионов (величина рН). Изменение активной реакции среды в ту или иную сторону от нейтральной значительно влияет на устойчивость рыб к ядам, изменяя степень токсичности ядовитых веществ. При этом имеются в виду не крайние величины рН, токсически действующие сами по себе, а те, которые не оказывают какого-либо токсического эффекта. Это касается в первую очередь двух довольно обширных и распространенных групп токсических веществ: аммиака, солей аммония и цианистых соединений. Из других соединений, токсичность которых зависит от величины рН, следует указать на некоторые соединения хрома, железа (хлорное и сернокислое), марганца, меди, свинца, стронция, сульфидов.
Объясняется это явление тем, что активная реакция среды изменяет степень диссоциации ионизирующих веществ, в результате чего изменяется их токсичность. Проиллюстрируем это на примере с аммиаком и цианидами. В водном растворе соли аммония диссоциируют: (NH4) +OН ↔ NH3+H20. С увеличением концентрации водородных ионов (повышением рН) в воде равновесие сдвигается в сторону образования свободного аммиака. Аммиак усиливает свою токсичность в щелочной среде, поэтому устойчивость рыб в щелочных растворах аммиака значительно ниже, чем в нейтральной и кислой среде. По аналогии с солями аммония цианиды также диссоциируют в водном растворе, однако диссоциация их очень мала. В водном растворе цианидов образуется синильная кислота, количество которой зависит как от от величины рН: в сильно щелочном растворе цианистая кислота диссоциирует полностью. С увеличением величины рН цианистая кислота диссоциирует, поэтому ее токсичность резко снижается. В интервалах рН от 6 до 8,5 не наблюдается резкой разницы в токсичном действии цианидов, но по мере дальнейшего увеличения рН токсичность их резко падает
Кроме того, повышение или понижение концентрации водородных ионов оказывает влияние на устойчивость рыб к ядам в результате изменения интенсивности общего обмена веществ и газообмена в частности: понижение величины рН воды приводит к снижению интенсивности обмена, а увеличение рН – к повышению.
Связь между устойчивостью рыб к фенолу и величиной рН очень слабая, а токсичность пестицидов (из группы хлор- и фосфорорганических) не зависит от величины рН и жесткости воды.
Жесткость воды. Уже давно установлено, что токсическое действие многих солей щелочных, щелочноземельных и тяжелых металлов снижается в жесткой и морской воде. Физико-химически это явление объясняется тем, что высокоминерализованные воды, содержащие соли кальция, калия, натрия, магния и бария, снижают растворимость токсического вещества, образуя с ними нерастворимые осадки, и токсичность их в десятки раз уменьшается. Биологически снижение токсичности вышеупомянутых соединений следует объяснить тем, что ионы кальция влияют на клеточную проницаемость, уменьшая тем самым проникновение яда внутрь клетки .
Следует отметить, что в изменении токсичности тех или иных элементов имеют место явления антагонизма и синергизма ионов, то есть нейтрализация веществ или их синергизм в результате химического взаимодействия. На токсичность большинства органических соединений жесткость воды влияет незначительно или совсем не влияет. Токсичность анионоактивных и неактивных детергентов совершенно не зависит от жесткости воды.
Содержание углекислоты, скорость течения, свет. Из других экологических факторов, влияющих на токсикорезистентность рыб, следует указать на содержание в водоеме углекислоты, скорость течения воды, свет.
Наличие повышенных концентраций углекислоты в водоеме, с одной стороны, изменяет буферные свойства воды и химически взаимодействует с токсическими соединениями, с другой – влияет на физиологические функции организма, и прежде всего на газообмен. Скорость течения воды влияет на разбавление токсических веществ и на время контакта яда с гидробионтом. Свет в некоторых случаях отражается на токсичности сточных вод, повышая токсичность ферро- и феррицианидов. Эти сравнительно не токсичные комплексные соединения под действием света разлагаются с образованием свободных высокотоксических цианидов.
7.4. Комбинированное действие токсикантов
Большинство сточных вод промышленных и бытовых предприятий имеют сложный химический состав, следовательно, важно знать не только токсичность отдельных компонентов, но и их комбинированное действие. Комбинированное действие компонентов сточных вод проявляется в виде синергизма, антагонизма, сенсибилизации или аддитивного эффекта.
Синергизм – явление взаимодействия двух или нескольких компонентов, при котором токсический эффект выше, чем каждого компонента в отдельности, но меньше суммы эффектов этих компонентов. В виде символов данное взаимодействие выглядит следующим образом: Eff(A) и Eff(B) ‹ Eff (A+B) ‹ {Eff(A)+Aff(B)}.
Синергическими являются комбинации тяжелых металлов (меди и цинка, меди и кадмия, никеля и цинка), аммония и фенола, аммония и цианидов, аммония и хлора, муравьиной кислоты и сульфатов и др. Хлорирование некоторых среднетоксичных соединений приводит к резкому возрастанию токсичности соединения.
Сенсибилизация – такое явление, когда эффект суммы больше суммы эффектов
Eff (A+B) › Eff(A)+Eff(B). Иногда этот эффект отождествляют с синергизмом, называя мультипликацией.
Антагонизм – отрицательный синергизм, то есть действие компонентов, противоположное друг другу, в результате чего токсический эффект смеси снижается. Антагонизм может быть физиологический (противоположное действие на одну и ту же функцию организма) и химический (нейтрализация веществ в результате химического взаимодействия). В виде символов данное взаимодействие выглядит следующим образом: Eff (A+B) ‹ Eff(A) и Eff(B).
Антагонистами являются соли калия, кальция и соли натрия. Соли магния обезвреживаются солями кальция. Растворы хлористого натрия нейтрализуются солями хлористого кальция, хлористый натрий снижает токсичность хлористого кальция и калия. Синильная кислота снижает свою токсичность при одновременном действии окиси и закиси железа; наоборот, присутствие солей меди стабилизирует синильную кислоту. Известковое молоко нейтрализует или снижает токсичность сточных вод, содержащих соли тяжелых металлов (меди, цинка, олова, железа и др.), фторидов и другие соединения. Поэтому токсичность солей тяжелых металлов и фторидов в мягкой и дистиллированной воде более высокая, чем в жесткой и морской. Это свойство извести и других щелочных элементов используется на некоторых очистных сооружениях для обезвреживания сточных вод. Известно также, что наблюдается снижение токсичности, вплоть до полной нейтрализации, сточных вод целлюлозных предприятий от примеси коммунально-бытовых вод.
Аддитивный эффект. Большинство токсических веществ оказывают на рыб суммированное действие. Например, токсичность смеси соляной и серной кислот, смеси цианистого калия и паракрезола равна токсичности отдельных компонентов, то есть токсическое действие их проявляется в виде независимого совместного действия. Установлено, что степень комбинированного действия зависит от вида токсиканта, его доли в смеси, длительности воздействия, показателей состава воды (например, жесткости). В виде символов данное взаимодействие выглядит следующим образом:
Eff (A+B)=Eff(A)+Eff(B).
8. МЕХАНИЗМ ДЕЙСТВИЯ ТОКСИКАНТОВ НА ГИДРОБИОНТОВ
В противоположность человеку и высшим животным в организм рыб большинство отравляющих веществ проникает осмотически – через жабры и кожу, особенно поврежденную. Оральный путь поступления имеет большое значение при хронических отравлениях. Поэтому токсичность в большой степени зависит от растворимости вещества в воде и биологических средах. Соединения, растворимые в воде, более ядовиты, чем нерастворимые. Вместе с тем через жабры, кожу и слизистую кишечника легко проникают и вещества, хорошо растворимые в липидах и тканевой жидкости. Они поступают в кровь и разносятся по всему организму. К ним относится большинство органических загрязнителей – углеводороды, пестициды, детергенты и др.
Процесс интоксикации начинается с патогенного действия ядов в местах проникновения (жабрах, коже, слизистых оболочках), а также рефлекторной реакции со стороны нервной системы. В дальнейшем, после попадания в кровь отравляющие вещества, соединяясь с белками, нарушают физико-химические процессы в плазме и клеточных элементах. Затем они фиксируются в различных органах и тканях в соответствии с их сорбционной емкостью и биохимическим средством к отдельным ядам. Механизм действия большинства ядов тесно связан с включением их в различные звенья биохимических процессов, и прежде всего со способностью вступать в реакции с ферментами. Например, фосфорорганические пестициды блокируют фермент холинэстеразу, цианиды подавляют активность цитохромоксидазы, вызывая угнетение тканевого дыхания и т. д. Многие яды способны брать на себя функцию аналога субстрата, взаимодействующего с ферментами.
Изменения при токсикозах биохимического состава и обмена веществ у рыб задолго до их гибели позволяют использовать биохимические показатели для диагностических целей и установления ПДК.
8.1. Влияние токсикантов на обмен веществ и биохимический состав рыб
Белковый обмен.
Многогранная физиологическая роль тканевых и сывороточных белков, а также способность чутко отражать изменения интенсивности и направленности обменных процессов, в частности пластического обмена, позволяют использовать их в качестве важнейшего биохимического показателя функционального состояния организма, как в норме, так и при воздействии токсических веществ.
В серии опытов, выполненной на леще (Abramis brama) и налиме (Lota lota), подвергнутых воздействию фенола в течение 4-х суток, было установлено снижение содержания общего сывороточного белка. Однако в целом обнаруженная у подопытных рыб гипопротеинемия была незначительна. Она указывает скорее на направленность изменений белкового обмена.
Значительно более выраженные, а главное, скоротечные изменения концентрации общего сывороточного белка были отмечены у молоди осетровых, отравленной различными пестицидами. Согласно полученным данным, пестициды оказывают существенное влияние на уровень гипопротеинемии как в острых, так и в подострых опытах.
Возможно, снижение сывороточного белка в опытах с пестицидами связано с перераспределением белка между тканями и кровью или снижением процессов биосинтеза белка печенью. Нельзя исключить в качестве причины столь резкой гипопротеинемии и нарушение водно-солевого обмена, вследствие которого могло произойти «разжижение» крови.
Безусловно, концентрация общего сывороточного белка является важным интегральным, показателем белкового обмена, его направленности и интенсивности. Однако для более глубокого понимания характера воздействия токсикантов на белковый обмен у рыб большое значение имеет исследование относительного содержания белковых фракций (альбуминов и глобулинов) по сравнению с их количеством у контрольных (здоровых). Опыты на севрюгах, отравленных пестицидами, содержание альбуминов (25,6%) оказалось заметно ниже, чем у здоровых рыб (34,3%), а содержание глобулинов, напротив, выше (74,3%), чем у контрольных рыб (65,7%). В соответствии с этим альбумин-глобулиновый коэффициент у подопытных рыб (0,35) на 34% ниже, чем у контрольных (0,53). Еще более существенные различия между подопытными и контрольными севрюгами обнаружились при сопоставлении у них относительного содержания отдельных фракций глобулинов. Так, относительное содержание α-глобулинов у отравленных рыб (13,8%) в 2 с лишним раза выше, чем у здоровых (6,4%), а содержание β-глобулинов в три с лишним раза выше (27,3% и 8,0% соответственно), в то же время содержание высокомолекулярных (наименее подвижных) белков β2-глобулинов + γ-глобулинов у отравленных севрюг (33,1%) значительно ниже, чем у здоровых (51,1%).
Имеются указания нa изменения содержания сывороточных и тканевых белков у рыб и под влиянием других токсических веществ, в частности хлорорганических пестицидов, четыреххлористого углерода, хлорофоса и др.
Хотя мышечные белки по фракционному составу и количественному содержанию более стабильны, чем сывороточные белки, но и они претерпевают изменения под влиянием различных токсических веществ. Некоторые тяжелые металлы, например, такие как медь, хром, олово, кадмий, снижают содержание растворимых мышечных белков у рыб. Снижается оно и под влиянием нефтяного загрязнения. Вообще токсическое действие тяжелых металлов и нефтепродуктов проявляется в изменении содержания не только мышечных, но и сывороточных белков рыб. Воздействие на рыб ртути и свинца, например, вызывает снижение концентрации общего сывороточного белка и альбуминов, но приводит к увеличению концентрации глобулинов.
Таким образом, изменение скорости и интенсивности биосинтеза белка – один из реальных механизмов воздействия токсических веществ на обмен веществ рыб, а изменение концентрации общего сывороточного или тканевого белка – хороший биохимический показатель как острого, так и хронического отравления рыб.
Другим важнейшим биохимическим показателем токсического действий различных групп веществ на белковый обмен может служить уровень содержаняи аммиака в крови и тканях, прежде всего в мозговой ткани.
Как известно, рыбы (наряду с ракообразными) относятся к группе аммониотелических животных, у которых конечным продуктом катаболизма белков и аминокислот является аммиак: Аммиак и его водный раствор аммоний высокотоксичны. В нормальных условиях образующийся в различных тканях аммиак детоксицируется с помощью глютаминовой кислоты. Взаимодействие аммиака и глютаминовой кислоты ведет к образованию глютамина, который поступает в печень, где от него отщепляется аммиак. Нарушение этих тонко сбалансированных процессов образования и детоксикация аммиака в центральной нервной системе приводит к развитию двигательного возбуждения и судорожного состояния.
Динамика изменения количества аммиака в мозге у карасей по ходу развития фенольной интоксикации показала серьезные сдвиги в белковом обмене организма, обусловленные воздействием фенола на центральную нервную систему рыб. Опытным путем доказано, что в головном мозге рыб происходит резкое повышение концентрации аммиака во время двигательного возбуждения и судорог, характерных для фенольной интоксикации. Иными словами, биохимические изменения в головном мозге рыб во время сильнейшего двигательного возбуждения аналогичны имеющим место у теплокровных животных. Сходство биохимических изменений в головном мозге рыб и теплокровных, проявляющееся в увеличении содержания высокотоксичного аммиака, является следствием нарушения детоксикации аммиака у рыб в системе дикарбоновые кислоты – аммиак – глютамин.
Аналогичные изменения характерны для токсикозов, вызванных действием тяжелых металлов (свинец, кадмий). Важно отметить, что зарегистрированные изменения в системе глютаминовая кислота – аммиак – глютамин имеют место при действии на рыб тяжелых металлов в концентрациях, близких к ПДК, что позволяет содержание свободного аммиака в мозговой и других тканях рыб использовать в качестве биохимического показателя реакции организма рыб на токсические воздействия различных групп химических веществ, в том числе фенола, нефти, ртути, свинца, кадмия.
Аминокислоты. Аминокислоты – основные структурные элементы белков, динамика их содержания в различных органах и тканях также может служить показателем нарушения белкового обмена при токсикозах.
Анализ данных по изменению количества свободных и связанных аминокислот в различных органах и тканях рыб под влиянием токсикантов, позволяет сделать следующие выводы: в процессе интоксикации рыб суммарное содержание свободных аминокислот увеличивается в крови, печени, головном мозге, кишечнике и мышцах, причем, в мышцах эти изменения менее выражены и подчас более разнонаправлены, чем в других органах. Колебания аминокислотного состава органов и тканей отравленных рыб могут вызываться разными причинами, в том числе угнетением синтеза белка, нарушением трансаминирования, дезаминирования и декарбоксилирования, и, наконец, усилением распада белков, ведущего к увеличению суммарного содержания свободных аминокислот.
Интересны данные по исследованию концентрации специфических аминокислот коллагена в мозговой жидкости у рыб, подвергшихся токсическому воздействию некоторых пестицидов. Коллаген относится к группе протеиноидов (белковоподобных веществ) и является основным органическим компонентом, структурной основой опорных тканей, таких, как соединительная, хрящевая и костная. Чрезвычайно своеобразен аминокислотный состав коллагена. В молекулу коллагена наряду с аминокислотами входят аминокислоты, содержащие аминогруппу NH, а не аминогруппу NH2, как все аминокислоты – это гидроксипролин и гидроксилизин, которые в белках не обнаружены. Обе аминокислоты и свободном виде не встречаются и образуются внутри уже построенного коллагена. Исследованиями установлено, что содержание гидроксипролина и коллагена позвоночника, являясь чувствительным индикатором роста, снижается у рыб, подвергнутых длительному токсическому влиянию сублетальлых концентраций токсафена и ароклора. Это происходит значительно раньше, чем удается обнаружить снижение темпа роста. Так, отравление токсафеном приводит к замедлению темпа роста ручьевой форели, через 3–4 дня после снижения содержания гидроксипролина. В опытах на толстоголовом гольяне (Pimephales promelas) показано, что количество гидроксипролина в коллагене позвоночника достоверно снижается при концентрациях токсафена в 2–3 раза меньших, чем концентрации, вызывающие замедление роста Снижение концентрации гидроксипролина ведет к замедлению синтеза коллагена и повышению минерализации позвоночника, что внешне проявляется в симптоме «сломанная спина».
Из представленных в этом разделе данных можно сделать вывод, что многие токсические вещества вызывают существенное нарушение нормального хода белкового метаболизма у рыб. В связи с этим ряд показателей белкового обмена (концентрация общих сывороточных и тканевых белков, содержание свободного аммиака в тканях, фонд свободных аминокислот и концентрация коллагена) могут быть использованы для прогнозирования исхода токсического процесса и оценки степени токсичности веществ с выраженным гепатотропным действием.
Углеводный обмен
Одним из двух основных источников энергии, необходимой организму для обеспечения разнообразных процессов жизнедеятельности, являются углеводы. Глюкоза и гликоген – легко мобилизуемые энергетические субстраты, используемые организмом для обеспечения энергией многих физиологических процессов, в том числе и реакций на токсическое воздействие. В связи с этим показатели углеводного обмена, его интенсивность и направленность представляют первостепенный интерес при оценке реакции рыб на токсические вещества. Об этом свидетельствуют многочисленные экспериментальные данные, полученные в опытах на разных видах рыб, подвергнутых токсическому воздействию ядов органического и неорганического ряда.
Содержание налимов в растворе фенола концентрацией 5 мл уже в течение первых 24 ч приводило к небольшому, но хорошо заметному подъему уровня сахара в крови, среднее значение которого у подопытных рыб достигало 100 мг% против 73 мг% у контрольных. Через 48 ч после погружения рыб в токсический раствор отмечалась тенденция к некоторому снижению содержания сахара в крови подопытных рыб (92 мг%) и его нормализация в последующие 2 сут. Во всяком случае через 96 ч после начала опытов уровень сахара в крови подопытных и контрольных налимов оказался одинаковым (по 73 мг%). Однако на 5-е сутки контакта рыб с ядом содержание сахара в крови вновь поднялось у подопытных налимов до 94 мг%. Таким образом, у рыб имеет место 2-фазовое изменение уровня сахара: первоначальное повышение (гипергликемия), затем возвращение к норме и относительная стабилизации и понижение в случае продолжающегося контакта рыб с ядом.
У молоди русского осетра, отравленной пестицидами (метафосом, пропанидом и яланом) было отмечено резкое, почти четырехкратное снижение количества гликогена в печени (гипогликемия).
Разнонаправленные изменения содержания гликогена в печени и сахара в крови отражают одно из проявлений реакции рыб на токсическое воздействие. Она сопровождается повышенным расходом углеводов, обусловленным интенсификацией окислительных процессов в тканях. Такая реакция возникает на любое чрезвычайное по силе изменение факторов внешней среды, и мобилизация гликогена для удовлетворения возросших потребностей тканей в глюкозе – это вполне нормальный адаптивный процесс. Другое дело, если действие стрессорного раздражителя, в частности токсиканта, продолжается длительное время, при этом запасы гликогена истощаются и развивается гипогликемия, сопровождаемая судорогами и другими симптомами недостаточного снабжения мозга caxaром.
Еще одним проявлением нарушения углеводного обмена у рыб следует считать переключение характерного для рыб и других позвоночных животных высокоэффективного с энергетической точки зрения аэробного распада углеводов на филогенетически более древний анаэробный гликолиз, сопровождаемый образованием молочной кислоты.
Безусловным нарушением углеводного обмена может служить диссоциация между повышенной потребностью тканей в глюкозе и направленностью углеводного обмена в печени, скажем, преобладание гликогензапасающего характера обмена над гликогенрасходующий.
У рыб основные пути углеводного обмена и ферменты, контролирующие этот обмен, аналогичны известным у высших позвоночных животных. Глюкоза, поступая в клетки печени или мышц рыб, под действием гексокиназы подвергается фосфорилированию и превращается в глюкозо-6-фосфат с использованием при этом энергии фосфатной связи аденозинтрифосфата (АТФ). Образовавшийся глюкозо-6-фосфат под влиянием фосфоглюкомутазы перестраивается в глюкозо-1-фосфат. Заключительный этап синтеза гликогена у рыб осуществляется с помощью гликогенсинтетазы, под действием которой глюкозо-1-фосфат переходит в гликоген.
При токсикозах имеет место высокая активность ферментов фосфоролиза в печени, а также в мышцах разных видов рыб, причем в красных мышцах она выше, чем в белых. Высокая активность гликогенсинтетазы и низкая активность фосфорилазы определяют гликогензапасающий характер углеводного обмена. Смена гликогензапасающей направленности обмена на гликогенрасходующую возможна только при резком увеличении активности фосфорилазы и снижения активности гликогенсинтетазы.
Сигналом для переключения направленности углеводного обмена у рыб служат изменение различных факторов внешней среды (температуры, солености) и поведения, а также сезонная динамика физиолого-биохимических процессов и ряд других.
Восприятие этих сигналов осуществляется, по-видимому, как экстерорецепторами, так и интерорецепторами. Импульсы, возникающие в рецепторах, поступают а центральную нервную систему, а далее включаются нейрогормональные механизмы, контролирующие активность ключевых гликогенсинтезирующих и гликолитических ферментов. Гормональная регуляция углеводного обмена у высших позвоночных осуществляется с помощью гормонов поджелудочной железы (инсулина и глюкагона), коры надпочечников (картизола и дезоксикортикостерона), мозгового вещества надпочечников (адреналина), гипофиза (гормона роста и адренокортикотропного гормона). Одни из этих гормонов, такие, как адреналин, глюкагон и глюкокортикоиды, активируя гликолитические ферменты, интенсифицируют расщепление гликогена, повышают содержание сахара в крови, удовлетворяя тем самым повышенные энергетические потребности клеток тканей и органов. Другие гормоны, например инсулин, активируют активность гликогенсинтезирующих ферментов, усиливая тем самым гликогензапасающую функцию печени.
Полученные в последнее десятилетие экспериментальные данные однозначно свидетельствуют о разностороннем влиянии токсикантов на различные звенья углеводного обмена морских и проходных рыб при острых и хронических токсикозах. Так, краткосрочное выдерживание молоди кижуча в сточных водах целлюлозно-бумажного производства приводит к развитию гипергликемии уже через 3 ч контакта рыб с токсикантами. С некоторым опозданием у подопытных рыб начинается снижение содержания гликогена в печени. Если через 12 ч количество гликогена в печени подопытных рыб не претерпевает существенных изменений, то через 72 ч нахождения рыб в токсическом растворе его содержание снижается почти в 6 раз и составляет лишь 14% его количества у контрольных особей. Согласованные изменения основных показателей углеводного обмена – снижение уровня гликогена в печени и повышение концентрации сахара крови связывают с вероятным выбросом в кровяное русло отравленных рыб катехоламинов, которые, как известно, активируют гликолитические ферменты и приводят к снижению запасов гликогена в печени рыб.
Иные по направленности изменения углеводного обмена обнаружены в хронических опытах с молодью кижуча, подвергнутой токсическому воздействию сточных вод целлюлозно-бумажного производства. Длительное (до 200 сут.) выдерживание рыб в токсическом растворе приводило, как и в острых опытах, к повышению уровня сахара в крови, но содержание гликогена в печени при этом не снижалось, а повышалось. Аналогичные изменения содержания гликогена в печени отмечены в хронических опытах (160-дневные) на радужной форели. Длительный контакт с различными концентрациями пестицида приводил к повышению уровни гликогена в печени подопытных рыб. Более того, длительное плавание, не снижало запасов гликогена в печени, в то время как у контрольной форели эта же физическая нагрузка приводила к мобилизации гликогена в печени. Таким образом, здесь действительно имеет место нарушение нормального хода углеводного обмена.
Каковы же причины повышения гликогензапасающей функции печени в условиях хронического отравления рыб пестицидам и тяжелыми металлами? Чтобы ответить на этот вопрос, необходимо обратиться к материалам, характеризующим гормональный статус организма рыб в экстремальных условиях хронического отравления тем или иным токсикантом. Как известно, синтез гликогена может происходить либо непосредственно из глюкозы, либо из неуглеводных предшественников, сопровождаясь затратами АТФ и НАД-Н. Взаимосвязь углеводного обмена с белковым и липидным контролируется различными гормонами, в частности адренокортикальными, стимулирующими катаболизм белков и анаболизм углеводов. Наличие у рыб этих гормонов и их участие в регуляции катаболизма белков, а также имеющиеся экспериментальные данные по влиянию адренокортикотропного гормона и кортизола на уровень содержания сахара крови и гликогена печени рыб позволяют сделать вывод о том, что именно этим гормонам принадлежит ведущая роль в изменении направленности углеводного обмена в условиях хронического отравления рыб.
Совокупность представленных данных свидетельствует об однотипности реакции рыб и теплокровных позвоночных на стрессорные раздражители химической природы. Разнообразные по химическому строению токсиканты вызывают активацию гипофиза и выброс в кровяное русло адренокортикотропного гормона, которое в свою очередь усиливает секрецию кортикостероидов интерреналовой железой. Совместное действие этих гормонов приводит к снижению интенсивности использования глюкозы тканями и повышению темпов превращения продуктов расщепления белков в глюкозу, т. е. усиливает гликонеогенез. В результате при хроническом отравлении рыб происходит увеличение запасов гликогена в печени и содержания сахара в крови. При остром отравлении, напротив, происходит снижение концентрации кортизола в крови, повышение концентрации катехоламинов, в частности адреналина, что ведет к снижению запасов гликогена в печени и кратковременному повышению содержания сахара в крови.
Ценность гликогенового теста на токсичность нефтепродуктов состоит в том, что он отражает реакцию целостного организма, причем как в условиях острого и подострого токсикозов, так и, что особенно важно, в условиях хронического отравления, т. е. при действии малых концентраций токсикантов.
Опыты на изолированной печени, позволили понять механизмы снижении резервов гликогена в ней при воздействии на рыб токсикантов. В срезах печени рыб, подвергнутых подострому и хроническому отравлению, заметно снижается продукция глюкозы, одновременно с этим падает содержание гликогена. Эти изменения объясняются повышенным расходом глюкозы, которая может использоваться в качестве источника энергии для обеспечения процесса детоксикации. Развитие у рыб гипергликемии при сниженной продукции глюкозы печенью, можно объяснить пониженной утилизацией глюкозы периферическими тканями отравленных рыб.
Таким образом, показатели углеводного обмена: содержания сахара в крови и гликогена печени, можно использовать в качестве чувствительных критериев токсичности различных групп веществ для рыб.
Липидный обмен
Липидный обмен находится в тесной связи с углеводным, поскольку при энергетическом обеспечении многих процессов жизнедеятельности организма углеводы испoльзyютcя в качестве "запального" топлива, а липиды играют роль «стратегического» "топлива. Образно говоря, липиды, а точнее, жирные кислоты «сгорают в пламени углеводов». Однако не только в этом проявляется связь между окислением углеводов и обменом липидов. В случае недостатка углеводов в организме для покрытия потребности в энергии усиленно сжигаются жиры. При избытке углеводов из них легко образуются липиды. Синтез жиров происходит за счет энергии, выделяемой при окислении углеводов нормальной интенсивности, т. е. окисление углеводов прекращает усиленное расщепление жирных кислот и способствует их ресинтезу. Таким образом, липиды играют важнейшую роль в энергетическом обмене, но этим не исчерпывается их значение для организма. Липиды в соединении с белками (липопротеиды) являются основным структурным элементом биологических мембран, причем липидами богаты такие структурные элементы клеток, как митохондрии, лизосомы, в которых протекают энзиматические реакции, синтетические процессы и окислительное фосфорилирование.
Основная масса липидов рыб представлена фосфолипидами и триглицеридами, из которых первые несут структурную функцию, а вторые служат основным энергетическим субстратом. Большинство липидов, в том числе триглицериды и фосфолипиды, содержит насыщенные и ненасыщенные жирные кислоты. Рыбы имеют более сложный набор жирных кислот, среди которых резко преобладают ненасыщенные. Жирные кислоты представляют собой наиболее лабильный энергетический резерв организма, а их концентрация в крови может служить тонким индикатором степени мобилизации жировых запасов и интенсивности окислительных процессов в печени и мышцах.
Одним из важных компонентов фракционного состава липидов является холестерин. Последний наряду с фосфолипидами участвует в построении клеточных мембран и служит предшественником стероидных гормонов, играющих активную роль в регуляции адаптивных реакций организма в ответ на стрессорные раздражители.
Опыты, выполненные на модели пестицидного отравления карпа, в которых определяли направленность и интенсивность изменения содержания в органах и тканях подопытных рыб фосфолипидов, свободного холестерина, триглицеридов и эфиров холестерина, показали, что у отравленных рыб наблюдалось нарушение стационарного состояния обмена липидов.
Изменения фракционного состава липидов обнаружены в печени и плазме крови карпов. Количество фосфолипидов и неэстерифицированных жирных кислот в печени резко снижается, а триглицеридов существенно возрастает, В плазме крови, напротив, содержание фосфолипидов увеличивается почти втрое. Видимо, у отравленных рыб имеет место перераспределение фосфолипидов между печенью и мышцами, вследствие чего их содержание в печени снижается, а в крови, скелетной и сердечной мускулатуре возрастает. Снижение количества жирных кислот в печени без достоверного увеличения их содержания в крови и мускулатуре обусловлено, вероятно, повышенными энергетическими потребностями этого органа, удовлетворение которых может осуществляться за счет окисления жирных кислот. В плазме подопытных карпов отмечено достоверное снижение концентрации свободного холестерина, обусловленное либо участием последнего в связывании токсиканта, либо его усиленным использованием для синтеза стероидных гормонов, обеспечивающих адаптацию организма к неблагоприятным условиям.
Согласно современным представлениям одним из источников поступления холестерина в плазму являются, эритроциты. Не удивительно, что в эритроцитах отравленных карпов происходит заметное повышение уровня фосфолипидов и снижение количества эфиров холестерина. Остальные компоненты фракционного состава липидов эритроцитов подопытных рыб не претерпевают существенных изменений по отношению к контролю. Относительно стабильным оставался и фракционный состав липидов мозга. Было отмечено лишь незначительное снижение уровня фосфолипидов. Остается неясным, чем определяется снижение уровня фосфолипидов в мозге: угнетением их синтеза или усилением расщепления.
Из данных, характеризующих направленность и интенсивность изменений фракционного состава липидов в различных органах и тканях рыб, подвергнутых острому гербицидному отравлению, очевидно, что наиболее значительные сдвиги липидного обмена происходят в печени. Это естественно, поскольку печень играет большую роль в обороте липидов внутри организма и является главным местом их окисления. Аналогичная картина наблюдается и при действии других токсикантов как органической (фенол), так и неорганической (азотнокислый никель) природы.
Установлено, что влияния некоторых токсикантов на липидный обмен связан с нарушением целостности субклеточных структур, таких, как митохондрии и лизосомы печени рыб. Важнейшим элементом этих структур являются биологические мембраны, построенные из липопротеинов, нарушение целостности которых ведет к нарушению внутриклеточного обмена, в частности энергетического, протекающего в митохондриях. Под влиянием гербицидов происходят количественные изменения фосфолипидного состава митохондрий печени карпа на протяжении всего периода (1 ч) их инкубирования в буферном растворе в присутствии токсикантов. Выраженность изменений отдельных фракций фосфолипидов и их длительность неодинаковы, но они свидетельствуют о нарушении равновесия фосфолипидных фракций в митохондриях под влиянием токсикантов. Предполагается, что гербициды частично расщепляет липопротеиновые комплексы мембран митохондрий, что нарушает их структуру и увеличивает проницаемость.
Под влиянием фенола изменяется липидный спектр лизосом печени некоторых видов рыб (лещ, плотва, окунь, сиг). При этом снижается содержание общих липидов, триглицеридов, общей фракции фосфолипидов. По-видимому, токсиканты в данном случае нарушают целостность мембраны лизосом, высвобождая при этом кислые гидролазы, которые и приводят к отмеченному изменению липидного состава лизосом.
Все выше сказанное позволяет использовать показатели липидного обмена для оценки физиологического состояния рыб, обитающих в водоемах, подвергавшихся загрязнению.
Влияние токсикантов на активность ферментов.
Нормальное течение обменных процессов, лежащих в основе жизнедеятельности целостного организма или отдельной клетки, контролируется огромным количеством ферментов, объединенных в сложные взаимосвязанные системы. В любой клетке животного организма одновременно действуют многие сотни ферментов, организованные, в самостоятельные органеллы или надмолекулярные комплексы, встроенные в биомембраны. В настоящее время число идентифицированных ферментов превышает 800 и их описок непрерывно пополняется.
Как известно, в основе токсического действия различных по природе групп веществ лежит нарушение функций того или иного фермента, той или иной ферментной системы, контролирующей белковый, липидный, углеводный, минеральный или энергетический обмен.
Холинэстераза. В соответствии с современной номенклатурой ферментов различают два типа холинэетераз: ацетилхолинэстеразу и холинэстеразу. Первый из этих ферментов локализован в мозговой ткани, синаптических ганглиях, эритроцитах, а второй в сыворотке крови, печении в некоторых других органах и тканях.
Исследования активности холинэстеразы при фенольном отравлении показали, что ее уровень у подопытных рыб претерпевает весьма существенные изменения по ходу развития интоксикации. Через 7 мин после погружения подопытных карасей в раствор фенола (100 мг/л), во время которого у них отмечается сильнейшее двигательное возбуждение, активность мышечной холинэстеразы у подопытных рыб почти в два раза ниже, чем у контрольных.
Анализ изменения активности холинэстеразы во времени показывает, что максимальное ее падение приходится на 60-ю минуту токсического воздействия фенола на рыб. Именно к этому сроку караси полностью теряют подвижность, и только впоследствии у них появляются редкие импульсивные перемещения (чаще по кругу) в боковом положении. К 120-й минуте у подопытных карасей имеет место некоторое повышение активности холинэстеразы (на 32%) в сравнении с ее активностью, зарегистрированной на 60-й минуте, но на все еще значительно ниже, чем у контрольных карасей.
Полученные в этой серии опытов данные, свидетельствующие о резком торможении активности холинэстеразы – важнейшего звена ацетилхолинового метаболизма, позволяют понять биохимическую основу 2-фазового действия фенола на рыб. По-видимому, первоначальное возбуждающее действие фенола на рыб, проявляющееся в сильнейшей, но кратковременной двигательной реакции, обусловлено торможением холинэстеразы фенолом (прямым или каким-либо косвенным путем), которое приводит к стабилизации «физиологического» ацетилхолина. Последующее накопление ацетилхолина до максимальных концентраций лежит в основе парализующего действия фенола, имеющего место во второй стадии фенольной интоксикации. Таким образом, два наиболее типичных эффекта фенольной интоксикации – возбуждающее и парализующее действие – можно толковать как результат инактивации холинэстеразы, и, следовательно, накоплении ацетилхолина в холинэргический синапсах.
Экспериментальные данные по характеру и выраженности влияния фосфорорганических пестицидов на активность АХЭ мозга рыб показали, что все пестициды вызывают различный по выраженности и длительности антихолинэстеразный эффект у исследованных видов рыб. Только у некоторых рыб (ушастый окунь, сомик-кошка) не удалось обнаружить отрицательного влияния фосфорорганического пестицида на активность АХЭ мозга.
Сходство реакции рыб и теплокровных животных на фосфорорганические пестициды проявляется не только в самом факте ингибиронания АХЭ мозга, но и в скорости развития этого эффекта. Снижение активности АХЭ мозга рыб происходит в первые часы контакта рыб с ядохимикатами задолго до летального исхода. Выраженность антихолинэстеразного эффекта, вызываемого фосфорорганическими пестицидами, у рыб находится в прямой зависимости от концентрации ядохимиката и времени его действия. Летальные концентрации фосфорорганических пестицидов вызывают более глубокое угнетение АХЭ мозга рыб, чем сублетальные.
Изучение холинэстеразы крови рыб, показало, что субтоксические концентрации пестицидов снижали активность АХЭ крови на 49–55%. а токсическая – на 72–75%, печени снижение активности АХЭ может доходить до 100%.
Это позволяет диагностировать отравление рыб фосфорорганическими пестицидами по степени угнетения АХЭ крови прижизненно, а печени и мышц – посмертно.
Угнетение активности АХЭ мозга и крови рыб может быть вызвано не только фосфорорганическими пестицидами, но и многими другими токсикантами, обладающими нервно-паралитическим действием (фенолы, аммоний, карбаматные и хлорорганические пестициды, сине-зеленые водоросли и их токсины). Следовательно, использовать этот биохимический показатель для оценки степени загрязнения водных экосистем фосфорорганическими пестицидами, т. е. для индикации, можно с осторожностью наряду с определением остаточных количеств этих пестицидов в рыбах, исключив при этом наличие других токсикантов в воде и гидробионтах.
Аденозинтрифосфатазы. Аденозитрифосфатаза (АТФ-аза) осуществляет ферментативный гидролиз важнейшего макроэргического соединения – аденозинтрифосфаты (АТФ), играющей главную роль в энергетическом режиме клетки.
Согласно современным представлениям АТФ-азы имеют важное значение для ионной и осмотической регуляции, играя воль своеобразного натриевого насоса у пресноводных рыб. Напомним, что основным элементом осморегуляции пресноводных рыб является активный транспорт натрия и хлора через жабры из воды во внутреннюю среду. Ведущую роль в этом процессе играет проницаемость жаберного эпителия для воды и солей, которая собственно и регулируется локализованными в жабрах Na+, K+ и Мg;++ активируемыми АТФ-азами. Уровень активности этих ферментов в жабрах, а также в почках у рыб определяет интенсивность и направленность транспорта ионов и воды.
Экспериментальные данные свидетельствуют, что многие хлорорганические пестициды вызывают четко выраженное торможение активности Na+, К+, и Mg++ активизируемых АТФ-аз мозга, жабр, почек у морских, пресноводных и проходных рыб. Это дает основание считать, что уровень антивности АТФ-аз может служить важным биохимическим показателем токсического действия хлорорганических соединений. Не исключено, что и другие токсические вещества оказывают ингибирующее действие на АТФ-азы рыб, но это не может служить препятствием для их практического использования в ихтиотоксикологических исследованиях.
Тиаминаза (тиамингидролаза). Это фермент, играющий важную роль в обеспечений нормального хода обменных процессов с участием витамина В1 (тиамина). Тиаминаза расщепляет тиамин на тиазол и пиримидин, лишенных биологической активности, т. е. является естественным регулятором действия тиамина. Увеличение активности тиаминазы в различных тканях приводит к снижению количества тиамина и нарушению нормального хода биохимических процессов, характерных для В1-авитаминоза.
Многократно воспроизведенными опытами на разных видах рыб (окунь, судак, язь, плотва, лещ, толстолобик, красноперка) показано, что под действием метаболитов, продуктов распада сине-зеленых водорослей возрастает активность тиаминазы, снижается содержание тиамина, что провидит к развитию специфического B1-авитаминоза с характерным для него симптомом паралича и последующей скоротечной гибелью. Выраженность изменений системы тиаминаза – тиамин, а также время появления признаков паралича и гибели рыб определяются количеством внесенных в аквариумы сине-зеленых водорослей и видовыми особенностями – токсикорезистентностью рыб.
8.2. Механизм действия токсикантов на центральную и вегетативную нервную систему рыб
Многие токсические вещества, поступающие в рыбохозяйственные водоемы (фенолы, смолы, дегти, алкалоиды, сапонины и терпены, продукты выщелачивания древесины, хлорорганические и фосфорорганические пестициды, производные карбамиловой кислоты, некоторые гербициды и альгициды, а также ряд неорганических веществ), обладают так называемым нервно-паралитическим действием, т. е. оказывают прямое или косвенное влияние на нервную систему теплокровных животных и человека.
Какова же роль центральной нервной системы в развитии внешнего симптомокомплекса отравления рыб нервными ядами? Ответить на этот вопрос помогла серия экспериментов по выявлению роли центральной нервной системы в развитии внешнего симптомокомплекса отравления рыб ядами органического ряда на модели фенольной интоксикации карасей.
В первой серии опытов было предпринято изучение возможности торможения (блокирования) реакции рыб на фенольное раздражение посредством использования препаратов, угнетающих центральную нервную систему (наркоз): уретана (центрально действующий) и новокаина — препарата из группы анестетиков, который, проникая в общий круг кровообращения, вызывает типичный наркотический эффект. Использовали 0,5, 1 и 2%-ный растворы уретана и 0,25, 0,5 и 1%-ный растворы новокаина. Наркотизированных карасей помещали в растворы фенола концентрацией 50, 100, 400 и 800 мг/л.
Установлено, что у карасей, наркотизированных уретаном и подвергнутых токсическому воздействию фенола концентрацией 100 мг/л, резко увеличивается латентный период первичной реакции на фенольное раздражение, т. е. наркоз предупреждает и временно снимает все внешние проявления фенольной интоксикации рыб. Выраженность купирующего действия уретана находится и прямой зависимости от глубины наркоза, который и свою очередь при неизменной концентрации наркотика, определяется временем нахождении рыб в растворе уретана.
Интенсивность двигательной активности, наркотизированных карасей, погруженных в токсический раствор фенола, не претерпевает существенных изменений, если сравнивать средние величины двигательной активности.
Интересно отметить, что уретановый наркоз (15-минутная экспозиция в 2%-ном растворе) не оказывает существенного влияния на продолжительность жизни испытуемых карасей.
Новокаиновый наркоз также предупреждает и временно снимает возбуждающее действие фенола на рыб. Как и в опытах с уретаном, выраженность тормозного влияния новокаина на внешний симптомокомплекс фенольной интоксикации рыб определяется глубиной наркотического эффекта, зависящей от продолжительности наркотизации.
После возвращения карасей в чистую воду уже через 4 ч восстанавливался рефлекс равновесия и появлялась заметная двигательная активность, хотя по внешнему виду они все еще находились в несколько угнетенном состоянии, что свидетельствует об обратимости фенольной интоксикации, которая убедительно более высокая у наркотизированных карасей в сравнении с контрольными. Важно отметить, что в опытах с фенольной интоксикацией обнаружилось, что наркотизированные караси обладали большей устойчивостью: из 15 контрольных карасей погибли 13 в среднем за 6,2 ч. а из 15-наркотизированных новокаином погибли только 2 и 13 карасей (86,6%) выжили.
Таким образом, полученные экспериментальные данные показывают, что наркотизация рыб уретаном и новокаином приводит к резкому торможению внешнего симптомокомплекса фенольной интоксикации и значительному увеличению латентного периода реакции. Наряду е этим существенно изменяется время и процент гибели подопытных рыб, а также степень и скорость обратимости токсического процесса. Тормозное влияние, новокаина на внешний симптомокомплекс фенольной интоксикации и исход отравления выражено в значительно большей степени, чем аналогичный эффект уретана. Объяснить полученные результаты можно тем, что новокаин не только обладает центральным наркотическим эффектом, но и ярко выраженной проводниковой анестезией, препятствующей передаче импульсов с периферии в центр. Суммируя полученные экспериментальные данные, можно сделать вывод, что токсическое действие фенола на рыб осуществляется через центральную нервную систему. Именно она определяет внешний симптомокомплекс фенольной интоксикации, проявление которой можно полностью предотвратить или временно предупредить, изменяя исходное функциональное состояние центральной нервной системы.
Головной и спинной мозг. Роль головного и спинного мозга в симптомокомплексе фенольной интоксикации рыб показали опыты, которые проводили на трех группах подопытных карасей. У рыб первой группы проводили оперативное разобщение головного и спинного мозга на уровне грудных плавников (несколько ближе к голове), у особей второй группы извлекали головной мозг из черепной коробки, а у рыб третьей группы удаляли только передний мозг. Часть опытов была поставлена на препарате изолированной головы, приготовленном таким образом, что сохранялись оба грудных плавника. Такая постановка опытов позволяла проследить за реакцией мышц грудных плавников, использованной в качестве индикатора возбуждения в центральной нервной системе под действием фенола. Во всех опытах применяли остро токсичную концентрацию фенола (100 мг/л) и проводили регистрацию двигательной активности рыб. Функциональное состояние спинальных рыб и препарата изолированной головы определяли путем раздражения переменным током по первичной реакции и перемещению спинальных рыб в поле электрического тока.
В первой серии опытов, проведенной на 25 спинальных карасях, у которых был удален головной мозг, было установлено, что реакция рыб на токсическое воздействие фенолом, проявляющаяся в бурной двигательной активности и последующих судорогах, полностью отсутствовала. Спинальные рыбы, погруженные в раствор фенола концентрацией 100 мг/л, оставались совершенно неподвижными на всем протяжении наблюдений, не удалось отметить и каких-либо судорожных явлений. Под воздействием переменного электрического тока спинальные рыбы вздрагивали и перемещались.
Из данных этой серии опытов следует, что головной мозг играет определяющую роль в реакции рыб на воздействие фенолом.
Специальные опыты были проведены на обезглавленных карасях. При этом обезглавленные караси также не реагировали на токсическое воздействие фенолом, как и караси, у которых был полностью вылущен головной мозг. Реакция на электрический ток у обезглавленных карасей сохранялась.
Следующая серия опытов, поставленная на 25 карасях, была проведена для выявления влияния высокой перерезки спинного мозга на внешнюю картину фенольной интоксикации. Для этого спинной мозг отделялся от головного на уровне грудных плавников. Поведение карасей в растворе фенола несколько отличалось от поведения карасей, у которых разобщение спинного и головного мозга достигалось посредством полного удаления головного мозга. У большинства подопытных карасей, погруженных в раствор фенола, отмечались беспокойные движения грудных плавников и мышц головы. Однако рыбы оставались неподвижными, лежа на дне аквариума. Иногда у некоторых особей наблюдались, редкие вздрагивания всего туловища, но судороги, подобные тем, которые отмечались у контрольных карасей, так и не развивались.
Таким образом, отделение спинного мозга от головного на уровне грудных плавников приводило к более или менее полному снятию фенольной реакции и прежде всего ее наиболее характерных компонентов: двигательной активности и судорог.
Как известно, передний мозг костистых рыб играет ведущую роль в дифференциации запаховых раздражителей. Кроме того, передний мозг рыб принимает участие в сложной координирующей деятельности центральной нервной системы. Поскольку фенол обладает выраженным запахом, можно предположить, что раздражение, поступающее по обонятельному тракту в передний мозг, определяет латентный период наступающего возбуждения в центральной нервной системе рыб. Для проверки этого предположения были проведены опыты на 15 карасях с вылущенным передним мозгом. Через 24–72 ч оперированных рыб, у которых не было заметных нарушений в статической или моторной функции, помещали в раствор фенола (100 мг/л). Опыты показали, что реакции карасей на фенольное раздражение ничем существенно не отличалась от реакции контрольных карасей и развивалась полностью. Средний латентный период фенольной реакции подопытных карасей оказался весьма близким к латентному периоду контрольных карасей. Данные этой серии опытов позволяют отвести предположение, что переднему, мозгу рыб может принадлежать ведущая роль в определении скорости развития первоначального двигательного возбуждения, наступающего под влиянием фенола. В описанной выше серии опытов по влиянию фенола на карасей, у которых была проведена перерезка спинного мозга на уровне грудных плавников, установлено, что хотя основные компоненты реакции рыб на фенольное раздражение были сняты, у рыб отмечались движения грудных плавников и судорожные подергивания головы.
Опыты на изолированных головах, помещенных в токсический раствор фенола, показали, что через 2–4 мин после погружения в раствор отмечаются сильные и беспорядочные движения парных грудных плавников. Сокращение мускулатуры грудных плавников настолько интенсивное, что вызывает перемещение головы по дну аквариума. Одновременно наблюдаются сокращения мышц головы и вращательные движения глазных яблок. Частота дыхания, вначале высокая, постепенно убывала, при этом амплитуда дыхательных движений также значительно уменьшалась. Все отмеченные в опытах на препарате изолированной головы реакции со стороны мышечной системы грудных плавников, головы и глазных яблок продолжались не более 7–12 мин, затем прекращались. Однако, даже через 1 ч, когда движение крышек очень редкое и еле заметное, препарат изолированной головы реагировал вздрагиванием на воздействие электрическим током.
Из полученных данных можно сделать вывод, что в основе отмеченных реакций препарата изолированной головы на воздействие фенолом лежат нервные импульсы, генерируемые в головном мозгу и посылаемые по 4 парам черепно-мозговых нервов
В заключение остановимся на результатах еще одной серии опытов по выявлению влияния разобщения спинномозговых путей на время гибели рыб в токсическом растворе фенола. Оперированные караси поступали в опыт через 24 ч после высокой перерезки спинного мозга. Полученные материалы показывают, что разобщение нервной связи между центром и периферией не оказывает существенного влияния ни на исход фенольной интоксикации, ни на время гибели рыб.
Анализируя приведенные данные можно сделать вывод, что головной мозг играет ведущую роль в определении наиболее характерных компонентов реакции рыб на токсическое действие ядов органического ряда: двигательной, активности вначале и судорог впоследствии. Полное удаление головного мозга приводит к тому, что ни одна из этих реакций так и не развивается на протяжении всего опыта. Локомоторный аппарат спинного мозга приводится в действие импульсами из головного мозга. Следовательно, спинной мозг является обычным звеном рефлекторной дуги и выступает как орган, проводящий импульсы, вызванные фенольным раздражением, из различных отделов головного мозга к периферическому нейромускулярному аппарату рыб. Установлено, что спинной мозг имеет важное значение в реакции рыб на ток, чем головной, в то время как в опытах с фенолом ведущую роль играет головной мозг, причем различные его отделы (продолговатый, средний, промежуточный и передний) имеют далеко неравноценное значение в определении характера реакции рыб на фенольное раздражение.
Опыты на карасях, лишенных переднего мозга, показали, что скорость наступления и динамика развитии комплекса реакций, обусловленных воздействием фенола, у оперированных и интактных рыб почти не различаются.
Следует вспомнить также, что одной из самых ранних и типичных реакций рыб на фенольное раздражение наряду с бурной локомоторной деятельностью является потеря рефлекса равновесия, а центры равновесия, как известно, относят к основанию среднего мозга. Все это свидетельствует о том, что средний мозг играет ведущую роль в развитии целой гаммы рефлекторных реакций рыб на воздействие ядов органической природы.
Наряду со средним мозгом важную роль в определении характера и исхода фенольной интоксикации у рыб играет продолговатый мозг, представляющий собой многозначный рефлекторный центр важнейших функций организма. Есть основание полагать, что основной причиной гибели рыб в токсических растворах многих ядов органической природы является необратимый паралич дыхательного центра, расположенного в продолговатом мозге.
Хеморецепторы. Согласно современным представлениям сенсорной физиологии первичное восприятие химических раздражителей осуществляется специализированными хеморецепторами – специальными образованиями, в которых происходит трансформация энергии раздражающего стимула в сигналы, несущие нервным центрам информацию о действующем агенте. У рыб, как и у других позвоночных животных, восприятие многочисленных химических раздражителей, поступающих в воду, осуществляется хеморецепторами. Сигналы, возникающие в хеморецепторах, направляется в центральную нервную систему, в результате чего организм получает информацию о присутствии в водной среде тех или иных химических соединений.
Химическая рецепция рыб включает обоняние, вкус и общее химическое чувство. Разделение первых двух видов химической рецепции рыб экспериментально обосновано с морфологических и физиологических позиций.
Что касается выделения общего химического чувства, отличного от вкусового, то его правомерность все еще дискутируется.
Важнейшим физиологическим свойством любого рецептора является чувствительность к адекватному стимулу. Уровень чувствительности оценивается порогом возбуждения, т. е. минимальной величиной стимула, способной вызвать возбуждение. Величина порога обратна величине возбудимости. Существуют различные методы регистрации обонятельных порогов пахучих веществ (условные рефлексы, поведенческие реакции, электрическая активность). С их помощью удалось установить, что рыбы обладают исключительно высокой чувствительностью обонятельных рецепторов, в сотни раз превышающей чувствительность обонятельной рецепции человека. Это позволяет рыбам воспринимать чрезвычайно малые концентрации химических веществ, обладающих запахами.
Электрофизиологическими исследованиями подтверждена высокая чувствительность обонятельной рецепции рыб, которые хорошо воспринимают различные органические соединения – спирты, кетоны, альдегиды, кислоты, эфиры, фенол и его производные.
Необонятельная химическая рецепция рыб (вкус и общая химическая чувствительность) так же высока, как и обонятельная. Рецепторный аппарат вкусовой системы рыб представлен вкусовыми почками, расположенными в слизистой оболочке ротовой полости на жабрах и наружной поверхности тела. Кроме того, восприятие химических раздражителей осуществляется свободными нервными окончаниями тройничного, блуждающего и спинномозговых нервов. Основными проводниками химической необонятельной рецепции служат блуждающий, языкоглоточный и лицевой нервы. Наружные вкусовые почки рыб высокочувствительны к различным веществам. Например, вкусовая чувствительность у гольянов по отношению к глюкозе в 1,6 раза, к фруктозе в 2,5 раза, хинину в 24 раза, а к поваренной соли в 205 раз выше, чем у человека.
Электрофизиологическими исследованиями показаны способность пресноводных рыб воспринимать химические вещества в очень низких концентрациях и наличие в небном органе карпа особой хеморецепторной системы, отвечающей специфично на разведенные растворы электролитов, интенсивность ответа зависит от валентности аниона. В опытах на пресноводном сомике выявлено существование двух типов кислотных волокон, одни из которых отвечают только на органические кислоты, а другие – на неорганические. Изучение электрической активности лицевого и небного нервов атлантического лосося при химическом раздражении области рыла и небного органа показало, что под влиянием слабых растворов солей, минеральных и органических кислот в афферентных нервах возникают разряды, величина которых зависит от концентрации и химической природы вещества.
Имеющиеся экспериментальные данные однозначно свидетельствуют о чрезвычайно высокой чувствительности рыб к различным группам химических веществ, что ставит их в особое положение по отношению к другим гидробионтам, в частности к водным беспозвоночным. Конечно, последние также обладают определенным уровнем чувствительности к токсикантам, поскольку химическая раздражимость – общее свойство живых клеток. Однако среди гидробионтов только рыбы обладают высоко развитой центральной нервной системой. И специализированными анализаторными системами, в частности химическим анализатором, специальное назначение которого – информировать организм о присутствии в окружающей среде разнообразных химических веществ.
Механизм действия токсикантов на центральную нервную систему рыб. В основе реакции рыб на фенол лежит его действии на центральную нервную систему, а именно на систему ацетилхолин – ацетилхолинэстераза. Первоначальная сильная стимуляция нервной системы, проявляющаяся в бурной двигательной активности и судорогах, определяется, по-видимому, стабилизацией физиологического ацетилхолина и его накоплением в холинергических синапсах центральной нервной системы рыб. Наступающие вслед за возбуждением угнетение и нейтральный паралич, обусловленные фенолом, могут быть поняты как следствие накопления ацетилхолина в синапсах мозга в чрезмерных концентрациях, вызывающих торможение. Увеличение уровня ацетилхолина в синапсах может быть достигнуто двумя путями: либо инактивацией ацетилхолинэстеразы, либо увеличением выделения ацетилхолина из нервных окончаний, либо, наконец, совместным действием обоих механизмов.
Таким образом, доказана ведущая роль центральной нервной системы в развитии сложного симптомокомплекса отравления рыб ядами органического ряда.
9. ТРАНСФОРМАЦИЯ ТОКСКАНТОВ В СРЕДЕ И ТЕЛАХ ГИДРОБИОНТОВ
9.1. Превращение токсических веществ в водной среде под влиянием абиотических факторов
Поступающие в водоемы токсиканты обычно включаются в круговорот веществ и претерпевают различные превращения. Малостойкие и летучие вещества оседают на дно или улетучиваются, окисляются, связываются солями буферной системы воды или разлагаются под действием микроорганизмов и быстро подвергаются детоксикации. Они оказывают на гидробионтов прямое токсическое или косвенное воздействие, ухудшая физические свойства воды, газовый и солевой режимы водоемов.
В распределении и превращении веществ, поступивших в водную среду, могут играть роль процессы различной природы:
физические (механическое перемешивание, осаждение, адсорбция и десорбция, улетучивание, фотолиз);
химические (диссоциация, гидролиз, комплексообразование, окислительно-восстановительные реакции);
биологические (разрушения и превращения с участием ферментов и метаболитов, поглощение живыми организмами, захоронение с отходами жизнедеятельности);
геологические (породообразование).
Вещества в водной среде распределяются между различными фракциями и фазами. Помимо растворенных форм, проникающих через фильтры с сечением пор до 0,45 мк, происходит образование слаборастворимых соединений и комплексов, адсорбция их органическими и неорганическими взвесями, поглощение грунтами и донными осадками, т.е. происходит изъятие из водной фазы большой доли веществ. Значительная часть нефти и нефтепродуктов, пестицидов, ПАВ локализуется в поверхностной пленке, толщиной до нескольких десятков микрон. В океанических водах концентрация металлов в этом слое в 10–1000 раз превышает концентрацию металлов в нескольких сантиметрах от поверхности.
Металлы. Металлы в растворимой фракции могут встречаться в виде свободных гидратированных ионов, неорганических ионов, соединений и комплексов, органических комплексов и хелатов, комплекса с высокомолекулярными соединениями (гуминовыми кислотами, полисахаридами). Так исследование форм меди в природных водах показало, что только растворимая фракция включает гидратированные ионы Cu(H2О)х+n, неорганические соединения образуют комплексы с гидроксилом и другими ионами Cu(OH)-4 ,Cu(OH)2, CuCO3, Cu(CN)-, CuCl2-2, органические комплексы образуются с пептидами, порфиринами, гуматами. Нерастворимая фракция включает медь, адсорбированную Fe(OH)3, взвесью неорганических частиц, CuS , CuO, и адсорбированную клетками водорослей и организмами, составляющими зоопланктон. В результате, менее 0,5% меди присутствует в водной среде в виде свободного иона. Фракция коллоидов может включать гидроксиды и окислы металлов с размером частиц до 150 мкм. Важную роль в адсорбция металлов играют мицеллы гидроокиси железа и гидратированного диоксида марганца. В коллоидной фракции металлов содержится на порядок больше, чем в ионном виде.
Переходные элементы могут изменять валентность, как например Сr (VI) переходит в морское среде в Сr (Ш) с быстрым осаждением и захоронением в дойных осадках.
Существенна роль кислорода в химических превращениях веществ и в определении формы существования этих веществ в водной среде. Восстановленные формы элементов обычно образуют более растворимые соединения, чем окисленные. Это оказывается одной из причин повышения концентрации растворенных соединений при дефиците кислорода в воде.
Комплексные соединения, которые представляют собой сочетание двух или нескольких простых молекул, образование которых не связано с формированием новых электронных пар, имеют определяющее значение для баланса различных форм металлов в водной среде. Комплексные соединения металлов образуются за счет взаимодействия с лигандами – реакционно-способными группами присутствующих в воде соединений. Обычно лигандами служат группы СO2, OH, NH3, Cl, I, PO4. Органические комллексообразователи включают поликарбоксиловые соединения, аминокислоты, жирные, гуминовые кислоты, хелаты, различные экзометаболиты гидробионтов. С увеличением валентности связываемых металлов стабильность комплексов возрастает.
Хелаты или клешневидные соединения широко распространены в природных водах. По сродству к хелатообразованию металлы располагаются в следующей последовательности:
Hg2+ , Cu2+, Ni2+, Pb2+, Co2+, Zn2+, Fe2+, Cd2+, Mn2+
Мелкодисперсные взвеси связывают на единицу веса больше металлов, чем крупнодисперсные. Поверхность большинства частиц взвесей и коллоидов имеет отрицательный заряд, что способствует их взаимодействию с катионами.
Для распределения металлов между фазами основополагающее значение имеет рН среды. Например: Zn при рН=7 осаждается в виде Zn(OH)2, ZnO, Zn3(PO4)2, ZnCO3. В результате осаждения концентрация большинства металлов быстро снижается с удалением от источника загрязнения. В пресных водах быстро убывает концентрация Pb, Zn, Cr, Cd (уже в сотнях метров от источника загрязнения), но не Ni, Cu, Со, Mn. В морской воде концентрация многих загрязняющих веществ снижается быстрее, чем в пресной.
Основная часть исчезнувшего из воды вещества переходит в грунт, в результате чего грунты часто содержат необычайно высокие уровни загрязняющих веществ, в то время как концентрация их в воде может и не быть повышенной. В донных осадках металлы содержатся в виде карбонатов, сульфидов и в связанной с органическими осадками состоянии. Важная роль в концентрировании ртути, цинка, марганца, железа, мышьяка отводится детриту. Взмучивание и изменение комплексообразующих свойств водной среды приводит к изменению концентрации ионов в воде при естественном изменении условий. Уровень металлов в воде повышается в период паводков и дождей.
Все эти превращения изменяют поступление токсических веществ в водные организмы. Повышенные концентрации вещества, способного связывать ионы и молекулы токсического агента, и прочность этих связей снижают «биодоступность» или «физиологическую доступность» токсиканта для гидробионтов.
Органические соединения также проходят в водной среде разнообразные превращения. Важную роль в превращении пестицидов играют температура, растворенный кислород, активность водородных ионов, свет, особенно в коротковолновой области. Окисление кислородом воздуха может приводить к образованию гидроперикесей. Реакции окисления приводят в основном к разрыву двойных связей, дехлорированию, изомеризации, фотоминерализация.
Различные химические вещества могут выступать в роли химических модификаторов. Металлы способствуют восстановлению пестицидов. Причем в присутствии разных металлов ассортимент промежуточных и конечных продуктов бывает различным. Такие реакции в присутствии металлов в верхних слоях воды могут ускоряться ультрафиолетовой радиацией солнца.
Важное значение в превращении органических соединений имеют реакция гидролиза. Гидролиз приводит к быстрому превращению органических хлоридов в гидроксиды, к быстрому разрушению карбаматов и другим превращениям.
Разнообразие этих превращений приводит к тому, что зачастую не известно, в каком виде исходное соединение вступает в контакт с тканями организма.
9.2. Пути поступления токсикантов в тела гидробионтов. Накопление веществ компонентами водных экосистем. Коэффициент биомагнификация, коэффициент распределения.
Поступать в организм гидробионтов вещества могут непосредственно через поверхность клетки или тела, через жабры и через желудочно-кишечный тракт. Препятствием к поглощению через поверхность тела служат чешуя рыб, раковины и панцири беспозвоночных.
У рыб некоторые вещества, а особенно тяжелые металлы, активно связываются муцином слизи и накапливаются на поверхности тела. Вероятно, через кожу непосредственно поступления не происходит.
Иногда тот или иной орган служит преимущественным путем поступления вещества. Так, описано преимущественное накопление свинца микроскопической зеленой водорослью Platymonas subcordifomis через жгутик. Лишенные жгутиков особи накапливали металла гораздо меньше, чем нормальные клетки. Дафния способна накапливать вещества особенно активно через поверхность антенн.
Транспорт веществ через клеточные мембраны происходит путем простой диффузии по градиенту концентрации фильтрацией через поры в мембране, что важно для небольших гидрофильных молекул радиусом менее 4А, путем пиноцитоза или через активный транспорт с участием переносчиков и с затратой энергии.
Скорость проникновения через мембраны ионов и заряженных молекул зависит от молекулярного объема: с увеличением объема скорость проникновения снижается. Если заряд иона совпадает по знаку с зарядом участка мембраны, он отталкивается, а если знаки противоположны, то происходит фиксация иона на этом участке.
Вследствие большого объема, а также в связи с взаимодействием зарядов, прохождение иона через мембрану затрудняется и он оказывает местное поверхностное действие. В связи с этим многие металлы поражают прежде всего жабры. По этой причине неорганические соединения ртути, способные диссоциировать, нарушают проницаемость жаберного эпителия, нейтральные молекулы ртутьорганических соединений, проникая через внешние мембраны, легко достигают внутренних органов, где быстро проявляется их эффект. По этой же причине хелаты металлов, несущие меньший заряд, активнее проникают в ткани гидробионтов, чем их ионы. Легко в клетку проникают ионы, для которых в мембране существует механизм избирательной проницаемости или которые могут переноситься в связанном состоянии. Некоторые ионы проникают через транспортную систему, предназначенную для других соединений. Так, мышьяк проникает в клетку через транспортную систему фосфатов, в результате чего в водах, бедных фосфором, накопление мышьяка идет активнее.
Высокой проникающей способностью обладают липофильные соединения или неэлектролиты. За счет липофильности эти вещества активно переходят из водной фазы окружающей среды и тканевых жидкостей в структуры клеток, накапливаясь здесь до высоких уровней. Обратный переход затруднен, поэтому липофильные соединения концентрируются в тканях и долго могут здесь сохраняться, что делает их особо опасными. Допускают, что электролиты проникают только в клеточную оболочку и не проходят внутрь клетки. Однако такую возможность следует признать лишь для части липофильных соединений, обладающих очень высокой гидрофобностыо.
Проникновение неполярных молекул или молекул со слабовыраженными полярными свойствами в значительной степени не ограничено их молекулярным объемом. Если такие молекулы имеют не более трех гидрофильных групп и молекулярный вес не более 130, они легко проникают через мембраны. Проникающая активность молекул, несущих полярные группировки, зависит от соотношения полярной и неполярной частей и возрастает с увеличением неполярной.
Проникающая способность органических молекул возрастает с удлинением углеводородной цепи, с увеличением числа метил-, этил- и фенил-групп и быстро падает с введением гидрокси- и карбоксил-групп.
Если скорость поступления вещества в клетку превосходит скорость его выхода из клетки, происходит его накопление в тканях. Задержка вещества в клетке происходит за счет химических и физико-химических взаимодействий.
Все больше значение придается возможности активного накопления различных веществ клеткой и организмом.
Через стенки кишечника водных животных тяжелые металлы могут переноситься ди- и трипептидами и первичными аминами, однако часть их в связанном виде, не ассимилируясь, выводится из организма.
Hа активность накопления веществ гидробионтами влияют как факторы абиогенной природы, так и биологические характеристики организма. Увеличение концентрации ионов кальция или других щелочноземельных катионов в среде понижает, а преобладание щелочных – увеличивает проницаемость мембран. Кальций ингибирует накопление кадмия и это служит причиной обратного соотношения их содержания в тканях гидробионтов. Кадмий снижает накопление цинка, ртути и других металлов.
Взаимовлияние металлов может служить причиной корреляции их содержания в тканях гидробионтов. Так, например, показана количественная связь содержания в моллюсках цинка и меди, меди и серебра, кадмия и цинка. В крабах положительная корреляция отмечена для содержания меди и цинка, кадмия и стронция. Подобная взаимосвязь отмечена у рыб для содержания меди и цинка, железа и марганца, кадмия и цинка, селена и ртути. Особым вниманием пользуется характерная для многих гидробионтов более или менее постоянная пропорция содержания селена и ртути (1:1). Полагают, что селен выполняет некоторую детоксирующую роль при отравлении ртутью.
Повышение температуры увеличивает проникновение веществ через мембрану. Однако такое повышение проявляется лишь до некоторого предела температуры.
Способность гидробионтов накапливать вещества может изменяться с возрастом. Например, ни личинки устриц, ни молодые особи не накапливали цинк. Эта способность развивалась между 50 и 100 днями после оседания. Возможно, что активным накопление становится с возрастанием роли некоторых ферментов, содержащих металлы. Характерна способность гидробионтов повышать с возрастом и размерами способность к накоплению липотропных агентов.
Кинетику возрастания уровня загрязняющих веществ в тканях обычно объясняют, как результат равновесного состояния между процессами включения и выведения вещества, происходящими в одно и тоже время.
Однако довольно часто на практике не удается получить столь однозначной закономерности. Отклонения особенно заметны у мелких организмов, имеющих высокое значение соотношения поверхности тела к объему. Очевидно, это отклонение не случайно, так как процесс включения вещества определяется не только закономерностями абсорбции и диффузии, но и зависит от механизмов активного транспорта и систем выведения организма. Активность этих систем изменяется как функция состояния организма в целом.
Активность накопления различных веществ из окружающей среды выражается через соответствующие коэффициенты.
Коэффициент, описывающий отношение содержания вещества в тканях гидробионтов к концентрации в воде, как известно, называется коэффициентом накопления.
В случаях, когда необходимо определить относительную избирательность накопления двух веществ, используется коэффициент накопления по пищевой цепи, или коэффициент биомагнификации, который представляет собой отношение количества вещества в тканях хищника к количеству вещества в тканях жертвы. Накопление по пищевой цепи присуще соединениям липофильным или имеющим сродство к некоторым молекулам биосубстрата и в экологическом отношении оказывается опасным явлением. Такое накопление обусловлено следующими причинами. Для построения единицы массы некоторого трофического уровня организмы этого уровня должны потреблять в среднем десятикратное количество пищи. Вместе с этим количеством пищи организмы потребляет соответствующее количество токсического вещества, накопленного пищевым организмом. Из пищи усваивается только часть массы и почти все количество токсиканта. Аналогичная передача произойдет и на следующем трофическом уровне.
Для примера: биомагнификация ДДТ в компонентах пищевой цепи болота Южной Флориды характеризуется следующими данными: вода – 0,02 мкг/кг, перифитон – 7 мкг/кг, донный грунт – 16 мкг/кг, раки – 23 мкг/кг, рыбы – 19 мкг/кг, аллигатор – 352 мкг/кг, яйца хищных птиц – 16500 мкг/кг.
Кроме хлорорганических соединений и ртути способность к накоплению по пищевой цепи проявила медь, кадмий, марганец, кобальт, железо.
Иногда в экспериментальной практике исследуются коэффициенты распределения между тканями гидробионтов. Чаще других рассчитывается коэффициент распределения "ткань-кровь". Такой коэффициент может отражать локализацию вещества в той или иной ткани и выявить наиболее поражаемый орган гидробионта. Перераспределение вещества между тканями с течением времени может быть использовано для оценки сроков, прошедших после загрязнения водоема.
Способность вещества накапливаться в тканях связывают, как уже отмечалось, с их липофильностью. В качестве показателя липофильности часто используется коэффициент распределения вещества между несмешивающимися средами, например: вода – оливковое масло, вода – н-октанол. Связь коэффициента распределения между водой и н-октанолом (КР) и коэффициентом накопления (КН) в тканях может быть описана некоторыми уравнениями. Так для рыб Pimephalee promelas такое уравнение имеет вид:
Ig KH = 0,85 IgKP - 0,7
Величина коэффициента различна для разных условий опыта, видов гидробионтов и групп веществ.
Распределение веществ в тканях зависит как от специфических свойств элемента, так и от химической формы соединения, в котором находится элемент в среде. Показано, что при загрязнении водоема ртутью содержание хлористой ртути и метил-ртутьхлорида в жабрах, печени, сердце лосося составляло свыше 10 мкг/кг, в почках и мышцах – свыше 15 мкг/кг, в желудке, кишечнике и крови – менее 5 мкг/кг.
В природных условиях в моллюсках наибольший уровень меди обнаружился в крови и в левой почке. Высокий уровень никеля отмечался в поверхностных тканях (мантия, эпидермис ноги). Основная масса других металлов обнаруживалась в пищеварительной железе или правой почке, которая функционально, вероятно, отличается от левой.
У большинства видов высших водных растений в корнях тяжелые металлы накапливаются интенсивнее, чем в листьях.
У устриц в клетках кишечного эпителия и пищеварительной железы кадмия было больше, чем в жабрах и почках.
В тканях гидробионтов металлы находятся в связанном состоянии. У моллюсков металлы включаются в комплекс с таурином и представляют собой подвижный, легкодоступный резерв металлов. При появлении повышенных уровней металла в тканях у водных животных стимулируется синтез специфических протеинов, способных связывать ионы металлов в большом количестве. Эти протеины называют металлотионеинами и полагают, что они выполняют детоксицирующую задачу. Накопление металлов в составе металлотионеинов может достигать необычайно высоких уровней. Так, устрицы в естественных условиях могут накапливать цинка до 10% от сухого веса тканей без заметного вреда для себя.
Детальное исследование показало, что в сильно загрязненных водах в тканях моллюсков формируется по крайне мepe 5 комплексов с молекулярным весом менее 3000, один из которых – комплекс с таурином. Металлотионеиноподобные белковые комплексы образуют в тканях водных животных такие металлы, как кадмий, цинк, медь, ртуть.
Однако не все металлы связываются преимущественно с протеинами. Так у тунцов мышьяк концентрируется главным образом в липидной фазе.
Активность и возможность синтеза металлотионеинов зависит от условий воздействия и состояния организма. У краба металлотионеины синтезировались при действии кадмия, но не меди или ртути. При действии кадмия повышается концентрация металлотионеинов и у креветок.
У балянусов цинк осаждался в клетках паренхимы в виде гранул в значительных количествах. Основным компонентам этих гранул является фосфат цинка. В меньших количествах в состав гранул включаются железо и медь. Депонирование цинка в тканях моллюсков осуществляется в виде гранул с белковой природы. У рыб уже в кишечнике образуются гранулы, связывающие металлы и препятствующие их поглощению тканями.
Полагают, что в обычном состоянии некоторый запас металлов сохраняется в организме гидробионтов в виде низкомолекулярных металлоорганических комплексов. При избытке металла, возникающем вследствие нахождения организма в загрязненной среде, его избыточное количество начинает связываться с белковыми молекулами, очевидно, специально синтезируемыми в тканях для этих целей. В виде этих металлотионеиноподобных соединений, выполняющих депонирующую роль, избыток металлов сохраняется в тканях. Переизбыток металлов в тканях может быть со временем захоронен в еще более высокомолекулярных соединениях, образующих гранулы в клетках беспозвоночных или в клеточных стенках водных растений.
Выделение остатков поглощенных организмом превращенных в процессе детоксикации чужеродных соединений происходит через печень, почки или заменяющие их органы, через поверхность клеток и тела, через органы дыхания с половыми продуктами и слизью. Содержания веществ в тканях обычно оценивается по периоду «полураспада» и «полувыведения», т.е. по времени снижения содержания вещества вдвое в организме или отдельной ткани. Например, для моллюсков период полувыведения ртути составляет от 15 сут. (в гонадах) до 60 сут. (пищеварительные железы, нога). Нафталин активно выводится мидиями через жабры и почки. Причем, этот процесс активнее проходил у особей, предварительно перенесших экспозицию нафталином в меньших концентрациях.
Таким образом, поглощение веществ из водной среды как и выведение, может происходить многими путями. Активность этих процессов зависит от свойств веществ, таких как липофильность, растворимость в воде, размер молекулы, а также от свойств среды, концентрации вещества и присутствия других соединений, не маловажны биологические свойства вида и индивидуальное состояние особи.
9.3. Биохимические механизмы трансформации токсикантов в телах гидробионтов
Установлено, что чужеродные соединения (ксенобиотики), поступающие в организм млекопитающих, претерпевают превращения, которые идут в два этапа.
На первом этапе (биотрансформация) происходят различного рода метаболические превращения (окисление, восстановление, гидролиз, дегидрохлорирование, десульфирование и др.), ведущие к появлению в молекуле ксенобиотика новых функциональных групп, повышающих ее полярность. В результате токсичность вещества может быть либо ослаблена (детоксикация), либо усилена (токсификация).
Биотрансформация чужеродных соединений катализируется ферментами, локализованными в микросомальной фракции клеток печени и других тканей. У теплокровных животных это – система смешанных оксидаз. Они осуществляют превращения разных по строению органических соединений при участии АДФ-Н2 и молекулярного кислорода. Активированный НАДФ-Н2 кислород в присутствии различных микросомальных гидроксилаз окисляет ядовитое соединение, изменяя его токсические свойства в сторону ослабления или усиления. Например, фосфорорганические соединения подвергаются в организме биологической активаций в результате окислительной десульфурации, т. е. отщепления серы и замены ее кислородом.
Доказано, что рыбы имеют все ферменты, необходимые для метаболизма липидорастворимых чужеродных веществ, а реакции, катализируемые этими энзимами, аналогичны таким реакциям у млекопитающих.
Помимо фосфорорганических пестицидов микросомальные ферменты печени рыб катализируют метаболические превращения других ядовитых соединений, в частности различных нефтепродуктов и полициклических ароматических углеводородов.
Акцентируя внимание на принципиальном сходстве ферментных систем, осуществляющих метаболические превращения ксенобиотиков у рыб и млекопитающих, необходимо иметь в виду, что метаболизм чужеродных соединений и организме рыб происходит медленнее, чем у млекопитающих.
Принципиальное сходство между рыбами и млекопитающими в их реакции на токсические вещества заключается в том, что ксенобиотики, поступая в организм рыб, способны индуцировать у них образование ферментов, катализирующих метаболические превращения чужеродных соединений. Например, активность гидроксилаз, металлизирующих растворенные нефтепродукты и некоторые полициклические ароматические углеводороды, заметно возрастает в тканях рыб (печень, жабры, почки), подвергшихся токсическому воздействию этих веществ как в экспериментальных, так и в естественных условиях.
Продукты метаболических превращений, катализируемые микросомальными ферментами печени, могут затем выделяться без каких-либо изменений, вступать в синтетические реакции конъюгации, подвергаться метаболизму с помощью нормальных процессов обмена и, наконец, аккумулироваться в тканях. Реакцию конъюгации справедливо рассматривают как истинную детоксикацию различных ядов.
Второй этап метаболических превращений многих ксенобиотиков, обладающих токсическими свойствами – конъюгация, которая представляет собой биосинтез, при котором чужеродные соединения или их метаболиты соединяются с легкодоступными субстратами (например, глюкуроновая кислота, сульфат, ацетил, метил, глицин), образуя конъюгаты. Конъюгация происходит путем присоединения к функциональной группе чужеродного соединения, в результате этого молекула становится более полярной, менее липидорастворимой и поэтому более легко выделяемой из организма животного. Как и метаболические превращения, реакции синтеза и конъюгации протекают при участии специфических ферментов.
Необходимо отметить, что описываемые процессы, могут иметь место и вне тканей живых организмов. Для превращений, происходящих в водных микроорганизмах, особое значение имеет микрофлора, обитающая в полостях этих макроорганизмов-хозяев. Некоторые превращения, которые ранее относили на счет реакций метаболизма рыб, как оказалось, осуществляется при участии обменных реакций микроорганизмов кишечника.
Так, при участии микроорганизмов происходит окислительно-восстановительное превращение кобальта, хрома. Аэробные микроорганизмы преобразуют вещества путем окисления, а анаэробные путем восстановления.
Считают, что свыше 90% ртути, содержащейся в рыбе, включено в метилртуть. Если метилртуть является продуктом детоксикации, то процесс ее образования является детоксикацией для микроорганизмов, но не для организма-хозяина или других гидробионтов, накапливающих метилртуть из окружающей среды. При участии микрофлоры происходит, в частности, образование хлористых и сернистых соединений ртути, как промежуточных производных в ее обмене.
Превращение большинства соединений осуществляется с участием ферментов нормального метаболизма. Главным итогом превращения соединений в тканях является повышение их растворимости в воде, благодаря которой ускоряется выведение вещества из организма.
Превращение чужеродных органических соединений идет через двухфазный процесс – метаболическое превращение и конъюгацию. Метаболические превращения включают одно или ряд окислений, восстановлений, реакций гидролиза, приводящих к появлению групп, повышающих полярность молекулы. Конъюгация – это взаимодействие с глюкуроновой, серной кислотами, аминокислотами. Эти превращения и приводят к возрастанию полярности и снижению липофильности. Кроме того, конъюгация ведет к блокированию функциональных групп молекул токсиканта, что снижает их токсичность. В результате фенол, например, переходит в фенил-сульфат, бензойная кислота в бензолглюкуронид, цианид в тиоцианат.
Механизм конъюгации различен у морских и пресноводных рыб. У пресноводных рыб реакции конъюгации не так развиты, как у морских, в связи с ограниченным набором ферментов.
При разрушении или превращении чужеродных соединений в организме могут образовываться и более токсичные производные. Это явление называют летальным синтезом. Особенно опасно включение этих производных в состав нуклеиновых кислот и белковых молекул.
ПРИМЕРНЫЕ ВОПРОСЫ К СЕМИНАРАМ
