
- •Федеральное агентство по рыболовству
- •Введение
- •1. Краткая История создания систем кондиционирования воздуха
- •2. Задачи кондиционирования воздуха и нормы климата
- •Контрольные вопросы
- •3. Термодинамические свойства влажного воздуха
- •3.1. Основные параметры и характеристики сухого и влажного воздуха
- •Водяной пар
- •Паровоздушная смесь
- •Контрольные вопросы
- •4. Санитарно-гигиенические основы кондиционирования воздуха
- •4.1. Методы определения относительной влажности
- •4.2.Современные приборы измерения параметров воздуха
- •4.3. Оптимальные параметры окружающего воздуха для различных видов нагрузки
- •Результирующие температуры, °с
- •Метеорологические нормы микроклимата судовых помещений
- •Контрольные вопросы
- •5. Тепло-, массо- и воздухообмен в скв
- •5.1. Расчет теплового и влажностного балансов в помещении
- •5.2. Определение теплопритоков в помещении при различных наружных и внутренних условиях
- •5.3. Выделение тепла, влажности и газов в производственном помещении
- •5.3.1. Определение теплопритоков
- •5.3.2. Влагопоступление в помещении
- •5.3.3. Расчет газопоступлений в помещении
- •Количество углекислого газа, выделяемого людьми
- •Контрольные вопросы
- •6. Методы обработки воздуха
- •6.1. Тепло- и влагообмен между воздухом и водой
- •6.2. Построение процессов изменения состояния влажного воздуха на d-I-диаграмме
- •6.3. Нагревание воздуха
- •6.4. Охлаждение воздуха
- •6.5. Осушение воздуха
- •6.6. Увлажнение воздуха
- •Значение коэффициента эффективности е
- •6.7. Воздухонагреватели и воздухоохладители судовых систем кондиционирования воздуха
- •6.8. Фильтрация воздуха в системах кондиционирования
- •7. Системы кондиционирования воздуха
- •7.1. Классификация систем кондиционирования воздуха
- •7.2. Краткая характеристика кондиционеров воздуха
- •7.3. Принцип работы кондиционера
- •7.4. Хладагенты.
- •7.5. Судовые системы кондиционирования
- •8. Газодинамический расчет систем
- •8.1. Определение потерь давления в системах
- •8.2. Вентиляторы
- •8.3. Воздухораспределители
- •8.4. Шумоглушители
- •8.5 Теплоутилизационные установки
- •Библиографический список
- •Оглавление
6.5. Осушение воздуха
Воздух может охлаждаться и осушаться с помощью контактных поверхностных (рекуперативных и регенеративных) тепломассообменных аппаратов, в которых в качестве хладоносителей, рассол или хладагент, а также с помощью воздушных турбокомпрессорных холодильных машин (кондиционеров), твердых и жидких поглотителей влаги.
Осушение воздуха представляет собой процесс снижения его влагосодержания d. Этот процесс нельзя отождествлять с уменьшением относительной влажности .
При осушении воздуха одновременно могут изменяться либо все параметры, характеризующие его состояние, либо некоторые. Параллельно уменьшению влагосодержания можно отводить ощутимую теплоту, т.е. снижать энтальпию, но с расчетом, что относительная влажность при непрерывном понижении температуры воздуха будет оставаться неизменной. Однако, процесс снижения влагосодержания может проходить таким образом, что энтальпия воздуха будет уменьшаться при постоянной температуре и убывающей относительной влажности воздуха.
Воздух может осушаться и при постоянной энтальпии. Такой процесс сопровождается возрастанием температуры и уменьшением относительной влажности.
Осушение воздуха охлаждением
Осушение воздуха возможно в контактных аппаратах охлаждения, находившегося в непосредственным взаимодействии с водой. Из-за ограниченного времени контакта с водой в аппаратах и скорости движения воды и воздуха, характер процесса и конечное состояние воздуха возможно ненасыщенным.
Если целью процесса изменения состояния воздуха является только его осушение, понижение температуры воздуха неизбежно. Поэтому необходимо, чтобы при осушении температура понижалась как можно меньше.
Чтобы температура воздуха в конце процесса была выше, необходимо понижать температуру поверхности, с которой воздух взаимодействует. Чем выше температура осушенного воздуха при заданном уменьшении влагосодержания, тем ниже температура охлаждающей поверхности. Чем меньше конечное влагосодержание воздуха, тем ниже должна быть температура охлаждающей поверхности.
Процесс взаимодействия воздуха с поверхностью рассматривается как непрерывное перемешивание его с воздухом пограничного слоя. Процесс будет сопровождаться выпадением влаги в виде мельчайших капель водяного или ледяного тумана. Далее практически невозможно выделять частицы капельножидкой влаги или льда из осушенного воздуха. Конечное влагосодержание воздуха может оказаться выше расчетного.
Чаще наряду с осушением воздух охлаждают. Если процесс осушения основан на охлаждении воздуха и последующем его нагревании, то при рациональном расположении осушителя и холодильной машины можно для нагревания воздуха использовать тепло, отдаваемое холодильной машиной. В этом случае ходильная машина работает в качестве теплового насоса (рис. 23).

Рис. 23. Осушение и нагревание воздуха в тепловом насосе
Осушитель состоит из двух камер: нижней Н и верхней В. В первой – установлен змеевиковый испаритель И. Воздух поступает в нижнюю камеру, омывая поверхность змеевика, осушается и охлаждается. Затем он входит в верхнюю камеру, где омывает поверхность конденсатора К холодильной машины и нагревается до заданного уровня.
Холодильный агент подается в испаритель через регулирующий вентиль РВ и отсасывается компрессором М. Влага, выпадавшая на поверхности испарителя, стекает в поддон П, из которого удаляется наружу. Энтальпия воздуха, выходящего из осушителя выше, чем при входе.
Осушение воздуха возможно и при использовании холодильных машин через поверхностные теплообменники, с температурой поверхности ниже температуры точки росы. Здесь осушение осуществляется за счет отвода теплоты и влаги воздуха охлаждением.
Осушение воздуха водными растворами
Жидкие поглотители (абсорбенты) - вещества, изменяющиеся физически или химически в процессе осушки воздуха. К ним относятся растворы хлористого кальция CaCl2 · 6H2O и хлористого лития LiCl.
В водных растворах солей при равных температурах упругость пара в пограничном слое над поверхностью раствора ниже упругости пара над поверхностью воды. Это свойство водных растворов используется для осушения воздуха.
Свойства растворов обусловлены особенностями растворенного вещества и концентрацией в молях kм – число килограмм молекул растворенного вещества (соли) в 1000 кг воды.
Концентрацию обычно выражают в процентах (%) веса растворенного вещества к весу раствора:
![]() ,
,
где G и gc – соответственно весовое количество воды и растворенного вещества в растворе.
Наиболее существенное свойство водных растворов удобно определять по фазовой диаграмме (рис. 24).

Рис. 24. Фазовая диаграмма раствора поваренной соли
Если раствор, состояние которого в начальный момент времени характеризуется точкой А, охлаждать, то до определенной температуры tв никаких изменений не обнаруживается (прямая АВ). В точке В раствор переходит в криоскопическое состояние.
Если продолжать охлаждать раствор, то его состояния в фазовой диаграмме будут изменяться вдоль линии ВС и будет выпадать лед.
Кривая ВС называется кривой криоскопических состояний.
Если бы исходное состояние раствора характеризовалось точкой Е, то охлаждение его в начальной стадии изображалось бы прямой ЕД. По достижении некоторой температуры охлаждение сопровождается выпадением из раствора кристаллов растворенного вещества. Следовательно, в точке Д раствор будет насыщенным. Дальнейшее охлаждение раствора будет сопровождаться выпадением кристаллов вещества, а состояние раствора будет изменяться по кривой ДС – насыщенного раствора.
В точке С раствор представляет собой смесь из кристаллов льда и соли. Жидкая фаза отсутствует. Это состояние называется эвтектическим. Точка С – эвтектическая точка. Концентрация раствора kэ, соответствующая эвтектическому состоянию, также называется эвтектической.
Из фазовой диаграммы следует, что каждому значению концентрации соответствует определенная температура криоскопического состояния раствора, т.е. состояния, при котором из раствора начинает выпадать лед. Каждой концентрации соответствует определенное понижение температуры замерзания раствора против температуры замерзания воды. Это понижение температуры тем больше, чем выше концентрация раствора.
Поглощение воды из воздуха сопровождается выделением теплоты сорбции, основной составляющей которой является скрытая теплота конденсации. Так же сюда входит теплота гидратации, растворения и разбавления, не превышающая 5 – 15% общей теплоты сорбции (для некоторых растворов теплота разбавления может быть отрицательной).
Значение относительной влажности воздуха над поверхностью раствора:
![]() ,
,
где Рр – упругость водяного пара над поверхностью раствора при заданной температуре раствора; Рв - упругость водяного пара над поверхностью воды при той же температуре.
В криоскопическом состоянии каждому значению концентрации раствора соответствует определенное значение относительной влажности (φ).
При температуре раствора выше температуры соответствующей криоскопическому состоянию, упругость водяного пара р и величина φ (при малых концентрациях) являются функцией температуры замерзания раствора.
Диаграммы парциального давления водяного пара над водными растворами хлористого кальция и хлористого лития приведены на рисунках 25 и 26.
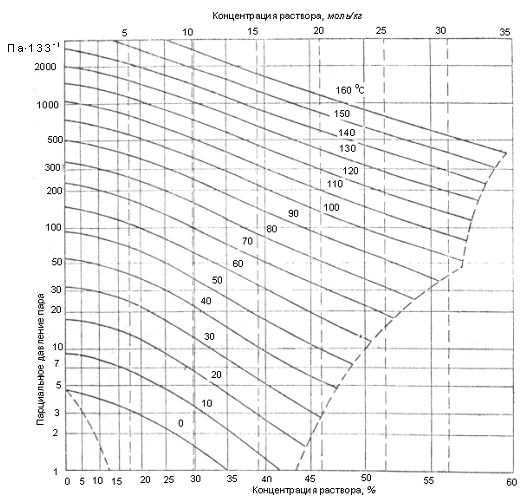
Рис. 25. Зависимость парциального давления водяного пара
от концентрации водного раствора хлористого лития
Поглощение воды из воздуха сопровождается выделением теплоты гидратации, растворения, разбавления и конденсации. Процессы тепло- и влагообмена проходят в воздухоохладителях, орошаемых раствором соли. При одинаковой температуре воздуха, рассола и воды в воздухоохладителе воздух после орошения становится суше, чем после орошения водой.
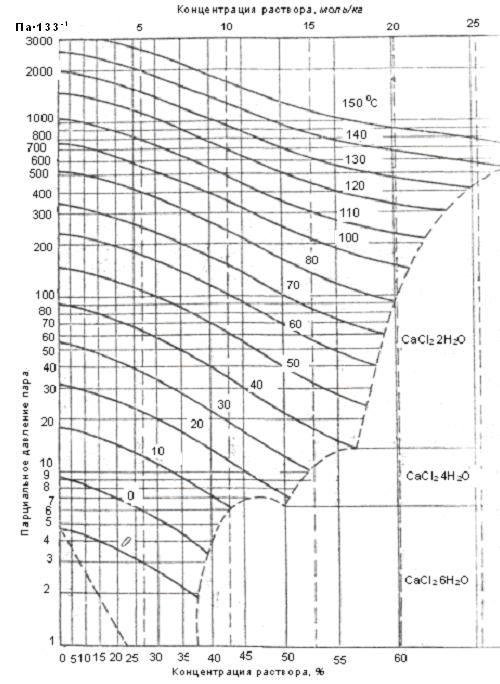
Рис. 26. Зависимость парциального давления водяного пара
от концентрации водного раствора хлористого кальция
Относительную влажность воздуха можно понизить с помощью раствора LiCl до 5% при влагосодержании до 1 г/кг, а с помощью раствора CaCl2 · 6H2O до 45 – 48%.
Осушку воздуха абсорбентами можно осуществлять в форсуночных камерах орошения кондиционеров или в специальных абсорбционных аппаратах.
В таблицах 5 и 6 приведены свойства растворов CaCl2 · 6H2O и LiCl.
Таблица 5
Свойства раствора CaCl2 · 6H2O
|
Концентрация, % |
Теплоемкость при 20°С, кДж/кг·°С |
Температура замерзания, °С |
Температура кипения, °С |
Удельный вес при 10°С кгс/м3 |
φ=р/р при 20°С
|
|
0 |
4,168 |
0 |
100 |
- |
1 |
|
2 |
4,064 |
-0,9 |
100 |
- |
1 |
|
4 |
3,939 |
-2 |
100 |
- |
0,98 |
|
6 |
3,834 |
-3 |
100,5 |
1051,3 |
- |
|
8 |
3,729 |
-4,3 |
100,5 |
1069,1 |
- |
|
10 |
3,645 |
-5,7 |
101,2 |
1087,2 |
0.93 |
|
12 |
3,520 |
-7,5 |
101,2 |
1105,6 |
- |
|
14 |
3,436 |
-9,4 |
101,2 |
1124,4 |
- |
|
16 |
3,335 |
-11,7 |
103,2 |
1143,8 |
- |
|
18 |
3,226 |
-14,5 |
103,2 |
1163,2 |
- |
|
20 |
3,143 |
-17,6 |
105 |
1183,1 |
0,78 |
|
22 |
3,059 |
-21,5 |
105 |
1203,3 |
- |
|
24 |
2,975 |
-25,3 |
105 |
1224 |
- |
Количество раствора, которое должно циркулировать в системе, определяется весовым расходом осушаемого воздуха Lγ, кгс/ч и допустимым отклонением концентрации от заданной ε, %. Отклонение концентрации Δε принимается от 0,1 до 0,3%. Весовой расход циркулирующего раствора, кгс/ч:
![]() ,
,
где d1 и d2 – соответственно начальное и конечное влагосодержаниевоздуха, г/кг;
Количество раствора Gpv, кгс, необходимого для заполнения системы, определяется её вместимостью V, м3, и удельным весом раствора γр, кгс/м3:
Gpγv = V · γр
Используя водные растворы, можно осуществлять самые разнообразные процессы изменения состояния воздуха. К веществам, водные растворы которых пригодны для изменения состояния воздуха, относятся NaCl, MgCl2, CaCl2, LiCl, LiBr и др. При выборе раствора необходимо учитывать не только термодинамические, но и свойства, способные вызывать коррозию, токсичность, химическую способность. Наиболее широко применяются растворы LiBr и некоторые другие соли лития.
Таблица 6
Свойства раствора LiCl
|
Концентрация, % |
Тепло-емкость при 20°С, кДж/кг·°С |
Темпе- ратура замерзания, °С |
Темпе-ратура кипения, °С |
Вязкость при 10°С кгс/м2 |
Удельный вес при 10°С кгс/м3 |
φ=р/р
при 20°С
|
|
0 |
4,168 |
0 |
100 |
- |
- |
1 |
|
7,8 |
3,775 |
-8,9 |
102,1 |
1,3 |
1045 |
0,94 |
|
15,5 |
3,482 |
-21,2 |
105,3 |
1,68 |
1085 |
0,85 |
|
20,2 |
3,259 |
-36,8 |
109,4 |
2,16 |
1119 |
0,8 |
|
25,3 |
3,096 |
-56 |
114,5 |
2,75 |
1150 |
0,68 |
|
29,7 |
2,975 |
-67,8 |
120,3 |
3,67 |
1181 |
0,55 |
|
33,6 |
2,879 |
-40 |
128,1 |
4,82 |
1203 |
0,45 |
|
37,1 |
2,791 |
-17,2 |
131,6 |
6,55 |
1235 |
0,35 |
|
40,4 |
2,711 |
2,6 |
135,6 |
9,74 |
1257 |
0,2 |
|
43,2 |
2,644 |
14,5 |
141,1 |
13,8 |
1279 |
- |
|
45,8 |
2,585 |
30,3 |
145,1 |
- |
- |
- |
|
48,2 |
2,531 |
56,1 |
149 |
- |
- |
- |
|
50,4 |
2,472 |
68,9 |
152,8 |
- |
- |
- |
|
52,4 |
2,430 |
82,2 |
156,1 |
- |
- |
- |
Осушение воздуха твердыми поглотителями влаги
Некоторые вещества, характеризующиеся капиллярной структурой и способностью адсорбировать влагу из воздуха (силикагель SiO2 и алюмогель Аl2О3) относятся к твердым поглотителям. Твёрдые поглотители удаляют водяной пар из воздуха вследствие того, что давление пара в их порах ниже парциального давления пара в осушаемом воздухе.
Эффективность сорбента зависит от температуры, влажности, скорости движения потока осушаемого воздуха и толщины слоя поглотителя. Скорость воздуха принимается в пределах 0,15-0,5 м/с. Толщина слоя поглотителя используется не менее 50 мм, а количество силикагеля в осушителе применяется 1 кг на 40 м3/ч осушаемого воздуха.
Процесс тепломассообмена при осушении воздуха адсорбентом приблизительно представляется следующим образом: при переходе водяных паров из воздуха в сорбент выделяется теплота адсорбции. Эта теплота содержит теплоту скрытой конденсации и теплоту смачивания, освобождающейся при контакте жидкой и твердой поверхностей. Общая теплота переходит в явную теплоту, нагревая сорбент, а в последствии и воздух. При этом процессе температура сорбента устанавливается на таком уровне, который соответствует балансу теплоты, т.е. когда количество скрытой теплоты конденсации, передаваемой от воздуха к сорбенту, будет равно количеству явной теплоты, передаваемой от сорбента к воздуху. Температура воздуха в процессе осушения возрастает. В зависимости от начального состояния температура воздуха может достигать 40-50 °С и это является недостатком твердых осушителей воздуха.
Для реактивации адсорбент нагревают, чтобы давление пара адсорбированной влаги стало выше парциального давления водяного пара в воздухе, пропускаемом через реактиватор. В охлажденном адсорбенте после реактивации давление пара в порах ниже парциального давления пара в воздухе. Температура реактивации в пределах от 75 до 300 °С, т.е. происходит выпаривание влаги из адсорбента. При использовании силикагеля эта температура составляет около 120 °С. При реактивации температура воздуха (по сухому термометру) выходящего из осушителя, резко поднимается и держится, пока большая часть воды, содержащейся в материале, не испарится. Далее температура выходящего воздуха вновь резко повышается, что говорит о конце процесса реактивации.
SiO2 получается путем обработки жидкого стекла минеральной кислотой. В готовом виде силикагель – это зернистое стекловидное вещество. Размер зерна может колебаться в широких пределах, для осушения воздуха желательно применять с зернами диаметром 1,0-3,0 мм. Этот поглотитель характеризуется химической и механической стойкостью и прочностью. Силикагель рационально применять для осушения при температуре воздуха примерно в пределах до 30-35 °С. При достижении предельной влажности силикагель теряет способность дальнейшего поглощения влаги из воздуха. Продолжительность периода адсорбции происходит в пределах от 10 мин. до 8 ч.
Для проведения процесса осушения необходимо определить толщину слоя геля, поверхность слоя и продолжительность процесса адсорбции. Количество влаги, кг, подлежащее адсорбции:
G = L (dн – dк) ,
где L – количество воздуха, м3/ч; dн, dк – начальное и конечное влагосодержание воздуха, кг/кг; – длительность адсорбции, ч.
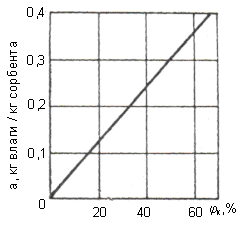
Конечная относительная влажность воздуха зависит от содержания влаги в силикагеле и определяется по графику (рис. 27а).
Объём силикагеля определяется:
V
=
![]() ,
,
где G – количество поглощаемой влаги, кг/с; а - коэффициент; γс - насыпной вес силикагеля, кг/м3.
По принятой скорости движения осушаемого воздуха и объёму силикагеля определяют необходимую толщину слоя.
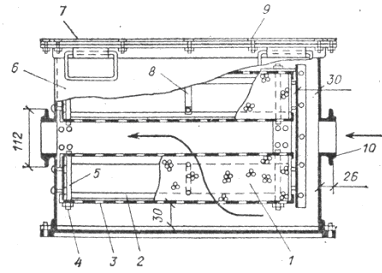
Общий вид простейшего силикагелевого осушителя изображен на рисунке 27б.
а
б
Рис. 27.
а – зависимость конечной влажности осушаемого
воздуха от содержания влаги в силикагеле;
б - осушитель конструкции В.И. Сыщикова
1 - слой силикагеля, 2 - рамка, 3 - сетка, 4 - гайка, 5 - штырь,
6 – корпус, 7 – крышка,8 – планка, 9 – болт, 10 – патрубок.
Алюмогель Аl2О3, активированный алюминий, можно применять для осушения воздуха температурой не выше 25 °С. Адсорбционные возможности ниже, чем у силикагеля. Подобно силикагелю, алюмогель – материал зернистый и применяется такими же размерами зерна.
