
- •Федеральное агентство по рыболовству
- •Содержание
- •Лабораторная работа №1 Изучение классов неорганических соединений Введение
- •Номенклатура оксидов
- •Получение оксидов
- •Химические свойства оксидов
- •Кислоты
- •Номенклатура кислот
- •Кислородсодержащие кислоты хлора
- •Получение кислот
- •Химические свойства кислот
- •Специфические свойства кислот
- •Основания (гидроксиды металлов)
- •Номенклатура оснований
- •Получение оснований
- •Химические свойства оснований
- •Номенклатура солей
- •Получение солей
- •Химические свойства солей
- •Степень окисления элементов.
- •Графические формулы оксидов, кислот, оснований, солей
- •Экспериментальная часть Приборы и материалы
- •Варианты экспериментальных задач
- •Оформление лабораторной работы
- •Пример оформления лабораторного опыта
- •Тестовые задания для самоконтроля Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •Вариант № 4
- •Вариант № 5
- •Укажите формулы оксидов, не реагирующих со щелочами
- •Вариант № 6
- •Вариант № 7
- •Вариант № 8
- •Вариант № 9
- •Вариант № 10
- •Вариант № 11
- •Вариант № 12
- •Вариант № 13
- •Вариант № 14
- •Вариант № 15
- •Задачи для самостоятельной работы
- •Вариант 5
- •Вариант 6
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Лабораторная работа № 2 Приготовление раствора кислоты заданной концентрации Введение
- •1. Цели и задачи
- •2. Теоретическая часть
- •Классификация растворов
- •Примеры расчета концентрации растворов
- •3. Экспериментальная часть
- •4. Задачи для самостоятельной работы
- •Плотность растворов некоторых неорганических кислот и щелочей в воде при 20ºС
- •Лабораторная работа № 3 Скорость химических реакций и химическое равновесие Введение
- •1. Цели и задачи
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •3.1. Исследование зависимости скорости гомогенной реакции от концентрации
- •3.2. Исследование зависимости скорости гомогенной реакции от температуры
- •3.3. Исследование влияния изменения концентрации на смещение равновесия
- •3.4. Исследование влияния изменения температуры на смещение равновесия
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 4 Ионно-обменные реакции Введение
- •1. Цели и задачи
- •1.1. Приобрести системные знания о теории электролитической диссоциации, изучить условия протекания реакций обмена в водных растворах электролитов.
- •2. Теоретическая часть
- •2.1. Электролитическая диссоциация. Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
- •2.2.Степень диссоциации. Сильные и слабые электролиты
- •2.3 Константа диссоциации
- •2.4. Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
- •2.5. Изменение энергии Гиббса и направленность химических процессов
- •Примеры решения задач
- •3. Экспериментальная часть
- •3.1. Получение малорастворимых оснований
- •3.2. Получение малорастворимых кислот
- •3.3. Реакции со слабыми электролитами
- •3.4. Получение малорастворимых солей
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 5 Водородный показатель и гидролиз солей Введение
- •1. Цели и задачи
- •2. Теоретическая часть
- •2.1. Ионное произведение воды, рН - растворов
- •2.2. Гидролиз солей
- •Примеры решения задач
- •3. Экспериментальная часть
- •3.1. Определение реакции среды при помощи индикаторов
- •Определение рН при помощи универсального
- •Индикатора
- •3.3. Реакция среды растворов различных средних солей
- •3.4. Факторы, влияющие на степень гидролиза
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 6 Окислительно-восстановительные реакции Введение
- •1. Цели и задачи
- •2. Теоретическая часть
- •2.1. Степень окисления.
- •2.2.Окислители и восстановители
- •2.3. Методика составления овр
- •3. Экспериментальная часть
- •3.1. Окислительные свойства галогенов
- •3.2. Окислительные и восстановительные свойства пероксида водорода н2о2
- •3.3. Окислительные свойства перманганат - иона MnO4-
- •3.4. Влияние среды на протекание окислительно-восстановительных процессов
- •3.5. Внутримолекулярная окислительно-восстановительная реакция
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 7
- •Электрохимическая активность металлов и гальванический
- •Элемент
- •Введение
- •1. Цель и задачи
- •2. Теоретическая часть
- •2.1. Электродный потенциал. Химическая активность металлов
- •2.2. Устройство и работа гальванического элемента
- •3. Экспериментальная часть
- •3. 1. Качественное определение различной электрохимической активности металлов
- •3.2. Изготовление медно-цинкового гальванического элемента
- •3.3. Изготовление медно-никелевого гальванического элемента
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 8 Электролиз водных растворов солей Введение
- •1. Цель и задачи
- •2. Теоретическая часть
- •2.1. Сущность электролиза. Электролиз расплава электролита
- •2.2. Законы Фарадея
- •2.3. Электролиз растворов электролитов
- •3. Экспериментальная часть
- •Лабораторная работа № 9 Коррозия металлов и методы защиты от коррозии Введение
- •1. Цели и задачи
- •2. Теоретическая часть
- •Химическая коррозия
- •Электрохимическая коррозия
- •Примеры решения эталонных задач
- •3. Экспериментальная часть
- •3.1. Образование микрогальванопар
- •3.2. Электрохимическая коррозия железа
- •3.3. Действие ионов, активирующих процесс коррозии
- •3.4. Ингибиторы раствора
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 10 Химический контроль качества воды Введение
- •1. Цели и задачи
- •2. Краткий теоретический материал
- •3. Экспериментальная часть
- •3.1. Определение жесткости воды
- •3.2. Определение щелочности воды
- •3.3. Определение водородного показателя
- •4. Задачи для самостоятельной работы
- •Лабораторная работа № 11 Полимеры Введение
- •1. Цели и задачи лабораторной работы
- •2.Теоретическая часть
- •2.1. История развития науки о полимерных материалов
- •2.2. Классификация полимерных соединений
- •2.3.Получение полимеров
- •2.4.Особенности строения полимеров
- •2.5. Свойства полимеров
- •2.5.1. Растворы полимеров
- •2.5.2 Набухание
- •2.6. Использование полимеров.
- •3. Экспериментальная часть
- •1.Определение примерной плотности полимеров1
- •2.Термопластичность полимеров
- •3. Горение
- •4.Отношение полимеров к растворам кислот и щелочей
- •5.Отношение полимеров к окислителям.
- •4. Задачи для самостоятельной работы
- •Литература
Федеральное агентство по рыболовству
Федеральное государственное бюджетное
образовательное учреждение высшего профессионального образования
«Дальневосточный государственный технический рыбохозяйственный университет»
(ФГБОУ ВПО «ДАЛЬРЫБВТУЗ»)
Каткова С.А., Бянкина Л.С., Бут И.В., Хальченко И.Г., Конева Е.Л.
ХИМИЯ
методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов
всех форм обучения
Владивосток
2012
УДК 54 (075.8)
ББК 24 я 73
С 232
Утверждено редакционно-издательским советом Дальневосточного государственного технического рыбохозяйственного университета
Автор: к.х.н., доцент Каткова С.А., к.х.н., доцент Бянкина Л.С., доцент Бут И.В., ст. препод. Хальченко И.Г., к.т.н., Конева Е.Л.
Рецензент:
Апанасенко О.А. к.х.н., доцент кафедры «Химия» Дальневосточного государственного технического рыбохозяйственного университета.
Содержание
1. Л/р №1 «Изучение классов неорганических соединений» 4
Задачи для самостоятельной работы 41
2. Л/р №2 «Приготовление раствора кислоты заданной концентрации» 47 Задачи для самостоятельной работы 55
3. Л/р № 3 «Скорость химических реакций и химическое равновесие» 58
Задачи для самостоятельной работы 68
4. Л/р № 4 «Ионно-обменные реакции» 71
Задачи для самостоятельной работы 79
5. Л/р № 5 «Водородный показатель и гидролиз солей» 81
Задачи для самостоятельной работы 90
6. Л/р № 6 «Окислительно-восстановительные реакции» 92
Задачи для самостоятельной работы 102
7. Л/р № 7 «Электрохимическая активность металлов и
гальванический элемент» 107
Задачи для самостоятельной работы 115
Л/р № 8 «Электролиз растворов солей» 117
Задачи для самостоятельной работы 124
9. Л/р № 9 «Коррозия металлов» 127
Задачи для самостоятельной работы 138
10. Л/р № 10 «Химический контроль воды» 141
Задачи для самостоятельной работы 148
11. Л/р 11 «Полимеры» 149
Задачи для самостоятельной работы 164
Лабораторная работа №1 Изучение классов неорганических соединений Введение
В настоящее время известно более десяти миллионов различных веществ. Классификация их, т.е. объединение в группы или классы, обладающие сходными свойствами, позволяет систематизировать знания о веществах и облегчает изучение веществ. Знание того, к какому классу принадлежит то или иное вещество, позволяет прогнозировать его физические и химические свойства.
Огромное количество соединений приводит к необходимости создания способа наименования химических веществ, или номенклатуры. До тех пор, пока веществ было известно сравнительно немного, они получали бессистемные названия, отражающие их свойства, способ получения, имя первооткрывателя и т.д. Часто это были весьма образные названия, многие из которых сохранились и поныне — глауберова соль, соляная кислота, нашатырный спирт и т.д. Однако с развитием химии появилась необходимость в универсальном способе названия веществ, который отражал бы их строение и был бы международным.
В современной химии принято использовать несколько видов номенклатуры: международная систематическая номенклатура ИЮПАК (IUРАС - международный союз теоретической и прикладной химии) и исторически сложившаяся тривиальная и рациональная номенклатуры. Однако только номенклатура ИЮПАК связывает структуру соединения и его названия.
Исторически первой и до сегодняшнего времени наиболее употребимой является классификация веществ, основанная главным образом на их строении (Рис. 1).
В зависимости от состава все вещества можно разделить на две большие группы: простые и сложные.
Простыми называют вещества, образованные атомами одного элемента.
Сложными веществами (или химическими соединениями) называют вещества, образованные атомами разных элементов.
Простых веществ гораздо меньше (учитывая аллотропные модификации – около 400), чем сложных; как правило, название простого вещества совпадает с названием образующего его элемента. Исключение составляют названия разных аллотропных модификаций одного вещества; как правило, они имеют собственные названия (например, алмаз, графит и т.д.).
Вещества Металлы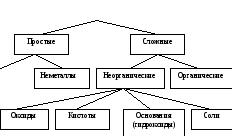
Рис. 1. Классификация веществ
Простые вещества делят на металлы и неметаллы. Неметаллов всего 22: водород, галогены, благородные газы, азот, кислород, углерод, бор, фосфор, сера, мышьяк, селен, теллур.
Сложные вещества делят на две большие группы: органические и неорганические. К органическим относят большинство соединений углерода, за исключением его оксидов, солей угольной кислоты и ряда других.
Неорганические соединения могут классифицироваться как по составу, так и по свойствам (функциональным признакам). По составу они, прежде всего, подразделяются на двухэлементные (бинарные) и многоэлементные соединения.
К бинарным соединениям относятся, например, соединения элементов с кислородом (оксиды), галогенами (галиды – фториды, хлориды, бромиды, иодиды), серой (сульфиды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), соединения металлов с водородом (гидриды). Названия бинарных соединений образуются из латинского корня названия более электроотрицательного элемента с окончанием «ид» и русского названия менее электроотрицательного элемента в родительном падеже. Так, Al2O3 – оксид алюминия, OF2 – фторид кислорода (так как фтор – более электроотрицательный элемент, чем кислород).
Среди многоэлементных соединений важную группу образуют гидроксиды, т.е. вещества, в состав которых входят гидроксильные группы –ОН и которые можно рассматривать как соединения оксидов с водой. К ним относятся как основания (основные гидроксиды - NaOH), так и кислоты (кислотные гидроксиды – H2SO4 или SO2(OH)2), а также вещества, способные проявлять как кислотные, так и основные свойства (амфотерные гидроксиды – Al(OH)3).
По функциональным признакам неорганические соединения подразделяются на классы в зависимости от характерных функций, выполняемых ими в химических реакциях: оксиды, основания (гидроксиды), кислоты и соли.
Рассмотрим важнейшие классы неорганических веществ.
ОКСИДЫ
Оксидами называются сложные вещества, состоящие из атомов двух элементов, один из которых — кислород.
Оксиды, в свою очередь, делятся на две группы солеобразующие и несолеобразующие.
По химическим свойствам солеобразующие оксиды делят на три подгруппы: основные, кислотные и амфотерные.
Несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. Наиболее важные из них такие, как СО - оксид углерода (II), N2O - оксид азота (I), NО - оксид азота (II).
