
Лабораторная работа №1
Классы неорганических соединений
Неорганические вещества делятся на простые и сложные.
1. Классификация простых веществ.
Простые вещества состоят из атомов одного элемента. Все простые вещества условно делятся на металлы и неметаллы. К неметаллам относятся 22 элемента: H, B, C, Si, N, P, As, O, S, Se, Te, галогены (F, Br, Cl, J, At) и инертные газы (He, Ne, Ar, Kr, Xe, Rn), к металлам - все остальные, то есть большинство простых веществ - металлы. Металлы отличаются характерным блеском, ковкостью, тягучестью, могут прокатываться в листы и вытягиваться в проволоку, обладают хорошей тепло- и электропроводимостью. При комнатной температуре все металлы, кроме ртути, находятся в твёрдом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупкостью, очень плохо проводят тепло и электричество. Некоторые из них при нормальных условиях находятся в газообразном состоянии.
2. Классификация сложных веществ.
Из неорганических веществ, в практике чаще всего приходится иметь дело с оксидами, гидроксидами и солями.
Оксиды
Оксидами называются сложные химические соединения, состоящие из какого-либо элемента и кислорода: ЭmOn. Степень окисления кислорода в оксидах равна -2, поэтому для написания формулы оксида, то есть для определения индексов m и n, в формуле оксида надо степень окисления элементов и кислорода поставить "крест-накрест". Например, для железа со степенью окисления +3 формула оксида такова: Fe2+3 O3-2 , т.е. Fe2O3;
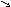
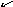 для
меди со степенью окисления +1:Cu2+1
O-2;
для
меди со степенью окисления +1:Cu2+1
O-2;
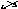 для
свинца со степенью окисления +4:Pb+4O2-2.
для
свинца со степенью окисления +4:Pb+4O2-2.
Название оксида составляют из слова "оксид" и названия элемента. Если элемент проявляет переменную степень окисления, то после названия оксида указывают в скобках римской цифрой степень окисления элемента.
Например: FeO-оксид железа (II), NO-оксид азота (II).
Оксиды делятся на солеобразующие и несолеобразующие (безразличные). Солеобразующие оксиды по химическим свойствам делятся на: а) кислотные, б) основные, в) амфотерные.
К кислотным оксидам относятся оксиды неметаллов, например: SiO2, SO3, P2O5 и оксиды металлов с высшей степенью окисления, например: Cr+6O3; Mn2+7O7 и др.
К основным оксидам относятся оксиды металлов со степенью окисления +1, +2, +3. Например: Na2+1O, Mg+2O, Sc2+3O3 и др.
К амфотерным оксидам относятся оксиды некоторых металлов, например: BeO, ZnO, SnO, PbO, Al2O3, Cr2O3 и др. Металлы, проявляющие переменную степень окисления, образуют несколько оксидов, характер которых изменяется закономерно; с повышением степени окисления металла основные свойства оксида убывают, а кислотные - усиливаются. Например: хром в соединениях проявляет степень окисления +2, +3, +6, образуя соответствующие оксиды: CrO - основной оксид, Cr2O3 - амфотерный оксид, CrO3 - кислотный оксид.
Несолеобразующие (безразличные) оксиды NO, N2O, CO.
Химические свойства оксидов
1. Растворимые оксиды взаимодействуют с водой с образованием щёлочи или кислоты:
BaO+H2O = Ba(OH)2 ;
SO3+H2O = H2SO4 .
2. Кислотные и основные оксиды реагируют между собой, образуя соли:
CO2+K2O = K2CO3;
SiO2+CaO = CaSiO3.
3. Кислотный оксид реагирует с основанием, а основной оксид вступает в реакцию с кислотой, образуя соль и воду:
CO2+Ba(OH)2 = BaCO3+H2O;
CuO+2HCl = CuCl2+H2O.
4. Амфотерные оксиды реагируют и с кислотами и со щелочами, образуя соль и воду.
ZnO+H2SO4 = ZnSO4+H2O;
tº
ZnO+2NaOH = Na2ZnO2+H2O.
Таким образом, кислотные и основные оксиды реагируют с веществами противоположного характера. Например, кислотные оксиды реагируют с основными оксидами и основаниями, но не реагируют с веществами кислотного характера. Амфотерные оксиды обладают двойственной природой.
Несолеобразующие оксиды (CO, NO, N2O) не вступают в реакцию с водой, другими оксидами, гидроксидами, не образуют солей.
