
Молекулярная физика (2 семестр) Кл. / Лаб.№1 / Лабораторная работа №1
.docxБланк лабораторной работы
ПЕТРОЗАВОДСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕСИТЕТ
Кольский филиал
|
ФИО: Климов Андрей Александрович |
Наименование лабораторной работы: Лабораторная работа № 1 Определение отношения молярных теплоемкостей Cp/Cv для воздуха |
||||||
|
Факультет: Физико-энергетический |
|||||||
|
Курс, группа: 1курс, 1 группа |
Цель работы: экспериментальное определение показателя адиабаты Cp/Cv для воздуха |
||||||
|
Этап работы |
Оценка |
Дата |
Преподаватель |
|
|||
|
Допуск |
|
|
|
|
|||
|
Окончание |
|
|
|
Принадлежности: лабораторная установка |
|||
|
Итоговая оценка |
|
||||||
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ И МЕТОДИКА ИЗМЕРЕНИЙ
Адиабатным (адиабатическим) называют термодинамический процесс, происходящий в термодинамической системе без подвода теплоты. Первое начало термодинамики для произвольного динамического процесса имеет вид
dQ = dU + dA
здесь dQ - бесконечно малое количество теплоты, подводимое к термодинамической системе; dA – бесконечно малая работа, совершаемая термодинамической системой в результате данного процесса; dU - бесконечно малое изменение внутренней энергии системы. Для адиабатного процесса это соотношение принимает вид:
dU + dA = 0
Для одного моля идеального газа имеем:
dU = CVdT
dA = PdV
здесь СV - молярная теплоемкость при постоянном объеме газа.
Подставляя эти соотношения вместо dU + dA, получим
CVdT + PdV = 0
Для одного моля идеального газа запишем уравнение Клайперона:
PV = RT
Дифференцируя его, найдем связь между параметрами dP, dV и dT:
PdV + VdP = RdT
Из этого уравнения получим:
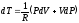
Дифференциальное уравнение, связывающее объем и давление идеального газа в адиабатном процессе:
(CV+R)*PdV+CV*VdP = 0
Учитывая, что Cv+R=СР - молярная теплоемкость идеального газа при постоянном давлении, получим:
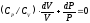
Известно, что для идеального газа молярные теплоемкости СP и CV не зависят от температуры:
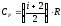 ;
;
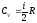
где i - число степеней свободы молекулы идеального газа.
Считая воздух при атмосферном давлении идеальным газом, получаем, что показатель CP/CV - постоянная для данного газа величина.
В
этом случае решение дифференциального
уравнения
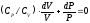 имеет
вид:
имеет
вид:
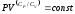
Это уравнение называют уравнением адиабаты (уравнением Пуассона), а показатель CP/CV - показателем адиабаты (показателем Пуассона).
Можно
выразить энтальпию как ![]() и внутренняя
энергия может
быть представлена как
и внутренняя
энергия может
быть представлена как ![]() .
Таким образом, можно также сказать, что
показатель адиабаты — это отношение
энтальпии к внутренней энергии:
.
Таким образом, можно также сказать, что
показатель адиабаты — это отношение
энтальпии к внутренней энергии:
![]()
С
другой стороны, теплоёмкости могут быть
выражены также через показатель адиабаты
(![]() )
и универсальную
газовую постоянную (
)
и универсальную
газовую постоянную (![]() ):
):
![]()
