
- •ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
- •Алкадиены
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ
И
1

Алкадиены
Непредельные соединения, содержащие в молекуле две двойные связи, называются диеновыми углеводородами (алкадиенами).
СnН2n-2 |
диолефины |
2

Алкадиены
Строение и классификация
H C |
|
C |
|
CH |
H2C |
|
CH |
|
HC |
|
CH2 |
|
|
|
|
||||||||
|
|
|
|
|
|||||||
|
|
|
|
||||||||
2 |
2 |
|
|
|
|
|
|
|
|||
кумулированный |
|
сопряженный |
|||||||||
|
пропадиен |
|
бутадиен-1,3 |
||||||||
|
(аллен) |
|
|
(дивинил) |
|||||||
H2C CH CH2 HC CH2
изолированный пентадиен-1,4
3

Алкадиены
Номенклатура и изомерия
1 |
2 |
3 |
4 |
5 |
|
||||
H2C |
|
CH |
|
CH |
|
CH |
|
CH3 |
пентадиен-1,3 |
|
|
||||||||
|
|
|
|||||||
|
|
||||||||
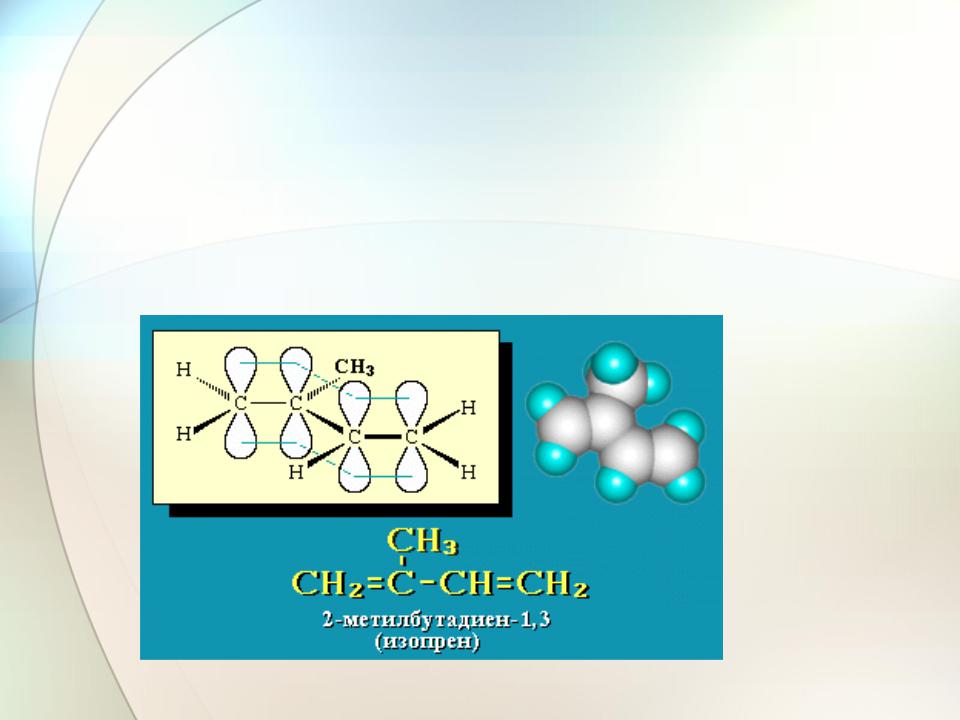
H2C C HC CH2 2-метилбутадиен
(изопрен)
CH3
4

Алкадиены
Строение и классификация
Наибольшего внимания заслуживают углеводороды с сопряженными двойными связями, в них двойные связи разделены одной простой
CH2=CH-CH=CH2 |
CH =C-CH=CH |
CH =C-CH=CH |
|||
2 |
2 |
||||
2 |
|
2 |
|
|
|
|
|
|
|||
|
|
|
|
Cl |
|
|
CH3 |
|
|||
1,3-бутадиeн |
|
2-хлор-1,3-бутадиeн |
|||
2-мeтил-1,3-бутадиeн |
|||||
дивинил |
изопрен |
|
хлоропрен |
||
5

Алкадиены
Строение и классификация
Сопряженный диен более устойчив, чем воображаемый диен с двумя независимыми двойными связями
Теплоты гидрирования алкенов и диенов
Соединение |
Теплоты гидрирования, кДж/моль |
CH3–CH=CH2 (Пропен) |
126 |
CH3–CH2–CH2–CH=CH2 (1-Пентен) |
127 |
CH2=CH–CH2–CH=CH2 (1,4-Пентадиен) |
254 |
CH2=CH–CH=CH2 (1,3-Бутадиен) |
239 |
6
Алкадиены
Строение и классификация
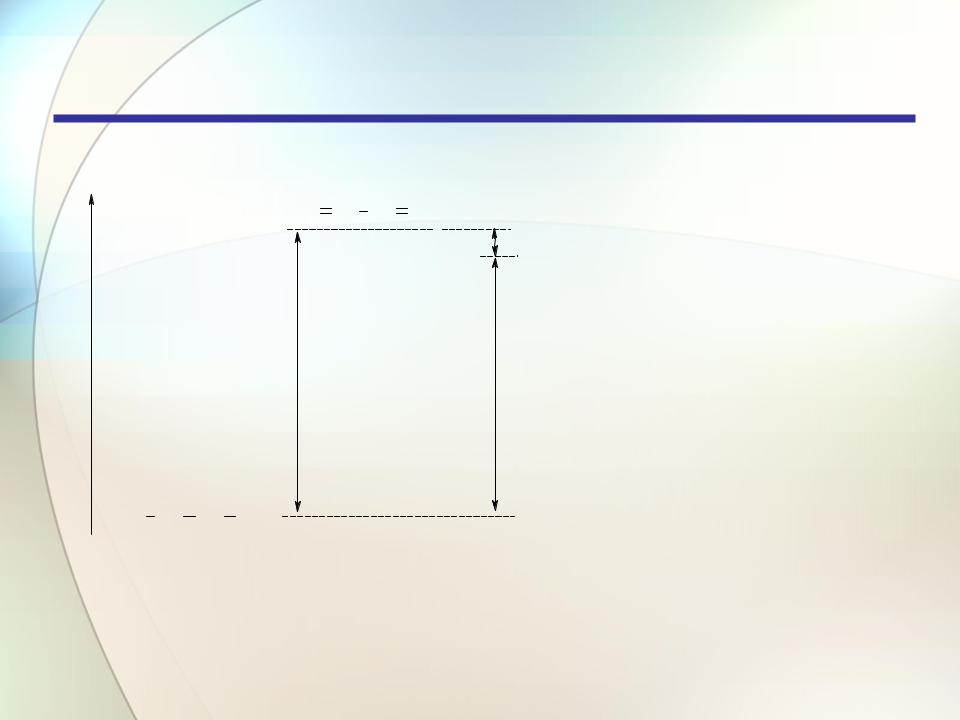
H2C CH HC CH2+ 2H2 |
15 кДж/моль |
|
|
|
энергия сопряжения |
254 кДж/моль |
239 кДж/моль |
(вычислено) |
(эксперимент) |
H3C CH2 CH2 CH3
Выигрыш энергии (15 кДж/моль) называется энергией сопряжения
7
Алкадиены
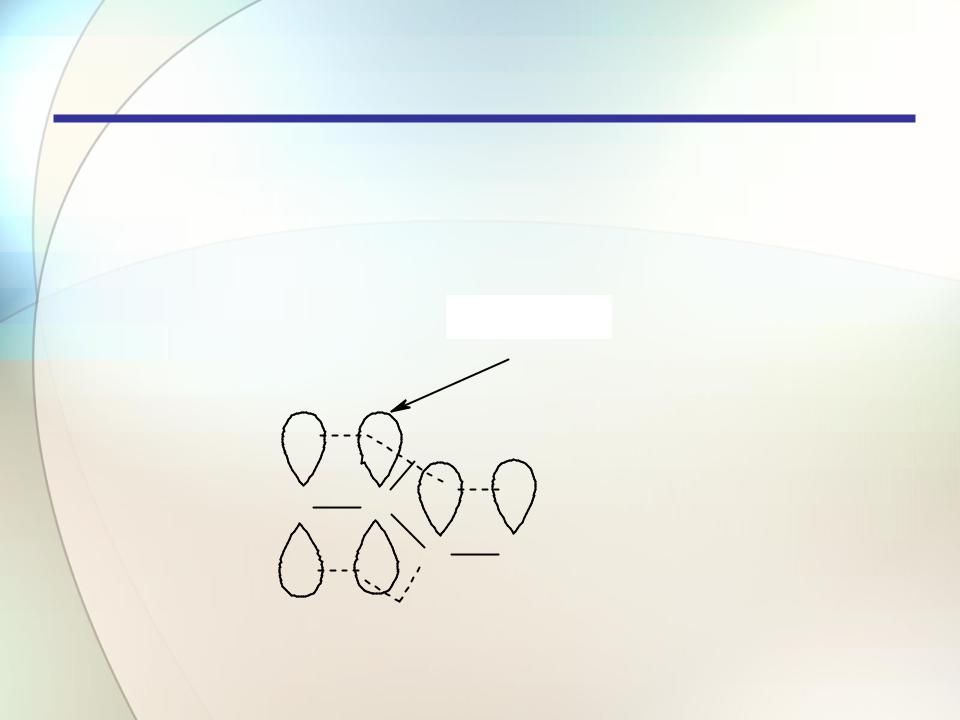
Строение и классификация
Электроны обеих -связей активно взаимодействую друг с
другом. Длины углерод-углеродных связей в диеновой системе в известной мере усредняются
(p-p)- -связи
H 
H2C C
CCH2
H 



8
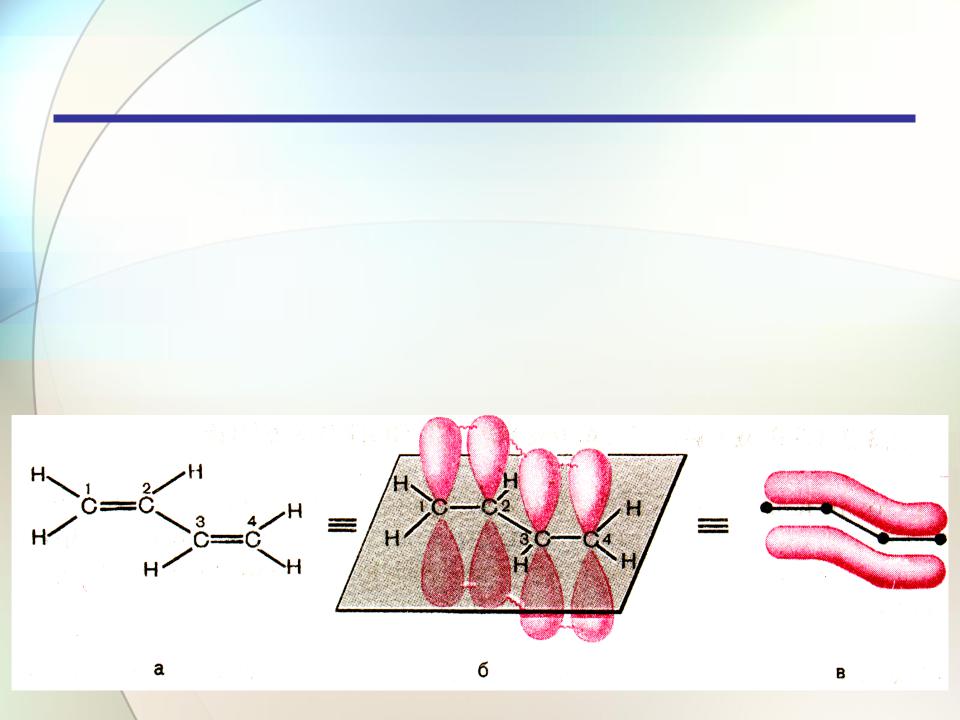
Алкадиены
Строение и классификация
Сопряжение — это образование единого электронного облака в результате взаимодействия негибридизованных pz-орбиталей
в молекуле с чередующимися двойными и одинарными связями.
9
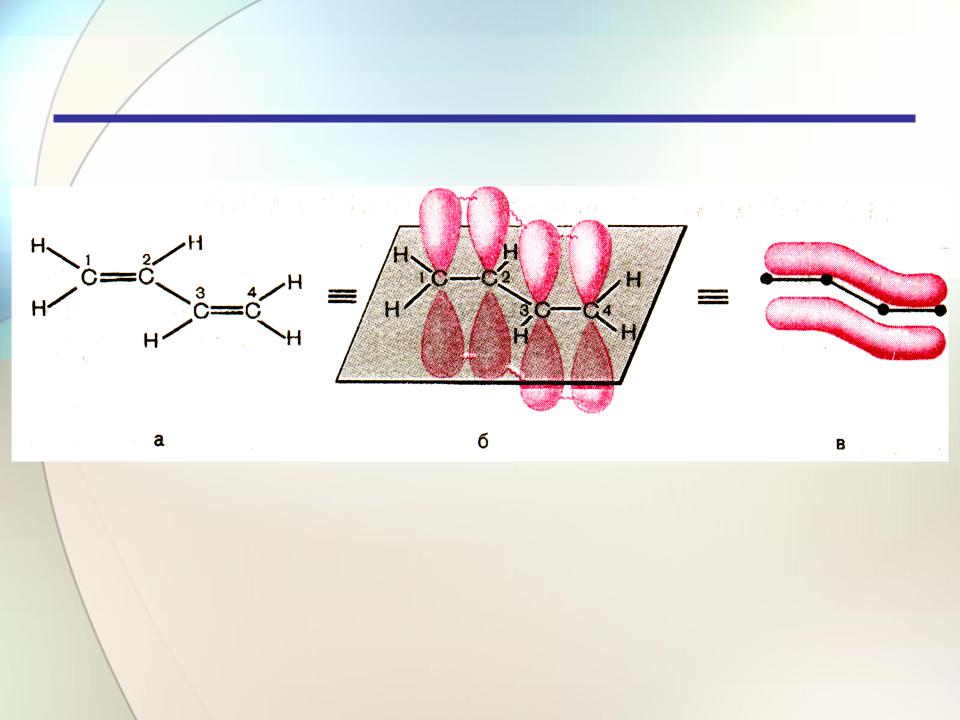
Алкадиены
Строение и классификация
Делокализация электронной плотности — это ее распределение по всей сопряженной системе, по всем связям и атомам.
10
