
ВУГЛЕВОДИ
.docВУГЛЕВОДИ
Вуглеводи
за хімічною будовою - це поліоксиальдегіди,
поліоксикетони, їх полімери та похідні.
Назва «Вуглеводи» не відповідає хімічний
будові і поряд з нею вживаються інші:
"Цукри", "Сахариди", “Глікани”.
Вуглеводи поділяють на моносахариди
(прості цукри), олігосахариди (олігомери,
що складаються з кількох залишків
моносахаридів) та полісахариди (полімери,
що складаються з багатьох залишків
моносахаридів).
3.1.
Моносахариди
Будова,
ізомерія
Моносахариди
не підлягають гідролітичному розщепленню
з утворенням менших молекул вуглеводів.
Їх загальна формула СnН2nOn. За кількістю
атомів карбону в молекулі моносахариди
поділяються на групи. Найбільш поширеними
є гексози (6 С) та пентози (5 С). Під час їх
перетворення в живих організмах
утворюються тріози (З С), тетрози (4 С),
гептози (7 С).
За розміщенням карбонільної
групи моносахариди поділяють на ряди
структурних ізомерів: альдози та кетози.
Найпростішими їх представниками є
альдотріоза гліцериновий альдегід і
кетотріоза диоксиацетон:
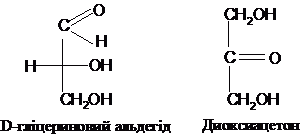 Для
вуглеводів характерна просторова
ізомерія – оптична (хіральна), пов’язана
з різним розміщенням в просторі замісників
біля асиметричного атома карбону. За
абсолютною конфігурацією вуглеводи
відносять до D або L ряду, порівнюючи з
еталоном - гліцериновим альдегідом.
Конфігурацію
моносахаридів з більшою кількістю
атомів С визначають за останнім від
початку молекули (від найбільш окисненої
групи) асиметричним атомом карбону.
Якщо розміщення гідроксильної групи в
нього таке ж, як і у D-гліцеринового
альдегіду, ізомер відносять до D-ряду,
якщо, як в L-гліцеринового альдегіду -
до L-ряду.
Оптичні ізомери мають
однаковий запас внутрішньої енергії,
однакові фізичні та хімічні властивості
і відрізнити їх можна за поведінкою в
асиметричному середовищі, так само, як
рукавички на різні руки можна виявити,
надягнувши на руку. Саме таку асиметричну
будову мають природні речовини та їх
комплекси, причому існують переважно
в одній з модифікацій. Так, більшість
вуглеводів належить до D-ряду.
Якщо
природа надає перевагу певному оптичному
антиподу, то штучно синтезовані речовини
- це рацемічна суміш. У зв'язку з цим
вважають, що існує небезпека загибелі
біосфери внаслідок рацемізаціі. Цей
процес може бути тривалим і непомітним,
але і необоротним. Призвести до цієї
катастрофи можуть масове використання
синтетичних харчових продуктів і ліків,
хімічне і ядерне забруднення.
Кількість
оптичних ізомерів для молекул, що містять
декілька асиметричних атомів карбону,
визначається за формулою: N= 2n , де N -
кількість ізомерів, n - кількість
асиметричних атомів карбону. Так для
альдогексоз, які мають чотири асиметричних
центри існує 16 оптичних ізомерів (8 D- і
8 L-ряду).
В розчині вуглецевий ланцюг
молекул моносахаридів може приймати
різну форму, в тому числі і згинатися.
При цьому створюється можливість для
взаємодії карбонільної та однієї з
віддалених гідроксильних груп. Це
приводить до одержання циклічних
внутрішньомолекулярних напівацеталів,
які можна розглядати як похідні
кисневмісних гетероциклів: п’ятичленного
– фурану і шестичленного – пірану.
Для
вуглеводів характерна просторова
ізомерія – оптична (хіральна), пов’язана
з різним розміщенням в просторі замісників
біля асиметричного атома карбону. За
абсолютною конфігурацією вуглеводи
відносять до D або L ряду, порівнюючи з
еталоном - гліцериновим альдегідом.
Конфігурацію
моносахаридів з більшою кількістю
атомів С визначають за останнім від
початку молекули (від найбільш окисненої
групи) асиметричним атомом карбону.
Якщо розміщення гідроксильної групи в
нього таке ж, як і у D-гліцеринового
альдегіду, ізомер відносять до D-ряду,
якщо, як в L-гліцеринового альдегіду -
до L-ряду.
Оптичні ізомери мають
однаковий запас внутрішньої енергії,
однакові фізичні та хімічні властивості
і відрізнити їх можна за поведінкою в
асиметричному середовищі, так само, як
рукавички на різні руки можна виявити,
надягнувши на руку. Саме таку асиметричну
будову мають природні речовини та їх
комплекси, причому існують переважно
в одній з модифікацій. Так, більшість
вуглеводів належить до D-ряду.
Якщо
природа надає перевагу певному оптичному
антиподу, то штучно синтезовані речовини
- це рацемічна суміш. У зв'язку з цим
вважають, що існує небезпека загибелі
біосфери внаслідок рацемізаціі. Цей
процес може бути тривалим і непомітним,
але і необоротним. Призвести до цієї
катастрофи можуть масове використання
синтетичних харчових продуктів і ліків,
хімічне і ядерне забруднення.
Кількість
оптичних ізомерів для молекул, що містять
декілька асиметричних атомів карбону,
визначається за формулою: N= 2n , де N -
кількість ізомерів, n - кількість
асиметричних атомів карбону. Так для
альдогексоз, які мають чотири асиметричних
центри існує 16 оптичних ізомерів (8 D- і
8 L-ряду).
В розчині вуглецевий ланцюг
молекул моносахаридів може приймати
різну форму, в тому числі і згинатися.
При цьому створюється можливість для
взаємодії карбонільної та однієї з
віддалених гідроксильних груп. Це
приводить до одержання циклічних
внутрішньомолекулярних напівацеталів,
які можна розглядати як похідні
кисневмісних гетероциклів: п’ятичленного
– фурану і шестичленного – пірану.
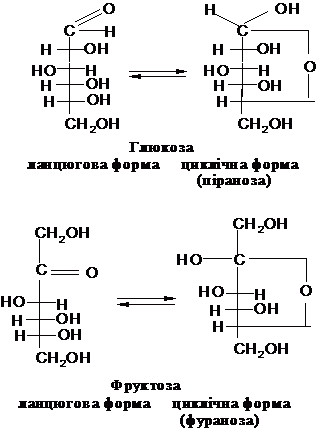
Атом
карбону напівацетальноі групи -
асиметричний. Отже, циклічні форми
вуглеводів мають на один асиметричний
атом карбону більше, ніж ланцюгові і,
відповідно, два додаткових оптичних
ізомери, які позначають a- і b-. Циклічні
форми зручно зображати за допомогою
перспективних формул, в яких молекула
розташовується ніби у площині,
перпендикулярній до площини листка.
Якщо в такій формулі глікозидний
гідроксил розташований під площиною
кільця, то це a-форма, якщо над площиною
- b-форма. Шестичленний цикл називається
піранозним, а п'ятичленний - фуранозним,
по аналогії з відповідними
гетероциклами:
 a-D-глюкопіраноза
b-D-глюкопіраноза
a-D-глюкопіраноза
b-D-глюкопіраноза
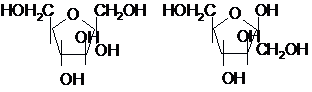 a-D-фруктофураноза
b-D-фруктофураноза
a-D-фруктофураноза
b-D-фруктофураноза
Ще більш точне уявлення про дійсну структуру молекул вуглеводів дають зображення їх конформацій, які також будують за певними правилами. Так піранозне кільце може приймати дві стійкі конформації – крісла і човна. Один із замісників біля атома карбону займає екваторіальне положення (е), близьке до площини кільця, а інший – аксіальне (а), близьке до перпендикулярного до площини кільця:
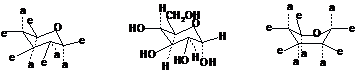 Крісло
a-D-глюкопіраноза
Човен
Крісло
a-D-глюкопіраноза
Човен
У
кристалічному вигляді циклічні форми
вуглеводів стабільні, але у водному
розчині вони знаходяться в динамічній
рівновазі між собою та ланцюговою
формою, тобто є таутомерами. Глюкоза в
розчині на 99,8 % знаходиться в циклічних
формах і лише 0,2 % -в ланцюговій. Інші
моносахариди менш циклізовані.
Свіжовиготовлений розчин a-D- чи b-D-форми
глюкози в процесі збереження змінює
оптичну активність, що можна виміряти
за допомогою поляриметра:
b-D
глюкопіраноза U Рівноважна
суміш U a-D –глюкопіраноза
+112,2°
+
52,7°
+ 18,7°
a-D-глюкоза - 36 %
b-D-глюкоза - 64
%
Явище зміни кута повороту площини
поляризації свіжовиготовленими розчинами
цукрів називається мутаротацією. Кут
повороту площини поляризації міняється
до тих пір, поки не наступить стан
рівноваги між різними формами
моносахариду.
Фізичні
та хімічні властивості
Моносахариди
представляють собою безбарвні кристалічні
тверді речовини, солодкі на смак, добре
розчинні у воді. Вони вступають у різні
реакції, властиві для карбонільної та
поліоксигруп. Розглянемо ті з них, які
мають важливе значення для їх біологічної
функції.
При окисненні слабким окисником
в нейтральному або слабокислому
середовищі у альдогексоз окиснюється
лише альдегідна група, що приводить до
утворення альдонових кислот. Дана
реакція може використовуватись як
якісна для виявлення альдегідоспиртів
в присутності кетоспиртів. Глюконова
кислота є природним продуктом обміну
речовин, а її сіль - глюконат кальцію
застосовується як медичний препарат.
При
дії енергійного окисника в кислому
середовищі (концентрованої азотної
кислоти) одночасно з альдегідною групою
окиснюється також первинна гідроксильна
група на протилежному кінці вуглецевого
ланцюга і утворюється альдарова
кислота.
В певних умовах, зокрема при
дії ферментів в організмі, альдогексози
окиснюються до уронових кислот:
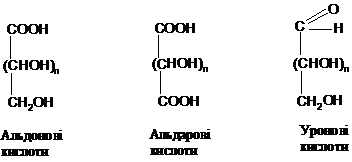 У
більшості хребетних зв’язування
(кон’югація) з глюкуроновою кислотою
є найбільш важливим шляхом знешкодження
токсичних речовин.
Важливими окисненими
похідними моносахаридів в організмі є
сіалові кислоти: мурамова і нейрамінова,
які містять дев’ять атомів карбону:
У
більшості хребетних зв’язування
(кон’югація) з глюкуроновою кислотою
є найбільш важливим шляхом знешкодження
токсичних речовин.
Важливими окисненими
похідними моносахаридів в організмі є
сіалові кислоти: мурамова і нейрамінова,
які містять дев’ять атомів карбону:
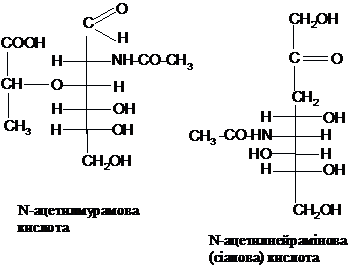
Окиснення
моносахаридів аміачним розчином оксиду
аргентума або гідроксидом купрума при
нагріванні відбувається дуже легко.
При цьому в лужному середовищі вуглецевий
ланцюг частково руйнується. Тому ці
реакції властиві не лише для альдоз,
але і для кетоз.
Моносахариди
відновлюються до багатоатомних спиртів
гідрогеном в присутності
каталізатора:
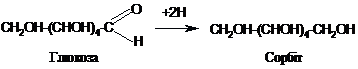 Шестиатомний
спирт сорбіт використовується як
замінник цукру для хворих на
діабет.
Моносахариди, як багатоатомні
спирти, утворюють розчинні комплекси
з гідроксидами кальцію і купруму. За
рахунок гідроксильних груп моносахариди
утворюють сполуки типу етерів, причому
глікозидний гідроксил відрізняється
від інших вищою реакційною здатністю.
Похідні, в яких гідроген в глікозидному
гідроксилі заміщений на радикал,
називають глікозидами:
Шестиатомний
спирт сорбіт використовується як
замінник цукру для хворих на
діабет.
Моносахариди, як багатоатомні
спирти, утворюють розчинні комплекси
з гідроксидами кальцію і купруму. За
рахунок гідроксильних груп моносахариди
утворюють сполуки типу етерів, причому
глікозидний гідроксил відрізняється
від інших вищою реакційною здатністю.
Похідні, в яких гідроген в глікозидному
гідроксилі заміщений на радикал,
називають глікозидами:
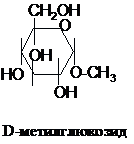 На
відміну від етерів глікозиди легко
гідролізуються в присутності кислот
або ферментів.
Глікозиди часто
зустрічаються в живій природі. Це
високоактивні речовини. До них належать
рослинний індикан, з якого вироблявся
фарбник індиго, дигитоксин, який
використовується для стимуляції
серцевого м'яза, антибіотики, такі як
стрептоміцин, цереброзиди нервової
тканини тварин. Глікозидний зв’язок
існує і в нуклеотидах між залишками
пентози і азотистої основи.
В
жорстких умовах етери утворюють і
спиртові гідроксильні групи. Ці зв’язки
більш міцні.
Моносахариди здатні
утворювати естери. В живих системах
моносахариди та їх похідні функціонують
у вигляді неповних фосфорнокислих
естерів, наприклад:
На
відміну від етерів глікозиди легко
гідролізуються в присутності кислот
або ферментів.
Глікозиди часто
зустрічаються в живій природі. Це
високоактивні речовини. До них належать
рослинний індикан, з якого вироблявся
фарбник індиго, дигитоксин, який
використовується для стимуляції
серцевого м'яза, антибіотики, такі як
стрептоміцин, цереброзиди нервової
тканини тварин. Глікозидний зв’язок
існує і в нуклеотидах між залишками
пентози і азотистої основи.
В
жорстких умовах етери утворюють і
спиртові гідроксильні групи. Ці зв’язки
більш міцні.
Моносахариди здатні
утворювати естери. В живих системах
моносахариди та їх похідні функціонують
у вигляді неповних фосфорнокислих
естерів, наприклад:
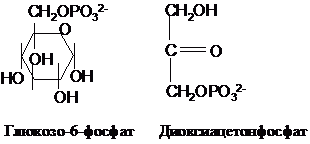 При
взаємодії моносахаридів з амінами
гідроксил заміщується на аміногрупу.
Так, вище згаданий зв’язок в нуклеотидах
є N-глікозидним. В природних вуглеводах
поширені 2-амінопохідні гексоз та їх
N-ацетилпохідні, наприклад:
При
взаємодії моносахаридів з амінами
гідроксил заміщується на аміногрупу.
Так, вище згаданий зв’язок в нуклеотидах
є N-глікозидним. В природних вуглеводах
поширені 2-амінопохідні гексоз та їх
N-ацетилпохідні, наприклад:
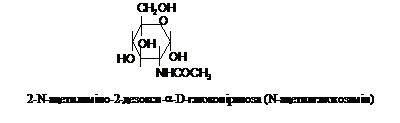 Карбонільні
групи ланцюгових форм моносахаридів
вступають без участі каталізаторів
(неферментативно) в реакції з аміногрупами
білків. Цей процес відбувається в
декілька стадій і приводить до утворення
продуктів з характерним кольором
смаженого м'яса, названих продуктами
Майара на честь біохіміка, який відкрив
їх у 1912 р. Процеси глікозування приводять
у хворих діабетом до порушення згортання
крові, еластичності сполучної тканини
та багатьох інших функцій. Завдяки
продуктам Майара шкіра діабетиків та
людей похилого віку має буруватий
відтінок. Вони утворюють скоринку при
смаженні.
Кетози відрізняють від
альдоз за допомогою реакції Селіванова,
в якій вони значно швидше від альдоз в
кислому середовищі утворюють з резорцином
забарвлені в рожево-червоний колір
продукти. До речі, проміжний продукт
цього процесу - фурфурол, або його
похідні, зумовлюють характерний аромат
свіжовипеченого хліба:
Карбонільні
групи ланцюгових форм моносахаридів
вступають без участі каталізаторів
(неферментативно) в реакції з аміногрупами
білків. Цей процес відбувається в
декілька стадій і приводить до утворення
продуктів з характерним кольором
смаженого м'яса, названих продуктами
Майара на честь біохіміка, який відкрив
їх у 1912 р. Процеси глікозування приводять
у хворих діабетом до порушення згортання
крові, еластичності сполучної тканини
та багатьох інших функцій. Завдяки
продуктам Майара шкіра діабетиків та
людей похилого віку має буруватий
відтінок. Вони утворюють скоринку при
смаженні.
Кетози відрізняють від
альдоз за допомогою реакції Селіванова,
в якій вони значно швидше від альдоз в
кислому середовищі утворюють з резорцином
забарвлені в рожево-червоний колір
продукти. До речі, проміжний продукт
цього процесу - фурфурол, або його
похідні, зумовлюють характерний аромат
свіжовипеченого хліба:
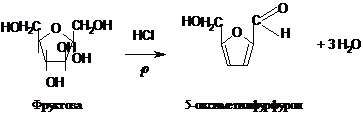 Моносахариди
та їх похідні виконують важливі біологічні
функції. Це перші органічні речовини,
які утворюються з вуглекислого газу в
процесі фотосинтезу. Вони використовуються
як найбільш мобільне джерело енергії,
так як легко вступають в окисно-відновні
перетворення. При повному окисненні
1 г глюкози виділяється біля 17 кДж
енергії. Проте, завдяки високій хімічній
активності, більшість моносахаридів в
живих організмах перебувають не у
вільному стані, а утворює оліго- і
полісахариди, входить до складу
різноманітних біомолекул та надмолекулярних
комплексів: складних ліпідів, нуклеїнових
кислот, глікопротеїнів біомембран. У
вільному стані в тваринному організмі
міститься переважно D-глюкоза, яка є
формою транспорту вуглеводів між
тканинами. Її концентрація в крові
людини становить в нормі 4,4 – 6,0 ммоль/л
крові, або 80 – 120 мг%. У фруктах також
містяться у великих кількостях вільні
глюкоза, фруктоза. Джерелом фруктози є
мед. До складу оліго- і полісахаридів
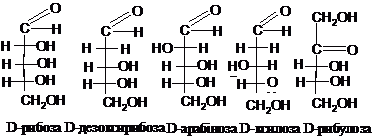
входять пентози D-рибоза, D-дезоксирибоза,
D-арабіноза, D-ксилоза, D-рибулоза, гексози
D-глюкоза, D-маноза, D-галактоза,
D-фруктоза:
Моносахариди
та їх похідні виконують важливі біологічні
функції. Це перші органічні речовини,
які утворюються з вуглекислого газу в
процесі фотосинтезу. Вони використовуються
як найбільш мобільне джерело енергії,
так як легко вступають в окисно-відновні
перетворення. При повному окисненні
1 г глюкози виділяється біля 17 кДж
енергії. Проте, завдяки високій хімічній
активності, більшість моносахаридів в
живих організмах перебувають не у
вільному стані, а утворює оліго- і
полісахариди, входить до складу
різноманітних біомолекул та надмолекулярних
комплексів: складних ліпідів, нуклеїнових
кислот, глікопротеїнів біомембран. У
вільному стані в тваринному організмі
міститься переважно D-глюкоза, яка є
формою транспорту вуглеводів між
тканинами. Її концентрація в крові
людини становить в нормі 4,4 – 6,0 ммоль/л
крові, або 80 – 120 мг%. У фруктах також
містяться у великих кількостях вільні
глюкоза, фруктоза. Джерелом фруктози є
мед. До складу оліго- і полісахаридів
входять пентози D-рибоза, D-дезоксирибоза,
D-арабіноза, D-ксилоза, D-рибулоза, гексози
D-глюкоза, D-маноза, D-галактоза,
D-фруктоза:
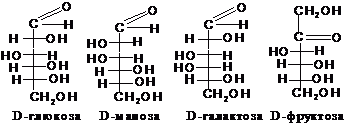
3.2.
Олігосахариди
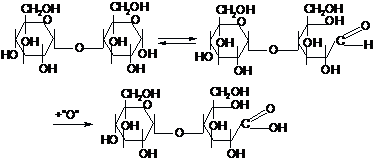
Серед
олігосахаридів найбільш поширеними є
дисахариди. Вони поділяються на дві
групи - відновлюючі та невідновлюючі
залежно від способу сполучення двох
залишків моносахаридів між собою. Якщо
в утворенні зв’язку між моносахаридами
бере участь лише один глікозидний
гідроксил, а другий залишається вільним,
то утворений дисахарид може утворювати
відкриту форму, яка містить карбонільну
групу, і вступати в окисно-відновні
реакції. Такі дисахариди, які мають
вільну глікозидну групу, називаються
відновлюючими:
 До
найбільш важливих дисахаридів
відновлюючого типу належить мальтоза.
Вона є проміжним продуктом обміну
полісахаридів крохмалю та глікогену.
Мальтоза складається з двох залишків
D-глюкози, сполучених зв'язком a-1®4.
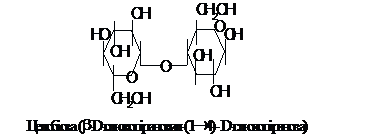
Відновлюючий дисахарид целобіоза є
продуктом обміну целюлози і складається
з двох залишків D-глюкози, з’єднаних
зв'язком b-1®4. Кільця в цій молекулі
повернені по відношенню одне до іншого
на 1800. Лактоза, яка утворюється із
залишків галактози і глюкози із зв'язком
b-1®4 між ними, міститься у молоці ссавців
(2 - 6 %).
Відновлюючі дисахариди:
До
найбільш важливих дисахаридів
відновлюючого типу належить мальтоза.
Вона є проміжним продуктом обміну
полісахаридів крохмалю та глікогену.
Мальтоза складається з двох залишків
D-глюкози, сполучених зв'язком a-1®4.
Відновлюючий дисахарид целобіоза є
продуктом обміну целюлози і складається
з двох залишків D-глюкози, з’єднаних
зв'язком b-1®4. Кільця в цій молекулі
повернені по відношенню одне до іншого
на 1800. Лактоза, яка утворюється із
залишків галактози і глюкози із зв'язком
b-1®4 між ними, міститься у молоці ссавців
(2 - 6 %).
Відновлюючі дисахариди:
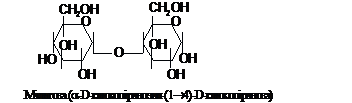
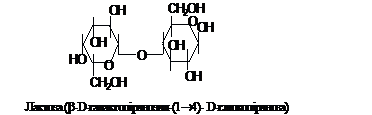
Дисахариди,
які утворюються за рахунок відщеплення
молекули води від глікозидних гідроксилів
обох залишків, не мають вільної глікозидної
групи, а отже і не проявляють окисно-відновних
властивостей. Їх називають невідновлюючими.
Живими організмами вони використовуються
як невеликі гідрофільні і хімічно стійкі
молекули. Вони зв’язують воду, легко в
ній розчиняються і, при цьому, хімічно
не змінюються.
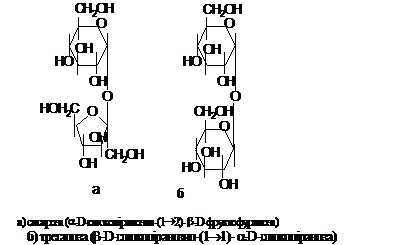
Найбільш відомим
невідновлюючим дисахаридом є сахароза,
яку застосовують у побуті під назвою
цукру. Цей сахарид складається із
залишків D-глюкози і D-фруктози, сполучених
зв'язком 1®2. Сахароза, внаслідок своєї
хімічної інертності, накопичується у
великих кількостях в багатьох рослинах
і служить в них формою транспорту.
Найбільше її міститься в цукровому
буряку і тростині. Невідновлюючий
дисахарид трегалоза міститься в клітинних
стінках спор і бактерій і забезпечує
їх гідратований стан, що сприяє виживанню
в екстремальних умовах.
Невідновлюючі
дисахариди:
3.3.
Полісахариди
Значна
більшість вуглеводів у природі існує
у вигляді високомолекулярних сполук,
які при гідролізі утворюють сотні і
тисячі молекул мономерів. Полімери
можуть бути розгалужені або нерозгалужені.
За складом вони поділяються
нагомополісахариди,
які складаються з однакових ланок,
і гетерополісахариди,
в молекулах яких чергуються різні ланки.
Найчастіше їх мономерами є глюкоза
(глюкопіраноза), залишки якої з’єднані
в нерозгалужених ланцюгах зв'язками
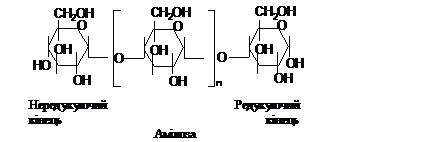
1®4, а в місцях розгалуження ще і 1®6. В
молекулі полісахариду розрізняють
редукуючий кінець, на якому розташований
вільний глікозидний гідроксил, здатний
до окиснення, та нередукуючий протилежний
кінець ланцюга. За біологічними функціями
і, відповідно, властивостями, полісахариди
можна поділити на три типи: запасаючі
(резервні), структурні лінійні та
структурні з’єднуючі.
Запасаючі
полісахариди
Це
внутрішньоклітинні полімери, які служать
енергетичним резервом. При потребі вони
гідролізуються і утворені мономери
використовуються як джерело енергії.
Іх довгі нерозгалужені або розгалужені
ланцюги є гнучкими і спіралізуються,
чому, ймовірно, сприяє човникоподібна
конформація ланок. Спіраль стабілізується
водневими зв’язками. Молекула укладається
більш компактно у клубок, а їх скупчення
утворює гранулу. На поверхні її містяться
гідрофільні групи, отже ці полісахариди
у водному середовищі утворюються
гідрофільні колоїди.
Крохмаль. В
рослинному світі формою запасання
поживних речовин є крохмаль. Це полімер,
утворений a-D-глюкопіранозою. Крохмаль
складається з двох фракцій - амілози і
амілопектину. Амілоза, на долю якої
припадає біля 25 % крохмалю, має молекулярну
масу від 30 тис. до 500 тис. і утворює
нерозгалужені ланцюги із зв'язками
a-1®4:
 Довгі
ланцюги амілози укладаються у спіраль,
на кожен виток якої припадає по 6-7 ланок
(рис. 3.1.)
Якісною реакцією на амілозу
є взаємодія в розчині з йодом, молекули
якого поміщаються у витках спіралі з
утворенням комплексу синьо-фіолетового
кольору. При нагріванні слабкі взаємодії
комплексу руйнуються, спіраль розкручується
і забарвлення зникає, а при охолодженні
структура відтворюється і забарвлення
з'являється знову.
Амілопектин, на
долю якого припадає біля 75 % маси крохмалю,
має молекулярну масу від 100 тис. до 1 млн.
і, на відміну від амілози, - розгалужену
будову із додатковими зв'язками a-1®6 в
точках галуження:
Довгі
ланцюги амілози укладаються у спіраль,
на кожен виток якої припадає по 6-7 ланок
(рис. 3.1.)
Якісною реакцією на амілозу
є взаємодія в розчині з йодом, молекули
якого поміщаються у витках спіралі з
утворенням комплексу синьо-фіолетового
кольору. При нагріванні слабкі взаємодії
комплексу руйнуються, спіраль розкручується
і забарвлення зникає, а при охолодженні
структура відтворюється і забарвлення
з'являється знову.
Амілопектин, на
долю якого припадає біля 75 % маси крохмалю,
має молекулярну масу від 100 тис. до 1 млн.
і, на відміну від амілози, - розгалужену
будову із додатковими зв'язками a-1®6 в
точках галуження: 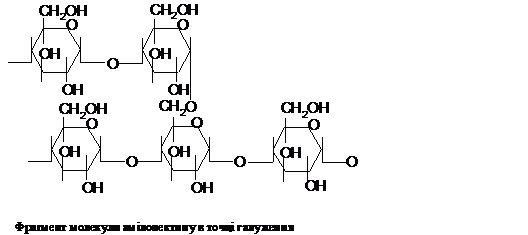 Точки
галуження в амілопектині знаходяться
через 20-30 ланок. При гідролізі амілоза
і амілопектин утворюють коротші фрагменти
- декстрини. Амілопектин і декстрини з
йодом дають червоно-фіолетове
забарвлення.
Глікоген. У
тварин формою відкладення поживних
речовин є глікоген. Особливо багато
його в печінці (до 15%) та м’язах (2 – 4%).
Молекули глікогену нагадують за будовою
амілопектин, але ще більш розгалужені.
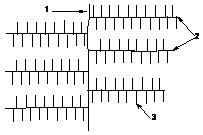
На схемі показано, що розгалужений
полісахарид має один редукуючий кінець
(1), кілька нередукуючих (2). Точки галуження
(3) в глікогені розташовані через кожні
10-15 ланок:
Точки
галуження в амілопектині знаходяться
через 20-30 ланок. При гідролізі амілоза
і амілопектин утворюють коротші фрагменти
- декстрини. Амілопектин і декстрини з
йодом дають червоно-фіолетове
забарвлення.
Глікоген. У
тварин формою відкладення поживних
речовин є глікоген. Особливо багато
його в печінці (до 15%) та м’язах (2 – 4%).
Молекули глікогену нагадують за будовою
амілопектин, але ще більш розгалужені.
На схемі показано, що розгалужений
полісахарид має один редукуючий кінець
(1), кілька нередукуючих (2). Точки галуження
(3) в глікогені розташовані через кожні
10-15 ланок:
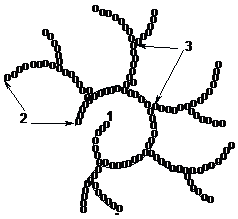 Молекулярна
маса глікогену становить від 270 тис. до
10 млн. Його зерна в тваринних тканинах
значно менші, ніж у крохмалю. Тому він
легко утворює колоїдний розчин, який з
йодом дає червоно-фіолетове забарвлення.
В
рослинах, багатоклітинних водоростях,
бактеріях існують інші резервні
полісахариди, побудовані за подібним
планом, наприклад інулін, який складається
із залишків фруктози, в клубнях топінамбуру
і жоржини, декстран, який, як крохмаль
і глікоген, складається їх залишків
глюкози, але в ньому переважають зв’язки
a-1®6, а в точках розгалуження додатковими
є зв’язки a-1®4.
Структурні
лінійні полісахариди
Ці
полісахариди є позаклітинними. Вони
беруть участь у формуванні клітинних
стінок в якості каркасу. Їх молекули
утворюють довгі нерозгалужені ланцюги,
переважно із зв’язками b-1®4 між ланками.
Вважають, що для них характерна
кріслоподібна конформація ланок, що
сприяє утворенню жорсткої структури,
стабілізованої водневими зв’язками.
Поперечні зшивки забезпечують утворення
міцного волокна (рис. 3.1.)
Такі волокна
лише набухають у воді і не мають
властивостей гідрофільних колоїдів.
Вони можуть витримувати величезні
навантаження. Міцність целюлозних
волокон перевищує міцність стального
дроту того ж діаметру.
Целюлоза (клітковина),
як і крохмаль чи глікоген, складається
з ланок глюкози, однак, на відміну від
них, містить залишки b-D-глюкопіранози.
Тому, при утворенні зв'язків 1®4 між
ланками, вони повертаються по відношенню
одна до другої на 180°, як ми це бачили на
прикладі целобіози. Наявність b-(1®4)
зв'язків у молекулі полімеру і визначає
принципову відмінність його властивостей
та функцій від резервних
полісахаридів:
Молекулярна
маса глікогену становить від 270 тис. до
10 млн. Його зерна в тваринних тканинах
значно менші, ніж у крохмалю. Тому він
легко утворює колоїдний розчин, який з
йодом дає червоно-фіолетове забарвлення.
В
рослинах, багатоклітинних водоростях,
бактеріях існують інші резервні
полісахариди, побудовані за подібним
планом, наприклад інулін, який складається
із залишків фруктози, в клубнях топінамбуру
і жоржини, декстран, який, як крохмаль
і глікоген, складається їх залишків
глюкози, але в ньому переважають зв’язки
a-1®6, а в точках розгалуження додатковими
є зв’язки a-1®4.
Структурні
лінійні полісахариди
Ці
полісахариди є позаклітинними. Вони
беруть участь у формуванні клітинних
стінок в якості каркасу. Їх молекули
утворюють довгі нерозгалужені ланцюги,
переважно із зв’язками b-1®4 між ланками.
Вважають, що для них характерна
кріслоподібна конформація ланок, що
сприяє утворенню жорсткої структури,
стабілізованої водневими зв’язками.
Поперечні зшивки забезпечують утворення
міцного волокна (рис. 3.1.)
Такі волокна
лише набухають у воді і не мають
властивостей гідрофільних колоїдів.
Вони можуть витримувати величезні
навантаження. Міцність целюлозних
волокон перевищує міцність стального
дроту того ж діаметру.
Целюлоза (клітковина),
як і крохмаль чи глікоген, складається
з ланок глюкози, однак, на відміну від
них, містить залишки b-D-глюкопіранози.
Тому, при утворенні зв'язків 1®4 між
ланками, вони повертаються по відношенню
одна до другої на 180°, як ми це бачили на
прикладі целобіози. Наявність b-(1®4)
зв'язків у молекулі полімеру і визначає
принципову відмінність його властивостей
та функцій від резервних
полісахаридів:
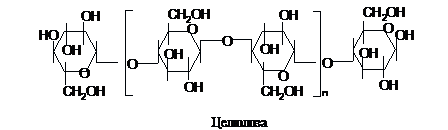 Целюлоза
має молекулярну масу від 100 тис. до 1 млн.
Вона не розчиняється у воді. Завдяки
своїй стійкості це найбільш поширений
в світі біополімер.
Целюлоза виконує
структурну функцію в рослинному світі.
Вона міститься в стінках клітин рослин,
де утворює каркас, який наповнений
іншими молекулами. Деревина на 50%
складається з целюлози, а льон, вовна -
це майже чиста целюлоза.
Крім целюлози
відомі і інші структурні полісахариди.
Міцні нерозчинні панцири багатьох
комах, ракоподібних утворені хітином,
який є полімером N-ацетил-D-глюкозаміну
із зв’язками b-(1®4) між ланками:
Целюлоза
має молекулярну масу від 100 тис. до 1 млн.
Вона не розчиняється у воді. Завдяки
своїй стійкості це найбільш поширений
в світі біополімер.
Целюлоза виконує
структурну функцію в рослинному світі.
Вона міститься в стінках клітин рослин,
де утворює каркас, який наповнений
іншими молекулами. Деревина на 50%
складається з целюлози, а льон, вовна -
це майже чиста целюлоза.
Крім целюлози
відомі і інші структурні полісахариди.
Міцні нерозчинні панцири багатьох
комах, ракоподібних утворені хітином,
який є полімером N-ацетил-D-глюкозаміну
із зв’язками b-(1®4) між ланками:
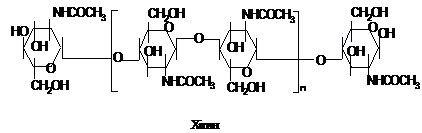 В
плодах рожкового дерева (каратах)
міститься полігалактоманан, який
зумовлює їх виняткову твердість і
постійність маси (0,2 г), з чим пов’язане
використання у давнину каратів як міри
цих якостей.
Складну будову має
структурний полісахарид стінок бактерій
муреїн. В його молекулі чергуються
залишки N-ацетил-D-глюкозаміну (Х) і
N-ацетилмурамової кислоти (Y), з’єднаної
з тетрапептидом (1). Між собою залишки
сполучаються b(1®4)-зв’язками. Ланцюги
з’єднуються між собою за допомогою
поперечних пентапептидних зшивок
(2):
В
плодах рожкового дерева (каратах)
міститься полігалактоманан, який
зумовлює їх виняткову твердість і
постійність маси (0,2 г), з чим пов’язане
використання у давнину каратів як міри
цих якостей.
Складну будову має
структурний полісахарид стінок бактерій
муреїн. В його молекулі чергуються
залишки N-ацетил-D-глюкозаміну (Х) і
N-ацетилмурамової кислоти (Y), з’єднаної
з тетрапептидом (1). Між собою залишки
сполучаються b(1®4)-зв’язками. Ланцюги
з’єднуються між собою за допомогою
поперечних пентапептидних зшивок
(2):
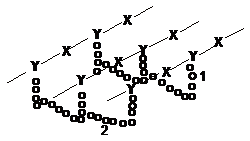 При
дії пеніциліну формування цих зшивок
порушується, що робить клітинну стінку
неповноцінною.
Структурні
з'єднуючі полісахариди
За
хімічною природою полісахариди цієї
групи відрізняються від інших великим
вмістом амінопохідних та кислотних
груп. Їх стара назва – кислі мукополісахариди,
сучасна – глікозаміноглікани. Як
правило, ці полісахариди утворюють
комплекси з білками – протеоглікани,
в яких частка полісахариду в комплексі
складає більше 95%. Глікозаміноглікани
тварин у складі протеогліканів є
міжклітинним цементуючим комплексом,
зокрема у хрящовій і кістковій тканинах,
у рослин заповнюють прошарок між
волокнами целюлози у клітинній стінці.
Завдяки наявності груп, негативно
йонізованих за фізіологічних значень
рН, а також сильно гідратованому стану,
вони забезпечують в’язкість, мастильні
властивості рідин організму, йонізацію
поверхні мембран, її проникність.
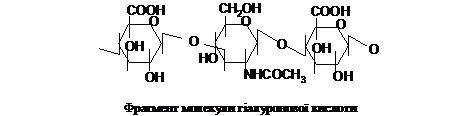
Гіалуронова
кислота входить
до складу основної міжклітинної речовини
тваринних тканин. В її молекулі
повторюються дисахаридні фрагменти,
утворені D-глюкуроновою кислотою і
N-ацетил-D-глюкозаміном, з’єднаними
b(1®3)-зв’язком. Між фрагментами з’єднання
відбувається за допомогою
b(1®4)-зв’язку:
При
дії пеніциліну формування цих зшивок
порушується, що робить клітинну стінку
неповноцінною.
Структурні
з'єднуючі полісахариди
За
хімічною природою полісахариди цієї
групи відрізняються від інших великим
вмістом амінопохідних та кислотних
груп. Їх стара назва – кислі мукополісахариди,
сучасна – глікозаміноглікани. Як
правило, ці полісахариди утворюють
комплекси з білками – протеоглікани,
в яких частка полісахариду в комплексі
складає більше 95%. Глікозаміноглікани
тварин у складі протеогліканів є
міжклітинним цементуючим комплексом,
зокрема у хрящовій і кістковій тканинах,
у рослин заповнюють прошарок між
волокнами целюлози у клітинній стінці.
Завдяки наявності груп, негативно
йонізованих за фізіологічних значень
рН, а також сильно гідратованому стану,
вони забезпечують в’язкість, мастильні
властивості рідин організму, йонізацію
поверхні мембран, її проникність.
Гіалуронова
кислота входить
до складу основної міжклітинної речовини
тваринних тканин. В її молекулі
повторюються дисахаридні фрагменти,
утворені D-глюкуроновою кислотою і
N-ацетил-D-глюкозаміном, з’єднаними
b(1®3)-зв’язком. Між фрагментами з’єднання
відбувається за допомогою
b(1®4)-зв’язку:
 Інший
компонент міжклітинної речовини
– хондроїтинсульфат –
побудований за таким самим принципом,
але замість глюкозаміну містить залишок
галактозамін-4-(або-6-) сульфату:
Інший
компонент міжклітинної речовини
– хондроїтинсульфат –
побудований за таким самим принципом,
але замість глюкозаміну містить залишок
галактозамін-4-(або-6-) сульфату:
 Вважають,
що протеогліканові агрегати в хрящовій
тканині складаються з центральної
великої молекули (Мr 270-500 кД) гіалуронової
кислоти (1), до якої приєднуються
протеогліканові субодиниці, що складаються
з центрального білкового ланцюга (2),
сполученого з чисельними короткими
ланцюгами типу хондроїтинсульфату (Мr
40 – 50 кД) (3):
Вважають,
що протеогліканові агрегати в хрящовій
тканині складаються з центральної
великої молекули (Мr 270-500 кД) гіалуронової
кислоти (1), до якої приєднуються
протеогліканові субодиниці, що складаються
з центрального білкового ланцюга (2),
сполученого з чисельними короткими
ланцюгами типу хондроїтинсульфату (Мr
40 – 50 кД) (3):
 Гепарин синтезується
клітинами печінки, легень і секретується
в кров, де відіграє роль антикоагулянта.
Його молекула (Мr 20 кД) складається із
залишків D-уронової кислоти і D-глюкозаміну,
що сполучаються зв’язками a(1®4) і
сульфатовані здебільшого по аміногрупі
і 6 положенню глюкозаміну і 2 положенню
уронової кислоти:
Гепарин синтезується
клітинами печінки, легень і секретується
в кров, де відіграє роль антикоагулянта.
Його молекула (Мr 20 кД) складається із
залишків D-уронової кислоти і D-глюкозаміну,
що сполучаються зв’язками a(1®4) і
сульфатовані здебільшого по аміногрупі
і 6 положенню глюкозаміну і 2 положенню
уронової кислоти:
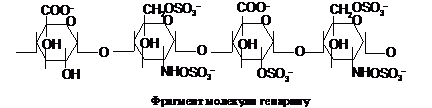 Невеликі
гетеросахаридні фрагменти (від 1 до 30%
маси молекули) входять до складу
гліколіпідів та глікопротеїнів клітинних
мембран. Більшість позаклітинних білків
також містять вуглеводні компоненти
Специфічні олігосахаридні групи
глікопротеїдів на поверхні клітин
вибірково зв’язуються з певними білками
лектинами, що приводить до їх злипання
(аглютинації). Ця взаємодія визначає
сумісність груп крові, тканин донора і
реципієнта при трансплантації, імунну
реакцію на чужерідні молекули.
Невеликі
гетеросахаридні фрагменти (від 1 до 30%
маси молекули) входять до складу
гліколіпідів та глікопротеїнів клітинних
мембран. Більшість позаклітинних білків
також містять вуглеводні компоненти
Специфічні олігосахаридні групи
глікопротеїдів на поверхні клітин
вибірково зв’язуються з певними білками
лектинами, що приводить до їх злипання
(аглютинації). Ця взаємодія визначає
сумісність груп крові, тканин донора і
реципієнта при трансплантації, імунну
реакцію на чужерідні молекули.
