
ФЕНОЛИ
.pdf
ФЕНОЛИ
1.Загальна характеристика одноатомних фенолів.
2.Методи одержання одноатомних фенолів.
3.Хімічні властивості фенолів: утворення фенолятів, етерів, естерів, - р-ції заміщення в бензольному ядрі (галогенами, сульфування,), - гідрування, окислення, - утворення фенол формальдегідних смол.
4.Застосування.
Одноатомні феноли
Одноатомні феноли – похідні бензену і його гомологів, в ядрі яких один атом Гідрогену заміщений на гідроксильну групу:
|
OH |
CH3 |
OH |
|
|
|
CH3 |
бензен |
фенол |
толуен |
2 - метилфенол |
Ізомерія і номенклатура. У найпростішого представника фенолів фенолу (карболової кислоти) ізомерів немає, у його гомологів існує ізомерія положення гідроксильної групи в бензеновому ядрі (о-, м- і я-положення).
Для найменування фенолів використовують три номенклатури – історичну, раціональну та ІЮПАК. За історичною номенклатурою феноли називаються тривіальними назвами– карболова кислота (карболка), крезоли тощо.
За основу раціональної назви фенолів береться найменування гомолога найпростішого представника фенолів, а префікси орто-, мета- і паравказують положення гідроксильної групи в бензеновому ядрі.
При побудові назви фенолів за номенклатурою ІЮПАК атоми Карбону в бензеновому ядрі позначають цифрами 1–6, починаючи з атома Карбону, зв'язаного з групою –ОН. За основу назви береться бензен, ОН-групу називають «окси» і місце її розміщення позначається цифрами (–ОН– старша функція). Наприклад, крезолам, формула яких С6Н4(СН3)ОН, відповідає три сполуки (в дужках наведено найменування за номенклатурою ІЮПАК)
|
|
|
CH3 |
OH |
CH3 |
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
о-крезол |
м-крезол |
|
|
п-крезол |
|
|
|
||||
(1 -окси-2-метилбензен) |
(1 -окси-3-метилбензен) |
(1-окси-4-метилбензен) |
|||||||||
Фенол за номенклатурою ІЮПАК називають гідроксибензеном.
Способи одержання. Одноатомні феноли одержують з природної сировини і синтетичними методами.
1. Природною сировиною для одержання фенолів є кам'яновугільна смола, буковий дьоготь, кісточкова олія тощо.
Ar |
|
OH |
|
|
|
|
|
|
NaOH |
Ar |
|
|
|
ONa |
|
|
|
|
|
|
H2O, |
||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
фенол |
|
|
|
|
|
|
|
|
фенолят натрію |
||||||||||||||
Ar |
|
|
ONa |
|
|
|
|
|
HOSO3H |
Ar |
|
|
|
OH |
|
|
|
|
|
NaHSO4. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
2. Спосіб Рашіга. Бензен хлорують за допомогою хлороводню і повітря, потім, не виділяючи утвореного хлорбензену, гідролізують водяною парою:
C6H6 |
|
|
|
|
0,5O2 |
|
|
|
|
HCl 200 C C6H5Cl |
|
|
|
H2O |
||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
C6H5Cl 500 C |
C6H5OH |
|
|
|
HCl |
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
солі Сu |
|
|
|
|
|
|
|
||||||
3. Кумельний спосіб. Вихідною речовиною є кумен (ізопропіл-бензен) С6Н6СН(СН3)2. Його одержують, алкілуючи бензен пропіленом (каталізатор А1С13). Крім фенолу, за допомогою цього способу одержують ацетон, що вигідно для виробництва. Кумен окиснюють киснем повітря, а утворений після цього гідропероксид кумену розкладають сульфатною кислотою:
CH3 |
CH3 |
|
|
|
|
|
|
|
O |
CH CH3 |
C CH |
|
|
OH |
O2 |
3 |
H2SO4 |
|
|
|
|
CH3 C CH3 |
||
|
OOH |
|
|
|
|
|
|
|
|
кумен |
куменгідропероксид |
фенол |
ацетон |
|
4. Одержання з ароматичних сульфосолей – один з найбільш поширених синтетичних способів одержання фенолів. Вихідною сировиною є натрієві або калієві солі сульфокислот. Утворюються феноляти, які піддають дії мінеральних кислот і одержують вільні феноли:
C6H5 |
|
SO3Na |
|
|
|
2NaOH |
C H ONa |
|
|
|
Na SO |
|
|
|
H O |
||
|
|
|
|
|
|
|
6 |
5 |
|
2 |
3 |
|
|
2 |
|||
2C6H5ONa  SO2
SO2  H2O
H2O  2C6H5OH
2C6H5OH  Na2SO3.
Na2SO3.
Фізичні властивості. Феноли – тверді кристалічні речовини зі специфічним запахом, важкорозчинні у воді, утворюють з нею кристалогідрати, температура плавлення яких нижча, ніж у вихідних фенолів. Добре розчиняються в органічних розчинниках, слабокислі. Фізичні властивості змінюються залежно від зміни молекулярної маси фенолів.
Хімічні властивості. Хімічні властивості фенолів визначають наявність гідроксильної групи в бензеновому ядрі та їх взаємовплив. Феноли можуть вступати в хімічні реакції, характерні для спиртів (утворення фенолятів, або феноксидів, етерів і ес-терів, галогенопохідних тощо), а також аренів: реакції заміщення атомів Гідрогену в бензеновому ядрі на галогени, нітрог-рупу,

сульфогрупу тощо. Разом з цим у фенолів більш сильні кислотні властивості, ніж у спиртів. Тому вони можуть взаємодіяти не тільки з металічним Натрієм або Калієм, але й з лугами.
В молекулі фенолу гідроксил має позитивний і негативний мезомерні ефекти. Причому позитивний мезомерний ефект більший за негативни. Гідроксил виступає електронодонором по відношенню до радикала (в даному випадку фенілу). Внаслідок зсуву пари електронів від атома Оксигену до атома Карбону бензенового ядра атом Оксигену, намагаючись компенсувати свій заряд, притягує до себе електронну густину зв'язку О–Н. Це призводить до підвищення полярності зв'язку С–Н і
 O H
O H  O
O
H
збільшення рухливості атома Гідрогену гідроксилу, що і обумовлює кислотні властивості фенолів:
Таким зміщенням електронів в фенолят-йоні пояснюється його підвищена стійкість. При зміщенні електронів електронна густина в бензеновому ядрі перерозподіляється: вона підвищена в положеннях 2-, 4- і 6-, де і відбувається заміщення атомів Гідрогену.
Хімічні властивості фенолів.
1. Взаємодія фенолів з лугами призводить до утворення стійких хімічних сполук – фенолятів, або феноксидів:
C6H5OH |
|
|
|
NaOH |
C6H5ONa |
|
|
|
H2O |
|
|
|
|
|
|
2. Утворення етерів. Наявність у фенолів позитивного мезомерного ефекту (+М) обумовлює їх нуклеофільні властивості, які значно менше виражені, ніж у спиртів.
C6H5ONa |
+ CH3Br |
C6H5OCH3 + NaBr |
феноксид |
бромметан |
метилфеніловий етер |
натрію |
|
|
|
|
3. Утворення естерів відбувається при взаємодії фенолів з хлорангідридами або ангідридами карбонових кислот.
|
|
|
O |
|
|
|
|
|
|
|
|
C6H5ONa + CH3 |
|
C |
C6H5O |
|
|
C |
|
|
CH3 + NaCl |
||
|
|
|
|
|
|||||||
|
|
|
Cl |
|
|
|
|
|
|
|
|
хлорангідрид |
|
|
|
|
|
|
O |
|
|||
ацетатної к-ти |
|
|
|
|
|
|
|
||||
|
|
|
фенілетаноат |
|
|||||||
|
|
|
|
|
|||||||
4. Реакції заміщення в бензоновому ядрі. Гідроксильна група в бензеновому ядрі проявляє +М-ефект і є орієнтантом І роду. Вона – електронодонор для бензенового кільця. Це дозволяє їй спрямовувати атаку електрофільних реагентів в орто- і пара-положеннях. Феноли вступають в реакції електрофільного заміщення значно легше, ніж арени, що і дозволяє одержувати з них низку цінних продуктів органічного синтезу.
а) Заміщення галогенами. При дії на феноли галогенів утворюються їх галогенопохідні. Бромування фенолів використовують при фармацевтичному аналізі:
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
C |
|
|
Br |
C |
Br |
|
|
|
|
|||
|
|
|
|
|
||
HC |
CH |
|
|
C |
|
C |
|
|
3Br2 |
|
|
||
|
|
+ |
|
|
+ 3HBr |
|
HC |
CH |
|
|
CH |
|
CH |
|
CH |
|
|
|
C |
|
|
|
|
|
|
|
фенол |
|
|
|
Br |
|||
|
|||
|
2, 4, 6-трибромфенол |
||
2,4,6-Трибромфенол погано розчиняється у воді і випадає в осад, що дозволяє використовувати дану реакцію для виявлення фенолів у розчинах.
б) Нітрування. При дії на фенол 20%-ї нітратної кислоти утворюється суміш о- і п-нітрофенолів, які розділяють перегонкою з водяною парою (о- нітрофенол відганяється, а п-нітрофенол залишається у розчині):
OH |
|
|
|
|
|
OH |
|
OH |
OH |
O2N |
NO2 |
|
NO2 |
|
|
HNO3 |
|
|
|
|
HNO3 |
+ |
|
|
|
|
|
||
|
|
|
|
|
NO2 |
фенол |
о нітрофенол |
NO2 |
|
пікринова к- та |
|
|
||
|
n |
нітрофенол |
||
|
|
|
||
При нітруванні фенолу концентрованою нітратною кислотою утворюється 2,4,6-тринітрофенол, або пікринова кислота:
|
OH |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
CH |
NO2C |
|
C |
|
|
|
NO2 |
|
||||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
C |
|
|||||||||||||||
|
|
|
|
|
|
|
3HO |
|
NO2 |
|
|
|
3H2O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
HC |
CH |
HC |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
CH |
|
||||||||||||||||||
|
CH |
|
|
|
|
|
|
|
|
|
C |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
фенол |
|
|
|
|
|
|
|
пікринова кислота |
|
||||||||||||
Пікринова кислота – кристалічна речовина жовтого кольору, гірка на смак, плавиться при 122 °С, при перегріванні вибухає. Застосовують для фарбування тканин у текстильній промисловості, виготовлення вибухових речовин (фугасних бомб), лікування опіків (в медицині, ветеринарії), як сировину для одержання хлорпікрину (засобу для боротьби із шкідниками сільськогосподарських культур).
в) Сульфування. Фенол може взаємодіяти з концентрованою сульфатною кислотою. Змінюючи умови хімічної реакції (наприклад, температуру), можна одержати переважно ортоабо пара-ізомери. Відповідно до правил ІЮПАК сульфогрупа вважається «старшою» за гідроксильну, тому продукти реакції називають сульфокислотами, а не сульфофенолами:
OH |
|
OH |
OH |
H2SO4 |
|
|
|
|
H2SO4 |
|
|
|
|
|
|
HO3S |
фенол |
|
SO3H |
|
2-гідроксибен- |
||
4-гідроксибен- |
|
|
|
зенсульфокислота |
|
|
зенсульфокислота |
5. Гідрування (гідрогенізація). При нагріванні та в присутності певних каталізаторів феноли можуть приєднувати молекулярний водень, перетворюючись на спирти циклопарафінового ряду:
OH |
OH |
3H2/Ni
170 C
фенол |
циклогексанол |
Циклогексанол (циклогексиловий спирт, гексагідрофенол) – тверда речовина, плавиться при 25,15 °С, при окисненні перетворюється на циклогексанон або пентадіолову кислоту, які застосовують у виробництві синтетичних волокон капрону, нейлону. Циклогексанол – добрий органічний розчинник для масел та олій, восків і полімерів, барвників і реактивів, гомогенізуючий засіб для дезинфекційних сумішей. У великих дозах діє як наркотик.
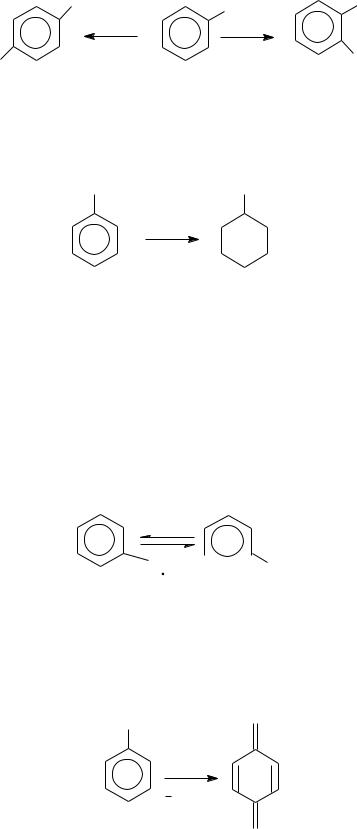
6. Окиснення. Феноли легко окиснюються навіть киснем повітря. При цьому їх забарвлення змінюється: вони стають рожевими, червонуваторожевими або темними. Процес окиснення протікає у декілька стадій.
O 
 O
O
Такі радикали нестійкі. Вони вступають в різні хімічні реакції, в т. ч. утворення димерів і полімерів. При інтенсивному окисненні фенолів сильними реагентами (наприклад, хромовою сумішшю) окиснюються гідроксил і Гідроген бензенового ядра в пара-положенні з утворенням бензохінону, а при більш глибокому окисненні – і продукти розщеплення бензенового ядра:
OH |
O |
O
H2O
фенол
O
бензохінон
7'. Утворення комплексних солей. Такі солі найчастіше феноли утворюють з хлоридом феруму (III). Якщо до розбавленого водного або

спиртового розчину фенолу додати декілька крапель розчину FеС13, виникає синьо-фіолетове забарвлення як наслідок утворення комплексної солі:
|
H |
|
H5C6 |
|
|
|
H |
||
|
|
|
|||||||
|
|
|
|
|
|
|
|
||
6C6H5OH + FeCl3 3HCl |
|
O OC6H5 O |
|
C6H5 |
|||||
|
|||||||||
|
|
||||||||
|
|
|
|
|
|||||
|
C6H5O |
Fe OC6H5 |
|||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|||||
|
|
|
H |
|
C6H5 |
||||
Реакція використовується в хімічному аналізі для виявлення в розчинах фенолу.
8. Утворення фенолформальдегідних смол. Такі смоли утворюються при взаємодії фенолу з формальдегідом. Смолисті продукти реакції отримали назву «бакеліти». Механізм утворення їх складний. Схематично його можна уявити так:
|
|
|
|
OH |
OH |
|
|
|
CH2OH |
|
|
|
|
|
|
|
O |
|
|
2 |
2H |
C |
о |
|
|
|
H |
оксибензиловий спирт |
|
фенол |
|
|
OH |
|
|
|
|
CH2OH
n оксибензиловий спирт
Димери конденсуються і утворюють складну сітчасту структуру, в якій оксифенільні залишки з'єднуються між собою метиленовими містками.
Фенолформальдегідні смоли найчастіше використовують разом з іншими матеріалами (наповнювачами). До таких наповнювачів належать деревне борошно (фенопластакарболіт), бавовнянопаперова тканина (текстоліт), папір (гетинакс), скляне волокно (склотекстоліт) тощо. Смоли широко використовують в машинобудівній промисловості, будівництві, при виготовленні лаків (іноді їх називають новолачними полімерами, або смолами) тощо.
3. Виконання експериментальної роботи
Дослід . Властивості фенолу
а) Розчинність фенолу у воді та його кислий характер
У пробірку вміщують 1 г кристалічного фенолу і наливають 4-5 мл води. При струшуванні фенол частково розчиняється. При стоянні утворюються 2 шари: нижній шар – фенол, верхній – розчин фенолу у воді.
При обережному нагріванні фенол повністю розчиняється, і суміш перетворюється в однорідну рідину, оскільки з підвищенням температури розчинність фенолу збільшується, й вище від 68о С він змішується з водою в усіх співвідношеннях. При охолодженні рідина знову розшаровується, і фенол виділяється на дні пробірки у вигляді червонуватої рідини.
В одержаний водний розчин фенолу опускають лакмусовий папірець.
Висновки, спостереження______________________________________
б) Одержання феноляту натрію
Вміст пробірки з попереднього досліду перемішують до утворення емульсії і додають по краплях 10%-ий розчин NaOH.
Висновки, |
спостереження______________________________________ |
До розчину феноляту натрію додають 10%-ий розчин HCl. |
|
Висновки, |
спостереження_____________________________________ |
в) Взаємодія фенолу з хлоридом заліза (ІІІ)
У пробірку наливають 1 мл 2%-го розчину фенолу і додають 1-2 краплі 2%-го розчину FeCl3 .
Висновки, спостереження_____________________________________
г) Бромування фенолу
У пробірку вміщують 1 мл 2%-го розчину фенолу і при струшуванні по краплях додають бромну воду до утворення білого осаду 2,4,6- трибромфенолу.
Висновки, спостереження____________________________________
д) Окиснення фенолу
У пробірку наливають 2 мл 2%-го розчину фенолу і стільки ж 10%-го розчину Na2CO3 , а далі по краплях додають 0,5 мл 1%-го розчину KMnO4 .
Висновки, спостереження____________________________________
