
Лекция 9. Распределения Максвелла и Больцмана. Явления переноса
[1] гл.8, §43-48
План лекции:
-
Закон Максвелла о распределении молекул по скоростям. Характерные скорости молекул.
-
Распределение Больцмана.
-
Средняя длина свободного пробега молекул.
-
Явления переноса:
а).диффузия;
б).внутреннее трение (вязкость);
в).теплопроводность.
-
Закон Максвелла о распределении молекул по скоростям. Характерные скорости молекул.
Молекулы
газа движутся хаотически и в результате
столкновений скорости их меняются по
величине и направлению
в газе имеются молекулы как с очень
большими, так и с очень малыми скоростями.
Можно поставить вопрос о числе молекул,
скорости которых лежат в интервале от
![]() и
и
![]() для газа в состоянии термодинамического
равновесия в отсутствии внешних силовых
полей. В этом случае устанавливается
некоторое стационарное, не меняющееся
со временем распределение молекул по
скоростям , которое подчиняется
статистическому закону , теоретически
выведенному Максвеллом.
для газа в состоянии термодинамического
равновесия в отсутствии внешних силовых
полей. В этом случае устанавливается
некоторое стационарное, не меняющееся
со временем распределение молекул по
скоростям , которое подчиняется
статистическому закону , теоретически
выведенному Максвеллом.
Чем
больше общее число молекул N,
тем большее число молекул N
будет обладать скоростями в интервале
от
![]() и
и
![]() ;чем
больше интервал скоростей
;чем
больше интервал скоростей
![]() ,
тем у большего числа молекул
,
тем у большего числа молекул
![]() значение скоростей будет лежать в
указанном интервале.
значение скоростей будет лежать в
указанном интервале.
![]() ~
~
![]()
Введем коэффициент пропорциональности f(.
![]() ,
,
где f( называется функцией распределения, которая зависит от скорости молекул и характеризует распределение молекул по скоростям.
Если
вид функции
![]() известен, можно найти число молекул
известен, можно найти число молекул
![]() ,
скорости которых лежат в интервале от
,
скорости которых лежат в интервале от
![]() до
до
![]() .
.
С помощью
методов теории вероятности и законов
статистики Максвелл в 1860г. теоретически
получил формулу, определяющую число
молекул
![]() ,
обладающих скоростями в интервале от
,
обладающих скоростями в интервале от
![]() до
до
![]() .
.
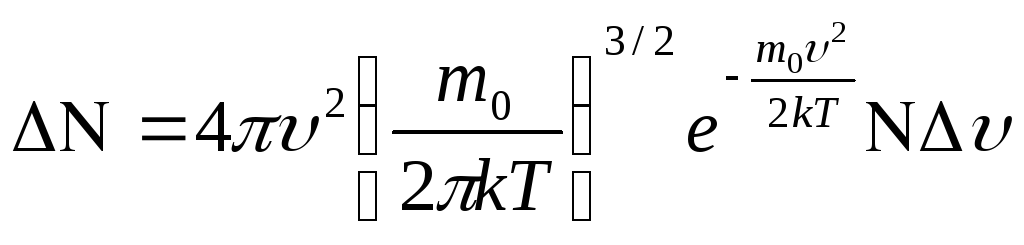 , (2)
, (2)
![]()
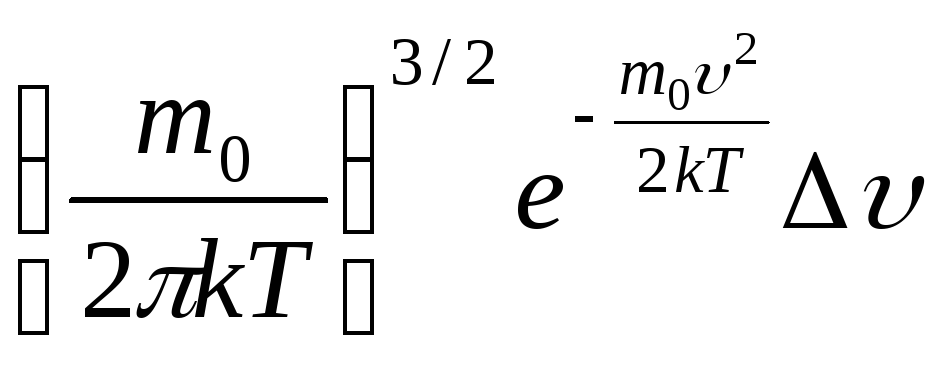 -
распределение Максвелла показывает,
какая доля
-
распределение Максвелла показывает,
какая доля
![]() общего числа молекул данного газа
обладает скоростями в интервале от
общего числа молекул данного газа
обладает скоростями в интервале от
![]() до
до
![]() .
.
Из
уравнений
и
следует вид функции
![]()
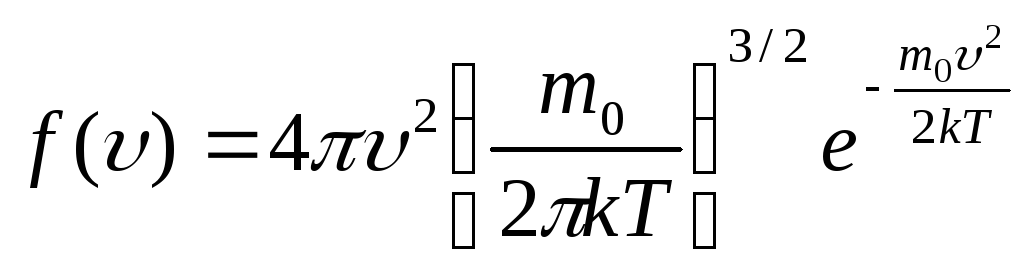 -
(3)
-
(3)
функция распределения молекул идеального газа по скоростям.
Из (3)
видно, что конкретный вид функции
![]() зависит от рода газа (от массы молекулы
m0)
и температуры.
зависит от рода газа (от массы молекулы
m0)
и температуры.
Наиболее часто закон распределения молекул по скоростям записывают в виде:
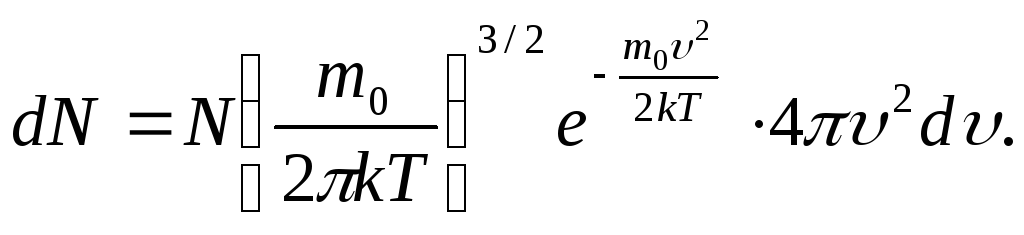
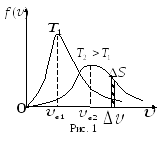
График
функции
![]() асимметричен (рис. 1). Положение максимума
характеризует наиболее часто встречающуюся
скорость, которая называется наиболее
вероятной. Скорости, превышающие в,
встречаются чаще, чем меньшие скорости.
асимметричен (рис. 1). Положение максимума
характеризует наиболее часто встречающуюся
скорость, которая называется наиболее
вероятной. Скорости, превышающие в,
встречаются чаще, чем меньшие скорости.
![]() - доля
общего числа молекул, обладающих
скоростями в этом интервале.
- доля
общего числа молекул, обладающих
скоростями в этом интервале.
Sобщ.= 1.
С повышением температуры максимум распределения сдвигается в сторону больших скоростей, а кривая становится более пологой, однако площадь под кривой не изменяется, т.к. Sобщ.= 1.
Наиболее вероятной называют скорость, близкой к которой оказываются скорости большинства молекул данного газа.
Для её
определения исследуем
![]() на максимум.
на максимум.
![]() ,
4
,
4 ,
,
![]() ,
,
![]() .
.
![]() ,
, ![]() .
.
Ранее было показано, что
![]() ,
,
![]() ,
,
![]()
![]()
![]() .
.
В МКТ используют также понятие средней арифметической скорости поступательного движения молекул идеального газа.
![]()
 - равна
отношению суммы модулей скоростей всех
молекул к
- равна
отношению суммы модулей скоростей всех
молекул к
числу молекул.
![]() .
.
Из сравнения видно (рис.2), что наименьшей является в.
