- •Методы микробиологической диагностики инфекционных заболеваний
- •1. Выделение чистых культур патогенных клостридий
- •2. Причины высокой чувствительности строгих анаэробов к кислороду объясняют следующими обстоятельствами:
- •Результаты посева на среды Плоскирева, Эндо, мпа
- •3. Вопросы к итоговому контролю по теме «Морфология и физиология бактерий».
- •Краткая характеристика основных санитарно-показательных микроорганизмов продуктов питания
- •Правила и техника взятия смывов для санитарно-бактериологических исследований на объектах питания
- •Регистрация чувствительности к антибиотикам выделенной культуры стафилококка
- •Механизм действия антибиотиков
- •Лекарственная устойчивость бактерий
- •Биохимические основы антибиотикорезистентности
- •Определение действия фактора проникновения по распространению краски в коже кролика
- •Определение гемотоксина (на мпа с кровью)
- •Результаты реакции агглютинации
- •Результаты опыта рск
- •Классификация диагностических серологических реакций по природе антигена, технике постановки и механизму протекания
- •Краткая общая схема иммунного ответа и кооперативного взаимодействия макрофагов, т- и в – лимфоцитов.
- •Вопросы к итоговому занятию «Инфекция и иммунитет»
З А Н Я Т И Е 1
Дата ______________
Тема: Правила работы в микробиологической лаборатории. Микроскопический метод диагностики инфекционных заболеваний. Методы микроскопии. Основные формы бактерий.
План занятия:
1. Знакомство с рабочим местом и режимом работы в микробиологической лаборатории.
2. Знакомство с иммерсионным микроскопом и правилами работы с ним.
3. Упражнение в микроскопии на готовых препаратах с применением сухих и иммерсион-ной систем.
4. Правила обращения с культурами микробов.
5. Приготовление препарата "раздавленная капля".
6. Приготовление и окраска препарата тушью по Бурри (негативный способ окраски).
7. Основные формы бактерий.
8.Специальные методы микроскопии (люминесцентная, темнопольная, фазовоконтрастная микроскопия, электронная микроскопия – см. приложение).
Методические указания
1.1. Оборудование рабочего места.
На рабочем столе должно быть все необходимое для работы: микроскоп, иммерсионное масло, бактериологическая петля, спиртовка, набор красок, промывалка и ванна для промывки препаратов, предметные стекла и салфетки для протирания их, штатив для пробирок с культурами, пинцет, фильтровальная бумага для высушивания препаратов и банка для отработанных стекол.
Из личных вещей студента на рабочем месте допускается иметь только рабочую тетрадь, в которой делают записи и зарисовки. Ничего лишнего (в том числе учебников и других книг) на рабочем столе не должно быть.
1.2. Режим работы в бактериологической лаборатории.
Работа с болезнетворными микробами требует обязательного соблюдения ряда правил личной и общественной профилактики. Каждый студент обязан работать в халате, на голову надевать шапочку или косынку, не курить и не принимать пищу в лаборатории, избегать суеты. По окончании работы необходимо вымыть руки с мылом.
2.Важнейшей характеристикой каждого объектива микроскопа является его разрешающаяся способность. Разрешающей способностью называется расстояние между двумя точками, при котором они еще видны раздельно (т.е. не сливаются в одну). Разрешающая способность объектива ограничивается такими недостатками оптической системы, как сферическая и хроматическая аберрации ,дифракция и т.д. Если первые два явления устранимы, то явление дифракции имеет место в любой оптической системе. Оно ограничивает разрешающую способность оптических систем. Разрешающая способность объектива с учетом явлений дифракции описывается следующей формулой:
А = 0,61
![]() ,
,
где А - минимальное расстояние между двумя точками объекта (разрешающая способность);
n - показатель преломления среды между препаратом и фронтальной линзой объектива (в случае масляной иммерсии n=1,51);
α- угол между оптической осью объектива и наиболее крайним лучом, попадающим в объектив из центра препарата;
λ- длина световой волны;
0,61 - коэффициент, который учитывает геометрические факторы при вычислении освещенности первого дифракционного максимума от круглого отверстия.
Величина n·Sinα постоянна для каждого объектива и называется числовой, или нумерической, апертурой. Она выгравирована на оправе объектива. В монобромнафталиновых иммерсионных объективах нумерическая апертура может варьировать в пределах от 1,25 до 1,60. При наличии воздуха между фронтальной линзой и покровным стеклом нумерическая апертура не превышает 0,95.
|
|
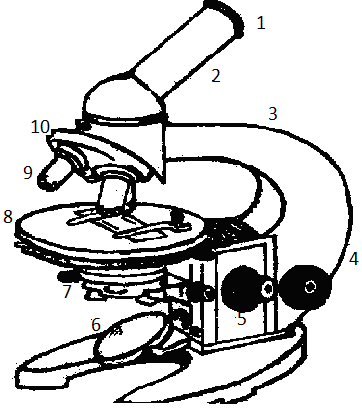
Микроскоп. Обозначения: 1 - окуляр; 2 - тубус; 3 – штатив (колонка и ножка); 4-макрометрический винт; 5- микрометрический винт; 6- зеркало; 7 - конденсор; 8- предметный столик; 9- объектив; 10 – револьвер.
|
Из приведенной выше формулы видно, что разрешающая способность объектива прямо пропорциональная его числовой апертуре и обратно пропорциональна длине волны света, используемого при микроскопии. При микроскопии в видимом свете с длиной волны порядка 0,55 микрона и иммерсионным объективом с максимальной нумерической апертурой 1,60 разрешающая способность равна:
А = 0,61![]()
Величина угла, при котором глаз способен различать раздельно две точки, называется углом резкого зрения. Для получения на сетчатке раздельного изображения двух точек световые лучи должны попасть в глаз под углом зрения, который стягивает дугу от 2 до 4 минут.
Изображение структур, разрешенных объективом, может быть увеличено окуляром лишь настолько, чтобы оно просматривалось под углом, стягивающим дугу величиной от 2 до 4 минут. Это - полезное увеличение микроскопа. Полезное увеличение микроскопа не может превышать числовую апертуру более чем в 1000 раз. Поэтому максимальное полезное увеличение для микроскопов, имеющих иммерсионные объективы с апертурой 1,4-1,6, составляет 1400-1600. Применение в таких микроскопах более сильных окуляров никаких дополнительных деталей к структуре препарата, разрешаемой объективом, не выявляет.
Для полного использования разрешающей способности иммерсионного объектива необходимо выполнять следующие основные правила:
1)Конденсор осветительного аппарата должен быть поднят до отказа (до уровня предметного столика).
2)Диафрагма конденсора должна быть полностью открыта.
3)Во всех без исключения случаях работа ведется с плоским зеркалом, так как конденсор рассчитан на работу с параллельными пучками света.
Наряду с увеличением и нумерической апертурой одной из важных характеристик объектива является его свободное рабочее расстояние, т.е. расстояние между верхней поверхностью препарата и нижней поверхностью фронтальной линзы объектива при наведенном на фокус объективе. Эти расстояния следующие:
для объектива с увеличением 8× - 8,5 мм;
для объектива с увеличением 40× - 0,4 мм;
для объектива с увеличением 90× - 0,2 мм.
Знание этих расстояний необходимо для того, чтобы быстро сфокусировать микроскоп на препарате. Кроме того, чтобы правильно и быстро установить освещение, необходимо, чтобы объектив находился от препарата на свободном рабочем расстоянии.
Порядок работы с микроскопом
1.Проверить состояние осветительного аппарата (поднять конденсор, открыть его диафрагму, поставить плоское зеркало).
2.Положить на столик микроскопа исследуемый препарат (дрожжи, окрашенные фуксином) и поставить слабый сухой объектив (8×) на расстояние несколько меньше свободного рабочего расстояния (для данного объектива 5-7 мм).
3. Глядя в окуляр и вращая зеркалом, произвести предварительную установку освещения,
4. Медленно поднимая тубус макровинтом, добиться резкого изображения препарата. При использовании слабого сухого объектива в поле зрения, кроме препарата, может быть видно изображение источника света, т.е. оконной рамы и других предметов, находящихся за окном.
5.Движением зеркала поставить в центре поля зрения наиболее светлый участок оконной рамы (например, участок неба с облаками), после чего можно переходить на микроскопию с сильным сухим или иммерсионным объективами. При этом мешающие детали исчезают из поля зрения, Если этого не происходит, то следует осторожно приподнять или опустить конденсор на 1-1,5 мм.
6.Поставив сильный сухой или иммерсионный объектив, ни в коем случае нельзя опускать тубус микроскопа, глядя в окуляр. Необходимо под контролем глаза, глядя сбоку, опустить объектив на расстояние меньше свободного рабочего, а затем, глядя в окуляр, макровинтом медленно поднимать тубус до тех пор, пока появится мелькание препарата. После этого точная установка достигается с помощью микровинта. Не следует делать микровинтом более половины оборота в одну или другую сторону. При фокусировке микроскопа полезно левой рукой слегка двигать препарат по поверхности предметного столика.
3.Пользуясь изложенными сведениями, необходимо научиться быстро и правильно устанавливать препарат в фокусе при всех трех объективах. Рассматривая препарат, следует обратить внимание на резкое увеличение числа разрешаемых подробностей при работе с иммерсионным объективом по сравнению с сухими объективами.



|
|
|
|
|
объектив 8× |
объектив 40× |
объектив 90× |
|
Дрожжевые клетки Saccharomyces cerevisiae
| ||
4.Необходимо твердо усвоить основные приемы бактериологической техники: обращение с культурами микробов, использование бактериологической петли, спиртовок, способы обеззараживания использованного материала и отработанных стекол.
При работе с культурами микроорганизмов необходимо соблюдать следующие два основные принципа: 1 - не загрязнить микробами окружающей среды и не заразить самого себя и 2 - не загрязнить культуру посторонними микробами из окружающей среды, так как точная идентификация исследуемого возбудителя заболевания возможна лишь при условии выделения и сохранения его в чистой культуре.
Культуру бактерий сохраняют обычно на жидких и плотных питательных средах в пробирках, закрытых ватно-марлевыми пробками. При всех манипуляциях с культурой (приготовление мазка, пересев ее с одной среда на другую и т.д.) используют стерильную бактериологическую петлю из металлической проволоки. Правильно приготовленная петля диаметром от I до 5 мм должна быть полностью замкнута и не должна иметь лишнего свободного конца. Петлю стерилизуют прокаливанием докрасна в пламени горелки, держа ее сначала вертикально, затем проводят 3-4 раза через пламя прилегающую к петле часть петледержателя.
Для соблюдения вышеуказанных принципов в случае приготовления бактериологическую петлю берут в правую руку как ручку или карандаш, а пробирку держат в левой руке между большим и указательным пальцами с тыльной стороны кисти почти в горизонтальном положении. При этом должна быть хорошо видна поверхность питательной среды с культурой бактерий.
Простерилизовав петлю, правой рукой захватывают пробку, прижимая ее мизинцем к ладони, освобождают ее небольшим поворотом, вынимают над пламенем горелки и, не выпуская пробку из руки (в таком положении она сохраняется в течение последующих манипуляций) обжигают края пробирки. Петлю вводят в пробирку, остужают прикосновением к внутренней стороне стекла и берут ею небольшое количество культуры, стараясь не захватить при этом питательной среды. Вынув петлю, опять обжигают края пробирки, слегка обжигают пробку и закрывают ею пробирку. Не выпуская петли из руки, ставят пробирку в штатив и приступают к приготовлению мазка. После этого петлю стерилизуют и ставят в штатив.
С соблюдением этих основных правил производят и все другие манипуляции с культурами бактерий - пересев из пробирки в пробирку» из пробирки в чашку, из чашки в чашку и т.п.
В случае попадания культуры микробов на руки, другие предметы и пол необходимо немедленно протереть руки и загрязненные предметы ватой, смоченной дезинфицирующим растворов, а пол залить этим же раствором. Через 30 минут руки можно вымыть с мылом.
5.На чистое сухое предметное стекло нанести с помощью бактериологической петли каплю воды. Прокаленной и остуженной петлёй внести в небольшое количество (одну петлю) микробной массы и равномерно перемешать с водой. Петлю прокалить и поставить в штатив. Накрыть каплю чистым покровным стеклом и придавить его слегка рукояткой петли. Полученную "раздавленную каплю" поместить на предметный столик микроскопа и промикроскопировать сначала со слабым сухим объективом, затем с сильным сухим объективом и, наконец, с иммерсионным. Для установки препарата в фокусе следует найти вначале при малом увеличении капли, вывести его в центр поля зрения и затем по нему ориентироваться.
При микроскопии необходимо помнить, что рассматривание неокрашенного препарата возможно только с ограниченным освещением, что достигается опусканием конденсора или уменьшением отверстия ирис-диафрагмы,
6.На чистое предметное стекло наносят каплю воды и рядом с ней несколько больших размеров каплю туши. В каплю воды вносят небольшое количество исследуемой культуры (получается облачко помутнения). Прокалив и остудив петлю(чтобы сжечь оставшуюся массу бактерий), готовят равномерную взвесь бактерий. Затем соединяют эту каплю с каплей туши, тщательно перемешивают и размазывают по стеклу тонким слоем. Высушивают мазок на воздухе и микроскопируют с иммерсионным объективом.
При микроскопии препарата рекомендуется начинать с более светлых участков его, а затем переходить на более темные. Необходимо помнить, что при негативных способах окраски микробы остаются не убитыми.


-
Сарцина Sarcina ,
Негативная окраска по Бурри
Стрептобацилла Streptobacillus
(«раздавленная капля»)
7.Основные формы бактерий. Готовые окрашенные препараты-мазки из культур стафилококка, стрептококка, сарцины (кокковые формы); монобактерии, стрептобациллы (палочковидные формы); вибриона (извитая форма) промикроскопировать и зарисовать. Обратить внимание на форму и взаиморасположение бактерий в каждом препарате.
|
|
|
|
|
Стафилококк Staphylococcus |
Стрептококк Streptococcus |
Сарцина Sarcina |
|
|
|
|
|
Монобактерии Monobacterium |
Стрептобацилла Streptobacillus |
Вибрион Vibrio |
Контрольные вопросы
От чего зависит разрешающая способность микроскопа?
Почему иммерсионные объективы имеют более высокую разрешающую способность по сравнению с сухими объективами с тем же отверстным утлом?
Что такое нумерическая апертура и по какой формуле она определяется?
Чему равны разрешающая способность современных оптических микроскопов и их полезное увеличение?
На какой высоте должен находиться при микроскопии конденсор?
Каким зеркалом следует пользоваться при работе на микроскопах, снабженных конденсором?
Чему равны свободные рабочие расстояния объективов микроскопов и для чего необходимо их знать?
Каким винтом микроскопа следует производить наводку на резкость?
Как следует производить наводку" микроскопа на резкость, чтобы избежать повреждения объектива и препарата?
Как выявить наличие загрязнения в окуляре?
Как правильно приготовить бактериологическую петлю?
Как следует держать пробирку, петлю и пробку при взятии материала для приготовления препарата?
Как предохранить культуру микроорганизма от загрязнения из воздуха?
Как производится негативная окраска препарата по Бурри?
Как выглядят бактерии в препарате, приготовленном по Бурри?
Как должно быть установлено освещение при микроскопии неокрашенных препаратов ("раздавленная капля")?
Как устроен люминесцентный микроскоп?
Каким светом наиболее целесообразно вызывать люминесценцию препарата и почему?
Каково назначение желтого окулярного светофильтра в люминесцентном микроскопе?
Что такое флуорохромирование, какие флуорохромы чаще применяются?
В чем заключается принцип иммунофлуоресцентного метода исследования?
В чем сущность темнопольной микроскопии?
В чем сущность фазовоконтрастной микроскопии?
Из каких трех основных систем состоит электронный микроскоп просвечивающего типа?
Почему разрешающая способность электронного микроскопа во много раз выше разрешающей способности светооптических микроскопов?
Приложение к ЗАНЯТИЮ 1.
Методы микробиологической диагностики инфекционных заболеваний
Микроскопический.С помощью микроскопии нативного патологического материала определяют вид возбудителя заболевания по форме, взаиморасположению и способности окрашиваться определенными красителями.
Бактериологический.Этот метод основан на выделении чистой культуры возбудителя заболевания и его идентификации (определение вида микроба).
Серологический.Метод основан на определении специфических антител в крови больных или переболевших инфекционными заболеваниями к соответствующим возбудителям с помощью различных реакций (агглютинации, пассивной гемагглютинации, связывания комплемента, преципитации и других).
Биологический.В основе этого метода лежит заражение лабораторных животных исследуемым материалом от больного с целью воспроизведения у них инфекционного заболевания или последующего выделения возбудителя.
Аллергический. С помощью этого метода обнаруживают повышенную чувствительность макроорганизма к определенным возбудителям инфекционных заболеваний или продуктам их жизнедеятельности. Для аллергических проб используют препараты, которые называются аллергенами.
Молекулярно-генетический. С помощью полимеразной цепной реакции (ПЦР) определяют в исследуемом материале наличие возбудителя инфекционного заболевания по специфичным для него последовательностям нуклеотидов.
ПРИЗНАКИ, ПРИМЕНЯЕМЫЕ ДЛЯ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ(для определения вида микроба)
Морфологические- форма, величина и характер расположения микробов друг к другу.
Тинкториалные- способность микробов окрашиваться различными красителями.
Культуральные - особенности роста микробов на жидких и плотных питательных средах.
Биохимические- способность микроорганизмов потреблять различные вещества (углеводы, белки и другие) с образованием характерных конечных продуктов, или наличие у микроорганизмов различных ферментов (уреаза, цистиназа и другие).
Антигенные- особенности химического состава микробных клеток (антигенной структуры), выявляемые с помощью специфических диагностических иммунных сывороток,
Чувствительность к специфическим фагам- способность бактерий лизироваться эталонными специфическими фагами.
Биологические свойства. Токсигенность - способность продуцировать экзотоксин. Чувствительность к определенным колицинам или тип синтезируемых колицинов.
Определение понятий "микроорганизмы" и "вид"
Микроорганизмы- это невидимые простым глазом живые существа, включающие в себя представителей всех царств жизни - плазмиды, вирусы, прокариоты (эубактерии и архебактерии) и эукариоты. Они стоят на низших ступенях эволюции и играют важную роль как в общей экономике природы, так и в патологии человека, животных и растений.
Вид - совокупность микроорганизмов, имевших общий корень происхождения, сходный генотип (более 80% гомологии ДНК) и максимально близкие фенотипические признаки и свойства.
Метод люминесцентной микроскопии.
Люминесцентная микроскопия основана на способности некоторых веществ светиться под действием коротковолновых лучей света. При этом длина волны излучаемого при люминесценции света всегда будет больше, чем длина волны света, возбуждающего люминесценцию. Так, если освещать объект синим светом, то он будет испускать лучи красного, оранжевого, желтого или зеленого цветов.
Препараты для люминесцентной микроскопии окрашивают специальными (светящимися) люминесцентными красителями - флуорохромами (например, раствор акридинового оранжевого 1:5000 - 1:10000). Лучи света от сильного источника (обычно ртутной лампы сверхвысокого давления) пропускаются через сине-фиолетовый фильтр. Под действием этого коротковолнового излучения окрашенные акридиновым оранжевым бактерии начинают светиться красным или зеленым светом. Для того, чтобы синий свет, вызывающий люминесценцию, не мешал наблюдению, над окуляром микроскопа ставят "запирающий" желтый светофильтр, задерживающий синие, но пропускающие желтые, зеленые и красные лучи.
В результате при наблюдении в микроскопе на темном фоне будут видны микробные клетки, светящиеся желтым, зеленым или красным цветом. При окраске акридиновым оранжевым дезоксирибонуклеиновая кислота (ядерное вещество) будет светиться ярко-зеленым цветом, а находящаяся в цитоплазме рибонуклеиновая кислота - красным цветом.
Метод люминесцентной микроскопии позволяет изучать живые нефиксированные бактерии, окрашенные сильно разведенными растворами красителей, не причиняющих вреда микробным клеткам. По характеру свечения могут быть дифференцированы отдельные химические вещества, входящие в состав микробной клетки. Метод с большим эффектом может -быть использован для ускорения диагностики ряда заболеваний.
Флуоресцирующими красителями можно обрабатывать диагностические сыворотки, содержащие антитела к определенным бактериям. Краситель, например, изотиоцианат флуоресцеина, химически соединяется с глобулинами иммунной сыворотки и таким образом как бы избирательно метит антитела.
Люминесцирующие сыворотки могут быть использованы для идентификации выделенных культур бактерии и для ускоренной индикации патогенных микробов во внешней среде и в выделениях больных.
Сущность иммунофлуоресцентного методаисследования заключается в том, что из исследуемого материала готовят мазок и после высушивания и фиксации обрабатывают его люминесцирующей сывороткой. При наличии в исследуемом мазке гомологичных бактерий, вследствие адсорбции на них меченных флуоресцирующим красителем антител, в люминесцентном микроскопе на темном фоне препарата обнаруживается специфическое яркое желто-зеленое свечение по периферии бактериальных клеток. Центральная часть клеток не светится. Присутствующие в препарате посторонние микробные клетки не светятся.
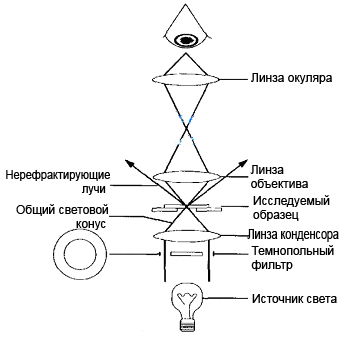
Темнопольная микроскопия (метод микроскопии в темном поле).
При микроскопии по методу темного поля препарат освещается сбоку косыми пучками лучей, не попадающими в объектив. В объектив микроскопа попадают лишь лучи, отклоненные частицами препарата в результате отражения, преломления или дифракции. В силу этого микробные клетки и другие частицы представляются ярко светящимися на черном фоне.
|
|
Ход лучей в темнопольном микроскопе |
Фазовоконтрастная микроскопия.
Обыкновенные окрашенные препараты поглощают часть проходящего через них света, в результате чего амплитуда световых волн снижается и частицы препарата выглядят темнее фона. При прохождении света через неокрашенный препарат амплитуда световых волн не меняется, происходит лишь изменение фазы световых волн, прошедших через частицы препарата. Однако человеческий глаз улавливать это изменение фазы света неспособен, поэтому неокрашенный препарат при правильной установке освещения в микроскопе будет невидим.
Фазоконтрастное устройство позволяет превратить изменение фазы лучей, прошедших через частицы неокрашенного препарата, в изменения амплитуды, воспринимаемые человеческим глазом и, таким образом, позволяет сделать отчетливо видимыми неокрашенные препараты.
Приспособление для фазовоконтрастной микроскопии включает в себя конденсор с набором кольцевых диафрагм, обеспечивающих освещение препарата полным конусом света, и фазовоконтрастные объективы, которые отличаются от обычных тем, что в их главном фокусе располагается полупрозрачная фазовая пластинка в виде кольца, вызывающая сдвиг фазы проходящего через нее света. Установка освещения производится таким образом, чтобы весь свет, прошедший через кольцевидную диафрагму конденсора, прошел в дальнейшем через расположенное в объективе фазовое кольцо.
При рассмотрении препарата весь свет, прошедший через участки препарата, в которых нет каких-либо объектов, пройдет через фазовое кольцо и даст светлое изображение фона. Свет, прошедший через имеющиеся в препарате частицы, например, бактериальные клетки,получит некоторые изменение фазы и, кроме того, разделится на два луча - недифрагированный и дифрагированный. Недифрагированный свет пройдет в дальнейшем через кольцевидную фазовую пластинку в объективе и получит дополнительный сдвиг фазы. Дифрагированные лучи пройдут мимо фазовой пластинки, и их фаза не изменится. В плоскости полевой диафрагмы окуляра произойдет интерференция дифрагированного и недифрагированного лучей. Так как эти лучи идут в разных фазах, произойдет их взаимное частичное гашение и уменьшение амплитуды. Благодаря этому микробные клетки будут выглядеть на светлом фоне темными.
Электронная микроскопия.
Устройство электронного микроскопа.
Возможности световых микроскопов ограничены волновой природой света. При оптимальных условиях световые микроскопы позволяют наблюдать, вследствие явления дифракции, объекты размером не менее 1/2 - 1/3 длины световой волны (около 0,2μ ).
Наибольшими возможностями в смысле разрешающей способности обладают электронные микроскопы, в которых пучок света заменен пучком электронов, длина волны которых составляет 0,04-0,05А.
Принципиальная оптическая схема электронного микроскопа аналогична схеме светового микроскопа, в котором все оптические элементы заменены соответствующими электрическими: источник света заменен источником электронов, стеклянные линзы - линзами электромагнитными, В электронных микроскопах просвечивающего типа различают три системы: электронно-оптическую, электропитания,
Электронно-оптическая система снабжена двумя конденсорными, объективной, промежуточной и проекционной линзами, обеспечивающими увеличение электронного микроскопа от 300 до 200000 крат. Промежуточная и проекционная линзы обеспечивают плавное изменение увеличения при постоянном поле изображения.
Фотографирование изображений при всех видах исследований производится на фотопластинки, фотопленку или фотобумагу.
В комплект электропитания электронного микроскопа входят: шкаф питающего устройства, выпрямитель высоковольтный, пульт управления, щит распределительный, трансформатор высокочастотный, стабилизатор феррорезонансный, соединительные кабели. Устройство обеспечивает электрическое питание всех узлов электронного микроскопа от сети трехфазного переменного тока с напряжением 220 или 380В, частотой 50 гц.
Вакуумная система электронного микроскопа позволяет получать и поддерживать в процессе работы рабочий вакуум 2·10-4мм рт.ст. в колонне микроскопа, производить шлюзование камеры объекта и фотокамеры. Герметичность вакуумной системы и колонны микроскопа в местах их соединения обеспечивается применением резиновых уплотнителей. Вакуумная система состоит из следующих основных узлов: стояка, вакуумного реле, высоковакуумного клапана, клапана распределительного, комбинированной ловушки, камеры вакуумной, обходного клапана, ловушки предварительного разрежения, диффузионного насоса, вспомогательного диффузионного насоса, баллона предварительного разрежения, механического насоса.
Источником пуска электронов является электронная пушка, состоящая из V-образного вольфрамового термокатода, который при нагревании до 2900° в результате термоэмиссии испускает свободные электроны, ускоряемые затем электростатическим полем, создаваемым между фокусирующим электродом и анодом. Электронный пучок затем формируется с помощью конденсорных линз и направляется на исследуемый объект. Электроны, проходя сквозь объект, за счет его различной толщины и плотности отклоняются под различными углами и попадают в объективную линзу, которая формирует первое увеличенное изображение объекта. После объективной линзы электроны попадают в промежуточную линзу, которая предназначена для плавного изменения увеличения микроскопа и получения диффракции с участков исследуемых образцов. Проекционная линза создает конечное увеличенное изображение объектов, которое направляется на флуоресцирующий экран. Благодаря взаимодействию быстрых электронов с веществом люминофора Флуоресцирующего экрана на нем возникает видимое изображение объекта. Увеличение конечного изображения на экране определяется как произведение увеличений, даваемых объективной, промежуточной и проекционной линзами.
Методы электронно-микроскопического препарирования.
а) Приготовление пленок-подложек и их монтаж на предметные сетки
Электронномикроскопическому изучению могут быть подвергнуты как ультратонкие срезы различных тканей, клеток, микроорганизмов, так и целые бактериальные клетки, вирусы, фаги, а также субклеточные структуры, выделенные при разрушении клеток различными способами.
Для того, чтобы исследовать различные объекты в световом микроскопе, их помещают на предметное стекло. При электронномикроскопических исследованиях роль предметного стекла (оно не может быть использовано, так как непроницаемо для электронов) выполняют очень тонкие, прозрачные пленки-подложки, которые крепятся на опорные сетки.
Обычно для исследований применяют сетки, приготовленные из платины или чистой меди и имеющие до 100 ячеек на I мм2. Они могут быть плетеными или изготавливаются специальным фотохимическим способом. Выпускаются как в готовом виде с внешним диаметром 2 или 3 мм. так и в виде полотна, из которого вырубаются специальными пробойниками.
Толщина пленок-подложек должна быть не более 200А, так как более толстые пленки увеличивают угловое рассеивание электронов, отчего контрастность изображения и разрешение структур объектов значительно уменьшаются. Чаще всего для электронномикроскопи-ческих исследований биологических объектов применяют коллодиевые, формваровые и угольные пленки-подложки.
Благодаря своему заряду электроны слабо проникают через плотные среды. Поэтому объект для исследования должен быть максимально проницаемым для электронов. По этим же соображениям подложка должна быть электрононейтральной, чтобы не задерживать электронов, и бесструктурной, чтобы не затемнять структуру объекта. Кроме того, подложки должны быть прочными, чтобы выдерживать высокую температуру. Для получения пленок-подложек из нитроцеллюлозы пользуются 1,5-2%-ными растворами коллодия в амилацетате (чистый коллодий получают путем выпаривания аптечного эфирного раствора коллодия). Каплю раствора коллодия наносят на поверхность дистиллированной воды, налитую в чашку диаметром около 20 см. Капля быстро растекается по поверхности воды, и после испарения амилацетата образуется тонкая пленка.
Пленки из формвара (поливинилформальдегида) несколько прочнее, чем из коллодия, но получать их сложнее, так как растворители формвара - диоксан, дихлорэтан - не растекаются по поверхности воды, как амилацетат, и, кроме того, очень токсичны. Для получения формваровых пленок чистое, хорошо отшлифованное стекло опускают в раствор 0,1-0,2%-ного формвара в диоксане или дихлорэтане, затем вынимают и подсушивают 5-10 минут на воздухе. На стекле образуется тонкая пленка, которую обрезают по краям стекла, стекло опускают под углом 45° в чашку с водой, пленку осторожно снимают на поверхность воды.
В последнее время все чаще применяют углеродные пленки (они химически инертны, хорошо переносят электронную бомбардировку, термостойки), которые получают путем испарения углерода в вакуумной установке. В установку помещают чистое шлифованное стекло и при контакте двух графитовых стержней, на которые подается электрический ток, на стекло распыляют углерод. Затем тонкую пленку, полученную на поверхности стекла, снимают на поверхность воды, как и в случае снятия формваровой пленки.
После того как на поверхности воды образуется тонкая пленка, полученная одним из вышеописанных способов, на пленку аккуратно пинцетом наносят опорные сетки выпуклой стороной вниз. После этого поверх сеток накладывают листок фильтровальной бумаги и снимают его вместе с пленкой о поверхности воды. Сетки оказываются заключенными между пленкой и фильтровальной бумагой. Бумагу подсушивают, и сетки вместе с подложкой снимают осторожно пинцетом для размещения на них объектов, подлежащих микроскопическому исследованию.
б) Методы негативного и позитивного контрастирования
При рассмотрении объекта в электронном микроскопе и выявлении тонких деталей его строения важны два основных фактора: разрешающая способность микроскопа и контрастность объекта. Ряд биологических структур рассеивают электроны почти так же, как и пленка-подложка, в результате чего контрастность настолько мала, что даже при достаточной разрешающей способности микроскопа изображение объекта не будет различимо. Для увеличения контрастности применяют ряд методов.
Негативное контрастирование. В основе этого метода лежит принцип разности контрастов. При этом исследуемый объект смешивают с раствором соли тяжелого металла и наносят на сетку. Контрастирующее вещество окружает объект более низкой плотности, в результате чего малоконтрастный объект становится отчетливо различим на окружающем его темном фоне. В этом случае получают негативный эффект. Для негативного контрастирования применяют 2%-ный раствор уранилацетата или 2%-ный раствор фосфорновольфрамовой кислоты.
Позитивное контрастирование. Известно, что соли тяжелых металлов могут специфически реагировать с различными биологическими веществами, тем самым они могут повышать контрастность соответствующих структур. Например, осмий хорошо реагирует с липоидными веществами, уранилацетат - с нуклеиновыми кислотами, соли свинца с белковыми компонентами клеток и тканей. Увеличение контрастности структур, возникающее после взаимодействия их с солями тяжелых металлов, обеспечивает позитивное контрастирование объекта, так как в результате "окраски" структуры становятся менее проницаемыми для электронов и выглядят темными на светлом фоне препарата.
в) Метод оттенения
Для увеличения контрастности исследуемых объектов применяют также метод оттенения. При изготовлении образцов по этому методу исследуемый объект помещают в вакуумную напылительную установку и на него под определенными углами производят испарение металла (платины, палладия, золота, хрома, углерода) или их сплавов.
В тех местах, где объект будет экранировать пучок частиц, возникают тени. Рассеивание и поглощение электронов для различных участков объекта оказывается различным, в результате чего контрастность изображения возрастает. Этот метод позволяет не только увеличить контрастность, но и установить в ряде случаев размеры исследуемых объектов по длине тени и углу отклонения с использованием специальных формул.
Методы получения ультратонких срезов
а) Способы фиксации и заливки биологических объектов
Основная цель фиксации - сохранить объект в таком состоянии, которое правильно бы отражало прижизненное состояние объекта. "В настоящее время в практике электронной микроскопии применяют химические способы фиксации. По способу действия на живые структуры все химические фиксаторы разделяют на две группы:
1) фиксаторы, осаждающие (коагулирующие) белки - спирты, уксусная и пикриновая кислоты, соли тяжелых металлов, которые в основном применяют в световой микроскопии;
2) фиксаторы, стабилизирующие липиды - четырехокись осмия, формалин, перманганат калия.
Для фиксации клеток из культур микроорганизмом, выращенных на плотных и жидких средах, применяют 1%-ный раствор KMnO4 приготовленный на ацетат-вероналовом буфере. При фиксации бактериальных клеток по Ритер-Келленбергер применяют стандартный раствор: 1% OsO4в ацетат-вероналовом буфере (рН=6,0), в котором фиксатором является осмий.
После фиксации производят обезвоживание. В качестве обезвоживающих веществ используют этиловый спирт, метиловый спирт и ацетон, которые берут в возрастающих концентрациях (30°, 50°, 70° , 96°, 100°).
После обезвоживания объекты заключают в пластмассы или другие среды. Так как оптимальная толщина срезов должна быть не более 250-800 А, то необходимо, чтобы заливочный материал обладал определенной твердостью и другими свойствами. Для этих целей используют пластические массы - метакрилаты, эпоксидные смолы.
В практике электронной микроскопии чаще используют метакрилаты: бутилметакрилат и метилметакрилат. Бутилметакрилат полимеризуется в сравнительно мягкие блоки, поэтому к нему прибавляют 10-20% метилметакрилата. В качестве катализатора применяют 1-2%-ную перекись бензоила. Заливочную смесь (рабочую) заливают в желатиновые капсулы, где происходит полимеризация ее при 600 в течение 48 часов.
б) Приготовление стеклянных ножей
Одним из самых важных этапов при получении ультра тонких срезов является процесс приготовления стеклянного ножа. Стеклянные ножи готовят из полос специального (зеркального) стекла, толщина которого должна быть 5 мм. Из такой полосы приготавливают квадраты размером 3x3 см, для чего стеклорезом вначале делают нарезки и по нарезу обламывают клетки-квадраты. Затем приготовленный квадрат надрезают по диагонали и разламывают.
Насечки стеклорезом производят таким образом, чтобы они не доходили до края стекла на 2-3 мм. После разламывания квадрата по диагонали с помощью лупы просматривают получившиеся лезвия. Обычно нож получается несколько неровным и только небольшая его , часть имеет ровный участок, который и используется в качестве лезвия.
Выпускаются специальные приборы - станки для изготовления стеклянных ножей (напр., ССН-1), которые значительно облегчили процесс изготовления ножей. После изготовления ножа на нем укрепляют ванночку из лейкопластыря, и нож с ванночкой устанавливают в микротом.
Демонстрация приготовления стеклянных ножей с помощью прибора ССН-1.
в) Ознакомление с устройством ультрамикротома и получением ультратонких срезов
Незначительная проникающая способность электронов даже при больших ускоряющих -напряжениях требует изготовления сверхтонких срезов. Ультратонкие срезы получают на специальных приборах, называемых ультрамикротомами. В современных микротомах применяется тепловая подача металлического стержня, а через него и блока (объекта) по отношению к ножу. Для подготовки препарата к резанию необходимо, чтобы полушаровидныи конец цилиндрического блока был заточен в виде пирамидки, содержащей объект. Все операции по заточке блока производят под бинокулярной лупой. После подготовки блока к резке его устанавливают в микротом таким образом, что после включения последнего блок начинает двигаться по отношению к неподвижно закрепленному ножу. Получающиеся при микротомии ультратонкие срезы остаются в ванночке ножа, которая предварительно заполняется дистиллированной водой. Срезы свободно плавают на поверхности жидкости. Когда срезов накапливается достаточное количество, их собирают на сетке (прикосновением к поверхности жидкости).
Демонстрация ультратонких срезов бактериальных клеток в электронном микроскопе.
З А Н Я Т И Е 2
Дата ______________
Тема: Морфология и ультраструктура бактерий, риккетсий, хламидий, микоплазм, актиномицетов, спирохет, грибов, простейших. Классификация микробов.
План занятия:
1. Спирохеты возвратного тифа. Микроскопия готовых препаратов.
2. Бледная спирохета. Микроскопия готовых препаратов, приготовленных из чистой культуры бледной спирохеты или из исследуемого материала – отделяемого твёрдого шанкра.
3. Лептоспиры. Демонстрация препарата из исследуемого материала с импрегнацией серебром.
4. Актиномицеты: а) микроскопия препарата-мазка из чистой культуры актиномицета; б) демонстрация готового препарата друзы актиномицета.
5. Нитчатые (плесневые) грибы. Макроскопия культур и микроскопия препаратов "раздавленная капля".
6. Дрожжевые грибы. Микроскопия окрашенных препаратов-мазков.
7. Дрожжеподобные грибы рода кандида. Микроскопия культур грибов кандида.
8. Простейшие:
а) микроскопия трипаносом, окрашенных по Романовскому;
б) микроскопия препаратов лейшманий из тканей больного и из чистой культуры.
9. Малярийный плазмодий. Микроскопия препаратов из крови больных малярией: изучение стадий развития плазмодия малярии.
10. Токсоплазмы. Микроскопия готовых препаратов, приготовленных из органов зараженной токсоплазмами белой мыши.
11. Амебы. Микроскопия готовых препаратов-мазков из испражнений больного амёбиазом.
12. Риккетсии. Разбор морфологии по таблицам.
13. Хламидии. Разбор морфологии по таблицам.
14. Микоплазмы. Разбор морфологии по таблицам.
Методические указания
1.Боррелии возвратного тифа в мазке крови больного при окраске по Романовскому-Гимзе на фоне форменных элементов крови выглядят как извилистые фиолетово-сиреневые нити, образующие от 3 до 8 завитков спирали. Завитки неравномерные, глубокие, шаги между завитками разные.
2.Бледная трепонема – возбудитель сифилиса – имеет вид спирали, напоминающей слегка растянутую пружину, имеющую от 6 до 14 завитков. Амплитуда завитков средняя, равномерная, шаг между завитками одинаковый. На концах пружина растянута, как бы, сильнее. При окраске по Романовскому-Гимзе окрашиваются в бледно-розовый цвет.
3.Лептоспиры имеют вид тонкой сильной закрученной пружины, имеют 14-22 витка спирали. Концы часто загнуты в виде крючков (завитки второго порядка), что может им придавать С- илиS-образную форму.
4.При микроскопии окрашенных мазков из чистой культуры обратить внимание на сплетение тонких нитей (гифов) и их истинное ветвление. Переплетение гифов – мицелий.
В гистологическом срезе из органа при актиномикозе центральная часть друзы актиномицета представляет сплетение тонких нитей, окрашенных в темно-фиолетовый цвет. Отходящие на периферию концевые нити образуют колбовидные вздутия, окрашенные в розовый цвет.
5.В каплю вода на предметном стекле вносят небольшую частицу гриба и накрывают покровным стеклом. При микроскопии со слабой и сильной сухими системами обратить внимание на строение мицелия и органов плодоношения. Мицелий у мукора одноклеточный, несептированный, а у аспергилла и пеницилла - многоклеточный. Органы плодоношения: большой спорангиеносец с эндоспорами у мукора; конидиеносцы несептированные в виде лейки у аспергилла, септированные в виде кисти рук у пеницилла.
6.В препарате-мазке, окрашенном метиленовым синим, обратить внимание на форму дрожжевых клеток, наличие почковидных выпячиваний, а также на внутреннее строение клеток.
7.Дрожжеподобные грибы родаCandidaявляются одноклеточными микроорганизмами. Диаметр клеток варьирует в пределах 2-15 мкм. Клетки дрожжеподобных грибов одеты отчетливо заметной оболочкой, имеют цитоплазму, компактное ядро, вакуоли и разнообразные включения. Почкование является единственной формой размножения этих грибов. Форма почек округлая или слегка грушевидная.
Наружных спор типа конидий и внутренних типа аскоспор дрожжеподобные грибы не образуют, чем и отличаются от истинных дрожжей, аскомицетов и конидиальных организмов. Некоторые виды рода Candidaобразуют хламидоспоры, диаметр их достигает 10-20 мкм, форма округлая, оболочка толстая, двуконтурная. Хламидоспоры возникают на концах псевдомицелия из укрупненных клеток, называемых протохламидоспорами.
Настоящего мицелия дрожжеподобные грибы также не имеют. Образование нитей (филаментация) происходит за счет удлинения клеток и расположения их в длинные цепочки. Такие нити называются псевдомицелием и отличаются от истинного мицелия тем, что не имеют общей оболочки и перегородок, а состоят из длинных клеток, образующихся путем последовательного бокового или концевого почкования.
8.Патогенные простейшие – жгутиконосцы.
8.1. Трипаносомы являются патогенными простейшими, относящимися к типу Sarcomastigophora, имеющими очень характерную морфологию. В мазке крови больного африканской сонной болезнью при окраске по Романовскому-Гимзеимеют размеры 15-30 мкм в длину и 1,4-3,0 мкм в ширину, длина жгутика колеблется от 12 до 42 мкм. Удлиненно-овальное ядро лежит почти в середине клетки, на заднем конце располагается блефаропласт, от которого отходит жгутик. Последний волнообразно изогнут, между ним и телом трипаносомы натянута прозрачная ундулирующая мембрана. От противоположного конца клетки жгутик продолжается на некотором расстоянии свободно.
8.2. Лейшманиальная форма (амастигота, тканевая форма) обнаруживается в патологическом материале в свободных макрофагах или клетках системы мононуклеарных фагоцитов. Амастиготы представляют собой мелкие овальные клетки размером 1-3 × 2-6 мкм с расположенным сбоку овальным ядром и хорошо видимым палочковидной формы кинето-пластом. В просвете кишечника переносчика-москита и в культуре на питательной среде безжгутиковые формы превращаются в подвижные жгутиковые промастиготы (лептомонадная форма). Они имеют веретенообразную вытянутую форму, размеры 4-6 × 10-20 мкм и жгутик, отходящий от кинетопласта. При окраске по Романовскому-Гимзе цитоплазма амастиготы и промастиготы окрашивается в голубой или голубовато-фиолетовый цвет, а ядро, кинетопласт и жгутик – в красный или красно-фиолетовый цвет.
9.В препаратах из крови больных трехдневной малярией найти различные стадии развития малярийного плазмодия: молодые шизонты кольцевидной формы с вакуолью в центре; зрелые шизонты неправильной амебовидной формы без вакуоли; делящиеся шизонты - в стадии меруляции; макфо- и микрогаметоциты правильной овальной формы. Обратить внимание на форму и размеры эритроцитов.
10.Токсоплазмы имеют форму полумесяца или напоминают дольки апельсина. Один конец токсоплазмы заострен, а другой - закруглен. Размеры их следующие: длина 4-7 микронов, ширина – 2-4 мкм. При окраске по методу Романовского-Гимзе цитоплазма токсоплазм окрашивается в голубой цвет; ядро, имеющее вид скопления гранул и сети, - в рубиново-красный цвет. Ядро располагается, как правило, в центре паразита, занимая около 1/4 части его тела.
11.Основной диагностический признак амёбиаза – обнаружение в испражнениях больного цист.Цисты правильной шаровидной формы, иногда слегка вытянуты, диаметр 8-15 мкм. Хорошо заметна бесцветная оболочка. Зрелые цисты содержат 4 ядра, незрелые цисты имеют одно, два, три ядра и вакуоль, содержащую гликоген. В свежем препарате ядра едва заметны; они хорошо выявляются при обработке препарата раствором Люголя.
12.Риккетсии – грамотрицательные прокариоты, не растущие на питательных средах, имеют мелкие размеры, форму палочек, кокковидную, иногда нитевидную. Жизненный цикл риккетсии зависит от жизнедеятельности клетки-хозяина и складывается из 2 стадий — вегетативной и покоящейся. Риккетсии, находящиеся в вегетативной стадии, имеют палочковидную форму, активно размножаются путем бинарного деления и обладают активной подвижностью. Риккетсии покоящейся стадии имеют сферическую форму и не размножаются. Обнаруживаются внутриклеточно окраской по Здродовскому.
13. Хламидии – грамотрицательные прокариоты, облигатные внутриклеточные «энергетические» паразиты. Основные стадии жизненного цикла:
элементарные тельца – мелкие (0,2-0,5 мкм) электронно-плотные шаровидные структуры, имеющие компактный нуклеоид и ригидную трехслойную клеточную стенку;
инициальные (исходные), или ретикулярные, тельца – большие (0,8-1,5 мкм в диаметре) сферические образования, имеющие сетчатую структуру с тонкой клеточной стенкой и фибриллярным нуклеоидом;
промежуточные тельца — промежуточная стадия между элементарными и ретикулярными тельцами.
Вегетативные формы размножаются путем бинарного деления внутриклеточно, но не инфекционны, когда выделяются из клетки-хозяина. Для микроскопического обнаружения хламидии в инфицированных клетках (тканях) применяют различные способы окрашивания: Романовского-Гимзы, Кастенады, Маккиавелло и др. При окрашивании по Романовскому-Гимзе они приобретают голубой или фиолетовый цвет. Однако хламидии хорошо видны и в неокрашенном состоянии при фазовоконтрастной микроскопии влажных препаратов под стеклом.
14.Микоплазмы – мелкие грамотрицательные прокариоты, лишённые клеточной стенки.Морфология их различна – шаровидные, вакуолизированные, нитевидные (нередко ветвящиеся), гранулярные (элементарные тельца) структуры. Обычно неподвижные, но некоторые виды обладают скользящей подвижностью.
|
|
|
|
|
Боррелии возвратного тифа Borrelia recurrentis |
Бледная трепонема Treponema pallidum |
Лептоспира Leptospira interrogans |
|
|
|
|
|
Актиномицет Actinomyces |
Друза актиномицета |
Нитчатый гриб мукор Mucor |
|
|
|
|
|
Нитчатый гриб аспергилл Aspergillus |
Нитчатый гриб пеницилл Penicillium |
Дрожжи Saccharomyces cerevisiae |
|
|
|
|
|
Грибы кандида Candida albicans |
Трипаносома Trypanosoma gambiense |
Токсоплазма Toxoplasma gondii |
|
|
|
|
|
Лейшмании в чист. кул-ре Leishmania tropica |
Лейшмании в тканях Leishmania tropica |
Патогенная амёба Entamoeba histolytica |
|
|
|
|
|
Молодой шизонт при | ||
|
3-дневной малярии Plasmodium vivax |
4-дневной малярии Plasmodium malariae |
тропической малярии Plasmodium falciparum |
|
|
|
|
|
Зрелый шизонт при | ||
|
3-дневной малярии Plasmodium vivax |
4-дневной малярии Plasmodium malariae |
тропической малярии (не обнаруживается !) Plasmodium falciparum |
|
|
|
|
|
Стадия меруляции при | ||
|
3-дневной малярии Plasmodium vivax |
4-дневной малярии Plasmodium malariae |
тропической малярии Plasmodium falciparum |
|
|
|
|
|
Гаметоциты при | ||
|
3-дневной малярии Plasmodium vivax |
4-дневной малярии Plasmodium malariae |
тропической малярии Plasmodium falciparum |
Контрольные вопросы
Какое место занимают спирохеты в системе микроорганизмов?
Дайте классификацию спирохет.
Какое строение имеют спирохеты?
Какие метода микроскопии применяются для изучения морфологии спирохет?
Какой принцип микроскопии в темном поле?
Какое место занимают актиномицеты в системе микроорганизмов?
Как устроена друза актиномицета?
Каковы особенности морфологии актиномицетов?
Что такое спорангий, гифы, мицелий, конидии?
Чем отличаются мицелий и органы плодоношения мукоровых, аспергилловых и пеницилловых плесеней?
Чем отличаются споры грибов от спор бактерий?
Каковы строение и способы размножения дрожжей?
Каковы морфологические отличия дрожжеподобных грибов от дрожжей?
Что такое аски?
Почему дрожжеподобные грибы относятся к категории несовершенных грибов?
Какие грибы используются как продуценты антибиотиков?
Какова роль дрожжевых и дрожжеподобных грибов в медицине и промышленности?
Что такое хламидоспоры? Псевдомицелий?
У каких грибов имеет место их образование?
Дайте классификацию простейших.
Назовите патогенных представителей из каждого класса простейших.
Какое строение имеют трипаносомы?
Что такое блефаробласт, ундулирующая мембрана?
Какое строение имеют лейшманин?
Чем отличается лептомонадная форма лейшманий от лейшманиальной?
Какова классификация возбудителей малярии?
Какие отличительные признаки имеет комар - переносчик возбудители малярии?
Какие циклы развития имеет малярийный плазмодий?
Как и где протекает спорогония?
Как и где протекает шизогония?
Какова морфологии молодых и зрелых шизонтов, микро- и макро-гаметоцитов и стадии меруляции у возбудителя 3-х дневной малярии?
Каковы отличительные особенности возбудителей 4-дневной и тропической малярии?
Как изменяются эритроциты при различных формах малярии?
Какое строение имеет токсоплазма?
Что такое риккетсии, их морфологические и биологические особенности?
Что такое хламидии, их морфологические и биологические особенности?
Что такое микоплазмы, их морфологические и биологические особенности?
Приложение к ЗАНЯТИЮ 2.
Для дифференциации малярийных плазмодиев необходимо учитывать следующие признаки:
1. Размеры, форма и количество молодых шизонтов;
2. Размеры и форма зрелого шизонта;
3. Количество мерозоитов на стадии меруляции;
4. Размеры поражённых эритроцитов;
5. Морфология половых клеток - гаметоцитов.
При всех формах малярии молодой шизонт имеет форму "голубого перстня с рубиновым камнем". При тропической малярии в одном эритроците может быть иногда 2-3 молодых шизонта одновременно, при остальных формах - только один.
При 3-дневной и тропической малярии зрелый шизонт имеет амёбовидную форму с зернистостью, при 4-дневной - лентовидную форму с узким ядром в виде рубиновой полосы сбоку.
На стадии меруляции при 3-дневной малярии в пораженном эритроците 16-20 мерозоитов, при 4-дневной – 6-8, при тропической – до 30.
Пораженный эритроцит увеличен в диаметре в 1,5-2 раза по сравнению с нормальным только при 3-дневной малярии.
Гаметоциты при 3-х и 4-дневной малярии крупные, занимают почти всю площадь эритроцита, у макрогамет ядро крупнее, у микрогамет – мельче. При тропической малярии гаметоциты имеют серповидную форму.
З А Н Я Т И Е 3
Дата ______________
Тема: Микроскопический метод диагностики инфекционных заболеваний. Морфология и ультраструктура микроорганизмов.
План занятия:
1. Знакомство с основными анилиновыми красителями и приготовлением их растворов для окрашивания микроорганизмов.
2. Приготовление препарата-мазка, фиксирование его, окрашивание и микроскопия.
3. Сложные методы окраски микробов. Окраска по Граму с применением контролей и без них.
4. Включения у бактерий. Окраска зерен волютина по Нейссеру и по Лёффлеру.
5. Капсула у бактерий. Окраска капсул в препаратах-мазках из культуры палочки Фридлендера по методу Бурри-Гинса.
6. Споры у бактерий. Исследование спор в неокрашенных препаратах (раздавленная капля) и в препаратах-мазках, окрашенных водным фуксином и по Клейну.
7. Изучение клеточных ультраструктур по электронограммам.
Методические указания
1. Анилиновые красители используются при светлопольной микроскопии для окрашивания микроорганизмов, имеющих клеточное строение, для более качественного наблюдения их морфологии и выявления отдельных субклеточных структур.
В микробиологической практике наиболее часто используются следующие анилиновые красители: I) красные (фуксин основной, фуксин кислый, сафранин, нейтральный красный, конгорот); 2) синие (метиленовый и толуидиновый синие и др.); 3) фиолетовые (генциан фиолетовый, метиловый фиолетовый, кристаллический фиолетовый); 4) желто-коричневые (везувин, хризоидин); 5) зеленые (бриллиантовый зеленый, малахитовый зеленый).
Из перечисленных анилиновых красителей готовят основные насыщенные спиртовые растворы, которые могут храниться длительное время. Для приготовления рабочих растворов основной насыщенный спиртовый раствор красителя разводят дистиллированной водой в соотношении 1:10.
2.На чистое предметное стекло нанести каплю воды. Прокаленной и остуженной петлёй захватить очень небольшое количество микробной массы и коснуться ею капли так, чтобы оставить в ней облачко помутнения. Прокалить и остудить петлю и, перемешав каплю, размазать ее тонким слоем по стеклу, после чего петлю снова прокалить и поставить в штатив.
Подсушить приготовленный мазок на воздухе. Зафиксировать мазок путем проведения нижней стороной через пламя 3-4 раза. Фиксирование считается хорошим, если стекло, приложенное к тыльной поверхности кисти, дает ощущение легкого жжения. При отсутствии такого ощущения препарат может смыться, а при ощущении ожога микроскопическая картина будет искажена.
Положить препарат на мостик для окраски мазком вверх и окрасить нужным методом. После окрашивания тщательно промыть препарат водой и обсушить препарат, аккуратно промокая (но не вытирая!) фильтровальной бумагой. Микроскопировать с иммерсионным объективом. Микроскопическую картину зарисовать в тетрадь.
3.Окраска по Граму (в модификации Синева) производят следующим образом. Из исследуемого материала готовят тонкий препарат-мазок, высушивают его на воздухе и фиксируют на пламени спиртовки.
На препарат кладут кусочек фильтровальной бумаги, пропитанной карболовым раствором генцианвиолета, и увлажняют его 2-3 каплями воды. Окрашивание продолжается 2 мин.
Сбросив пинцетом фильтровальную бумагу, на препарат наливают на 2 мин. раствор Люголя. Слив раствор Люголя, не промывая препарат, наливают на него для обесцвечивания несколько капель 96°спирта на 30 сек (обесцвечивание должно производиться при покачивании стекла).
Быстро смыв спирт водой, препарат докрашивают раствором фуксина Пфейффера в течение 1-2 мин., после чего промывают водой и высушивают.
Для окраски по Граму на одном стекле готовятся три мазка из разных культур (для контроля). Мазок в середине стекла готовят из изучаемой культуры, а по концам стекла с одной стороны - из культуры стафилококка (заведомо грамположительная); а с другой - из культуры кишечной палочки (заведомо грамотрицательная).
Приготовленный таким образом тройной препарат-мазок подсушивают на воздухе, фиксируют на пламени спиртовки и окрашивают как один мазок, чтобы соблюсти одинаковые условия. Лишь при правильной окраске контролей (темно-фиолетовый стафилококк и розовая кишечная палочка) можно считать правильной и окраску среднего мазка, то есть изучаемой культуры.
Из трёх культур приготовить на одном стекле мазки, зафиксировать и окрасить по Граму, промикроскопировать под иммерсией и зарисовать.
|
|
|
|
|
Окраска по Граму | ||
|
Стафилококк Staphylococcus |
Исследуемая культура _____________________ |
Кишечная палочка Escherichia coli |
4.Окраска зерен волютина
4.1. по Нейссеру:
Фиксированный мазок окрашивают заранее приготовленной уксуснокислой синькой Нейссера 5 мин. Промывают препарат водой и обрабатывают его раствором Люголя в течение I минуты. Не промывая водой, докрашивают препарат везувином 15 сек. Затем промывают, высушивают и микроскопируют. Зерна волютина окрашиваются в темно-фиолетовый цвет, а тело бактерий - в соломенно-желтый цвет.
4.2. по Лёффлеру:
Фиксированный мазок окрашивают щелочным р-ром метиленового синего, который наносят на 3 - 5 мин., после чего смывают водой, мазок высушивают и микроскопируют. Цитоплазма бактерий окрашивается в голубой цвет, волютиновые зерна – в темно-синий или фиолетовый.
5.Окраска капсул по методу Бурри-Гинса.
На предметное стекло нанести каплю туши, внести в нее небольшое количество исследуемой культуры с помощью бактериальной петли, тщательно перемешать. Ребром второго предметного стекла сделать мазок, как для исследования крови. Высушить мазок на воздухе и зафиксировать на пламени спиртовки. Нанести на мазок несколько капель водного фуксина на 2-3 минуты, затем промыть, высушить и промикроскопировать. На фоне туши четко видны окрашенные фуксином бактериальные клетки, окруженные светлым овалом (капсулы). Зарисовать препарат.
6.В препарате "раздавленная капля" споры, обладающие более высоким коэффициентом преломления, выглядят в виде блестящих или темных (в зависимости от фокусировки объектива) образований, отличающихся от более тусклых и неясно очерченных тел бактерий.
При окраске фуксином Пфейффера споры не окрашены и выглядят в виде бесцветных овальных образований, расположенных внутри окрашенных клеток или свободно лежащих между клетками.
|
|
|
|
|
Зёрна волютина (окраска по Нейссеру) Lactobacterium bifidum |
Зёрна волютина (окраска по Лёффлеру) Corynebacterium diphtheriae |
Капсулы бактерий (окраска по Бурри-Гинсу) Klebsiella pneumoniae |
|
|
|
|
|
Споры бактерий у Streptobacillus | ||
|
«раздавленная капля» |
окраска фуксином |
окраска по Клейну |
Для окраски препарата по способу Клейна фиксированный мазок покрывают фильтровальной бумагой, на бумагу наливают карболовый фуксин Циля и подогревают препарат над спиртовкой до появления паров 4-5 раз. Пинцетом снимают бумажку и обесцвечивают препарат, погружая его в стаканчик с 1% -ным раствором серной кислоты на 5-6 сек. Тщательно промывают препарат и дополнительно докрашивают метиленовым синим 3-5 мин. Промывают препарат водой, высушивают и микроскопируют. Споры окрашиваются в красный цвет, вегетативные клетки – в синий. Препараты зарисовать.
7.Демонстрация электронограмм ультратонких срезов различных видов бактерии. Определить на электронограммах клеточную стенку, цитоплазматическую мембрану, мезосомы, рибосомы и нуклеоид (ядерную вакуоль).
Контрольные вопросы
Какие красители - кислые или основные - чаще применяются при окрашивании бактерий и почему?
Какие основные красители красного, синего, фиолетового и коричневого цвета применяются в микробиологии?
Как готовится концентрированный карболовый раствор основного фуксина и насыщенный раствор метиленового синего?
Какие способы окрашивания микробов Вы знаете?
Из каких последовательных этапов складывается приготовление препарата-мазка?
Для чего необходима фиксация препарата-мазка?
Какие способы фиксации препаратов Вы знаете?
Как производится фиксация на пламени и как контролируется ее качество?
Как определить, на какой стороне стекла находится мазок?
В чем заключается принцип окраски по Граму?
В какой цвет окрашены грамположительные бактерии и почему?
Какова методика окраски по Граму?
Как контролируется правильность окраски по Граму?
Почему зерна волютина окрашенные метиленовым синим, получили название метахроматических?
Какие образования составляют оболочку бактерий?
Что представляют собой цитоплазматическая мембрана, клеточная стенка и капсула?
Какие включения могут быть в цитоплазме бактерий?
Какую роль играют капсулы у патогенных бактерий?
По каким признакам можно заподозрить наличие капсул в микробной культуре?
Что такое споры бактерий, каковы их свойства?
Как можно заподозрить наличие опор в микробной культуре?
Каковы принципы окраски капсул у бактерии?
Каковы принципы окрашивания спор у бактерий?
С чем связана высокая терморезистентность спор?
Какова структура пептидогликана?
Каковы функции клеточной стенки бактерий?
Каковы функции цитоплазматической мембраны?
Что такое рибосомы?
Чем отличается ядерный аппарат бактерий от ядерного аппарата эукариотов?
Приложение к ЗАНЯТИЮ 3.
Карболовый фуксин Циля
Основной фуксин 1 г
Спирт 96°10 мл
Карболовая кислота кристаллическая 5 г Глицерин несколько капель
Вода дистиллированная до 100 мл
Водный фуксин (фуксин Пфейффера)
Карболовый фуксин Циля 1 мл
Дистиллированная вода 10 мл
Насыщенный спиртовый раствор метиленового синего
Метиленовый синий 10 г
Спирт 96°до 100 мл
Водно-спиртовый раствор метиленового синего
Насыщенный спиртовый раствор метиленового синего 10 мл
Дистиллированная вода 100 мл
Метиленовый щелочной синий Лёффлера
Насыщенный спиртовый раствор метиленового синего 30 мл
Едкий натр или едкое кали 1%-ный раствор I мл
Дистиллированная вода до 100 мл
З А Н Я Т И Е 4
Дата ______________
Тема: Физиология бактерий. Питательные среды. Методы стерилизации и дезинфекции. Влияние на микробы физических и химических факторов. Бактериологический метод диагностики инфекционных заболеваний Выделение чистых культур бактерий: аэробов и анаэробов (1 день).
План занятия:
1. Питательные среды, применяемые для выращивания бактерий.
2. Знакомство с термостатами, их устройством, терморегуляцией. Знакомство с бактериологической посудой.
3. Методы стерилизации. Знакомство с устройством и работой сухожарового аппарата и автоклава.
4. Знакомство с характером роста бактерий на плотных и жидких питательных средах (культуры бактерий на МПА в чашках Петри и в пробирках, а также на МПБ).
5. Пигменты бактерий, демонстрация пигментных культур.
6. Изучение колоний бактерий на пластинках МПА.
7. Техника пересева бактериальных культур с пластинок МПА на косячок МПА, с косячков МПА на косячок и пластинки МПА с помощью бактериальной петли и шпателя.
8. Исследование смеси бактерий. Бактериоскопия смеси и посев ее на пластинки МПА для выделения изолированных колоний.
Методические указания
1. Питательные среды (ПС). По назначению делятся на:Универсальные среды – (мясопептонный агар - МПА, мясопептонный бульон - МПБ) – растут многие вида бактерий.Специальныесреды – (кровяные, сахарные, сывороточные) – для культивирования бактерий, плохо растущих или не растущих на универсальных средах.Избирательные( элективные) среды – (желчь, желчный бульон, пептонная вода, солевой агар) – хорошо растут (избирательно) лишь нужные виды бактерий, рост сопутствующих подавлен.Дифференциально-диагностическиесреда – (Эндо, Левина, Плоскирева и др.) – различные виды бактерий растут в виде окрашенных или неокрашенных колоний (дифференциация по внешнему виду колоний).
ПС по консистенции: жидкие, полужидкие, плотные (твёрдые).
ПС должны обязательно отвечать следующим требованиям: 1) они должны содержать все необходимые питательные вещества, витамины и соли; 2) иметь оптимальную рН; 3) обладать буферной ёмкостью; 4) иметь достаточную влажность (особенно плотные среды); 5) должны быть стерильными; 6) должны быть прозрачными (особенно жидкие ПС).
2.Демонстрация термостатов, бактериологической посуды.
3.Демонстрация сухожарового шкафа, автоклава. Разбор методов стерилизации и дезинфекции.
4-6. Обратить внимание на внешний вид культуры: муть, пленка, осадок (для жидких культур). Описать внешний вид колоний на пластинках МПА: размеры; края колонии (ровные, фестончатые, лопастные); поверхность колонии (влажная или сухая, гладкая или шероховатая, складчатая или ровная, плоская или выпуклая и т.д.); прозрачность колонии (прозрачная, полупрозрачная, непрозрачная); наличие пигмента и цвет его; консистенция колонии (плотная, рыхлая, слизистая).
Из описанной колонии приготовить препарат-мазок, окрасить фуксином Пфейффера, зарисовать препарат и записать морфологию бактерий, а затем при помощи бактериальной петли сделать посев на косячок МПА. Для этого необходимо простерилизовать петлю, приподнять крышку чашки Петри и стерильной холодной петлёй прикоснуться к колонии. После этого в левую руку берется пробирка с косячком МПА (между большим и указательным пальцами) так, чтобы поверхность скошенного агара была перед глазами. Пробирка открывается над пламенем горелки, обжигается ее край, а затем петля вводится в пробирку до дна ее, где имеется небольшое количество конденсационной влаги. Плоской поверхностью петли прикасаются к поверхности косячка агара и делают посев штрихообразными движениями, постепенно продвигаясь снизу вверх. Обжигают на пламени спиртовки край пробирки и пробку и закрывают пробирку над пламенем спиртовки. На пробирке восковым карандашом (маркером) надписывают название культуры, дату посева, фамилию и группу студента и ставят посев до следующего занятия в термостат. Результаты работы оформляют в виде протокола по следующей форме.
Протокол исследования колонии.
1. Размер колонии_______________________________________
2. Форма колонии_______________________________________
3. Поверхность колонии_________________________________
4. Края колонии________________________________________
5. Прозрачность колоний_________________________________
6. Пигмент____________________________________________
7. Консистенция________________________________________
8. Форма бактерий______________________________________
9. Взаиморасположение бактерий_________________________
10. Латинское морфологическое название бактерий _________________________
7.Демонстрация техники пересева бактериальных культур с пластинок МПА на косячок МПА, с косячков МПА на косячок и пластинки МПА с помощью бактериальной петли и шпателя.
|
|
|
|
|
Колонии пигментных бактерий |
Латинское морфологическое название бактерий из колонии
окраска по Граму |
Смесь бактерий окраска по Граму |
8.Приготовить из смеси бактерий препарат-мазок, окрасить его по Граму, промикроскопировать и определить, какие виды микробов находятся в смеси. Произвести посев смеси на пластинку МПА в чашке Петри для выделения изолированных колоний.
Для этого чашка Петри делится маркером на две половины. Каждый студент использует для посева одну половину чашки. Перед посевом следует тщательно проверить качество бактериальной петли, которая должна быть полностью замкнута. Прокаленной и остуженной петлей захватывают каплю бактериальной взвеси и переносят ее на МПА в один из углов отведенного для посева сектора (несколько отступая от границы сектора и от края чашки). Затем скользящими движениями наносят петлей штрихи по поверхности МПА возможно ближе штрих к штриху, но не наслаивая один штрих на другой так, чтобы использовать всю поверхность чашки, за исключением полоски в 3-4 мм шириной у края чашки и у границы сектора (во избежание слияния посева с соседним). В момент посева необходимо строго соблюдать правила, предупреждающие загрязнение питательной среды микробами воздуха (посев производить под прикрытием крышки или держа чашку в вертикальном положении, не оставлять чашку открытой). Чашки с посевами помещают в термостат до следующего занятия.
Контрольные вопросы
Каким требованиям должны удовлетворять питательные среды для выращивания микробов?
Какие виды питательных сред применяются в бактериологической практике?
Что такое агар, и для какой цели он применяется?
Что такое универсальная питательная среда?
Какие сложные (специальные) среды Вы знаете?
Каково назначение элективных (избирательных) питательных сред?
Каково назначение дифференциально-диагностических сред?
По какому принципу сконструированы дифференциальные среды Эндо, Левина, Плоскирева?
Какова оптимальная температура для выращивания патогенных микробов?
Что такое термофилы, психрофилы, мезофилы?
По какому принципу устроены терморегуляторы?
Что такое стерилизация?
Что такое дезинфекция?
Чем отличается стерилизация от дезинфекции?
Какие методы используют для стерилизации?
Какие предметы лучше подвергать стерилизации сухим жаром?
Что такое дробная стерилизация?
Когда она применяется?
Что такое пастеризация и тиндализация и в каких случаях они применяются?
Как устроен автоклав?
Какой порядок работы с автоклавом?
Какие методы контроля качества стерилизации вам известны?
Какова методика бактериологического контроля эффективности стерилизации?
Что такое стерилизация фильтрованием?
Какие изменения происходят в жидких питательных средах при росте бактерий?
Какие признаки колоний имеют дифференциальное значение?
Какие формы колоний вы знаете?
Какие края бывают у колоний бактерий?
Как определить прозрачность колоний?
Какой характер имеет консистенция колоний у капсульных бактерий?
Какая поверхность может быть у колоний бактерий?
Почему пигмент у одних видов бактерий окрашивает только колонии, а у других - колонии и питательную среду?
Какие правила необходимо соблюдать при пересеве культуры?
Как следует держать бактериологическую петлю при посеве бактерий на пластинки МПА в чашках Петри и при посеве на косячки?
Как следует держать пробирки с культурой бактерий и питательной средой при посеве бактерий?
Какие методы микробиологической диагностики инфекционных болезней вы знаете?
Какова последовательность исследования смеси бактерий?
Для чего необходимо получить рост изолированных колоний?
Какие методы посева используют для получения изолированных колоний?
Как предупредить загрязнение питательных сред бактериями из воздуха?
Как избежать повреждения плотной питательной среды при посеве бактериальной петлей?
С какой целью получают чистые культуры?
Почему нельзя работать со смешанными культурами?
Приложение к ЗАНЯТИЮ 4.
|
|
Схема устойства автоклава ВК-75:
|
З А Н Я Т И Е 5
Дата ______________
Тема: Питание, дыхание, размножение, метаболизм и ферментные системы бактерий. Бактериологический метод (2 день).
План занятия:
1. Регистрация результата пересева культуры бактерий из колонии, определение её чистоты. Макро- и микроскопия выросшей культуры.
2. Исследование смеси бактерий (продолжение). Макро- и микроскопия колоний, выросших на пластинках МПА. Посев колоний на косячки МПА для получения чистых культур.
3. Изучение биохимической (ферментативной) активности бактерий. Знакомство со средами "пестрого ряда", принципами их конструирования и характером изменений в результате роста бактерий. Посев бактерий на среды "пестрого ряда" для изучения их сахаролитических и других биохимических свойств.
4. Методы культивирования анаэробов. Демонстрация способов удаления кислорода из атмосферы роста и питательных сред для анаэробов. Посев почвы на среды Китта-Тароцци и Вильсон-Блэра (в трубки Вейон-Виньяля). Способ Фортнера.
5. Дифференциально-диагностические питательные среды: Плоскирева, Эндо, Левина и др. Посев различных культур бактерий на среды Плоскирева, Эндо и МПА.
Методические указания
1.Установить, соответствует ли внешний вид выросшей культуры внешнему виду колонии, из которой был сделан посев (поверхность, пигмент, прозрачность, консистенция культуры). Приготовить из выросшей культуры препарат-мазок, окрасить его фуксином Пфейффера и, установив форму бактерий и характер их взаимоположения. отметить, правильно ли был сделан пересев культуры.
2.Описать внешний вид колоний одного из двух видов бактерий, выросших на пластинках МПА. Приготовить препараты-мазки из описанных колоний, окрасить их фуксином Пфейффера и определить морфологию бактерии для каждого вида колоний. Одну из колоний пересеять на косячок для получения чистой культуры.
Протокол исследования колонии.
1.Размер колонии_______________________________________
2.Форма колонии_______________________________________
3. Поверхность колонии_________________________________
4. Края колонии________________________________________
5.Прозрачность колоний_________________________________
6.Пигмент_____________________________________________
7.Консистенция________________________________________
8.Форма бактерий______________________________________
9. Взаиморасположение бактерий_________________________
10.Латинское морфологическое название бактерий___________________________
3.Объяснить принципы конструирования сред "пестрого ряда"; а также характерные изменения последних, наступающие в результате ферментативной деятельности бактерии. Произвести посев на среды "пестрого ряда" культур кишечной палочки и фекального шелочеобразователя.
Помимо общепринятых сред, в состав "пестрого ряда" нередко включаются среды с другими углеводами, а также среда для определения уреазы - фермента, расщепляющего мочевину. Среда представляет собой мясопептонный бульон с добавлением 1-2% мочевины и индикатора фенолового красного. При разложении мочевины образуется аммиак, вызывающий изменение рН среды и соответственно желтой окраски индикатора, на красную.
4.Разобрать типы дыхания, их сущность и разницу, группы бактерий по типу дыхания. Перечислить и раскрыть сущность механических, физических, химических и биологических методов культивирования анаэробов.
Приготовить взвесь почвы в физиологическом растворе. С помощью пастеровской пипетки засеять 1-2 капли взвеси на среду Кита-Тароцци.
Сделать посев почвенной взвеси на среду Вильсон-Блера в трубки Вейон-Виньяля. Для этого исходная взвесь почвы последовательно разводится в трех пробирках с 10 мл физиологического раствора1*. Несколько капель из последней пробирки засеять в расплавленную и остуженную до 42°-45° среду Вильсон-Блера. Среда с засеянным материалом перемешивается и насасывается в трубки Вейон-Виньяля, которые после застывания среды запаивают и помещают в термостат.
|
|
|
|
|
Латинское морфологическое название выделенной культуры
окраска по Граму |
Латинское морфологическое название бактерий из колонии
окраска по Граму |
Метод выращивания анаэробов по Фортнеру |
5.Записать состав среды Плоскирева и Эндо и характер их изменений при росте различных бактерий. Произвести посев культур кишечной палочки, фекального щелочеобразователя и стафилококка на среды Плоскирева, Эндо и МПА. Для этого чашка с каждой средой делится на три сектора и на каждый сектор с помощью петли засевается одинаковое количество культуры одного из микробов (культура рассеивается по всей поверхности сектора в виде газона). При посеве на разные среды и разных микробов следует стремиться засеять одинаковое количество бактерий и одинаковым способом для того, чтобы на следующем занятии можно было сравнить интенсивность роста.
Рецепт среды Эндо:____________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Рецепт среды Плоскирева:______________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольные вопросы
Какие методы определения чистоты выросшей культуры Вы знаете?
Как можно по внешнему виду культуры определить ее чистоту?
В чем заключается микроскопический метод проверки чистоты выделенной культуры бактерий?
Для чего добавляется индикатор в углеводные среды "пестрого ряда"?
Какие различия между бактериоскопическим и бактериологическим анализами?
Какие углеводы чаше всего включаются в среды "пестрого ряда"?
Какой цвет имеет углеводная среда с индикатором Андреде в случае ферментации углевода?
Какого цвета углеводная среда с индикатором ВР, если бактерии потребляют углевод? Почему?
Как определяется способность бактерий ферментировать углеводы с образованием газа?
Как определяется индол в среде?
Как определяется уреазная активность бактерий?
Как определить способность бактерий образовывать H2S?
Что такое анаэробиоз?
Кто открыл анаэробные бактерии?
Какие методы применяются для удаления кислорода из атмосферы роста и питательных сред для анаэробов?
В чем заключается метод выращивания анаэробов, предложенный Фортнером?
Какой состав имеет среда Вильсон-Блера?
Чём отличаются облигатные анаэробы от факультативных?
Что такое регенерация питательной среды и как она производится?
Какие изменения вызывают анаэробы на среде Тароцци?
Почему происходит почернение среды Вильсон-Блера при росте анаэробов?
Как выделяют чистые культуры анаэробных бактерий?
Какой состав имеют среды Эндо, Левина, Плоскирева?
Почему среда Плоскирева обладает бактериостатическим действие?
Для чего в среды Плоскирева, Эндо, Левина добавляется молочный сахар (лактоза)?
Почему колонии кишечной палочки на средах Эндо, Левина и Плоскирева окрашены?
Какие бактерии на средах Эндо, Левина, Плоскирева вырастают в виде бесцветных колоний?
Приложение к ЗАНЯТИЮ 5.