
- •1.Классификация органических соединений. Важнейшие функциональные группы. Примеры.
- •2. Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
- •3. Классификация органических реакций (по механизму и по конечному результату). Гомолитический и гетеролитический способы разрыва связей. Электрофильные и нуклеофильные реакции. Примеры.
- •5.Особенности многоатомных спиртов. Биологическая роль этиленгликоля и глицерина.
- •6.Химические свойства фенолов: кислотно-основные, окислительно-восстановительные.
- •7. Карбонильные соединения: альдегиды, кетоны. Строение, классификация. Примеры.
- •8.Тип гибридизации атомных орбиталей карбонильного атома углерода. Распределение электронной плотности в молекулах. Реакционные центры альдегидов и кетонов: электрофильный, основный, сн-кислотный.
- •10.Взаимодействие альдегидов а) со спиртами (образование ацеталей и полуацеталей); б) с водой; в) с аммиаком, аминами (образование иминов-оснований Шиффа); г) с циановодородной кислотой.
- •11. Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление.
- •14.Образование сложных эфиров, тиоэфиров, амидов, ангидридов, галогенгидридов карбоновых кислот. Ацетилкофермент а in vivo как переносчик ацильных групп на нуклеофильные субстраты.
- •16.Гетерофункциональные органические соединения (кетокислоты, гидроксикислоты, аминокислоты, аминофенолы, аминоспирты. Привести примеры.
- •17. Α-Аминокислоты. Строение, классификация α-Аминокислот по природе радикала: алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
- •18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
- •21. Липиды как сложная по составу группа органических веществ. Классификация липидов: химическая и функциональная. Биологическая роль липидов.
- •22. Высшие жирные кислоты (вжк): строение, конфигурация двойных связей, биологическая роль.
- •23. Омыляемые простые липиды: а) воски (спермацет, пчелиный воск); б) жиры, масла. Триаглицерины: общая структура, твердые, жидкие. Примеры. Свойства липидов: гидролиз, реакция
- •24. Омыляемые сложные липиды. Фосфолипиды, классификация. Фосфатидные кислоты. Фосфатидилэтаноламин, фосфатидилхолин, фосфатидилсерины, фосфатидилинозиты, плазмагены.
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ.
1.Классификация органических соединений. Важнейшие функциональные группы. Примеры.
По строению углеродного скелета органические соединения делятся на: а) ациклические (алифатические), в которых цепь атомов углерода может быть неразветвленной и разветвленной: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
СН3
б) карбоциклические соединения, в составе циклов которых только атомы углерода
![]()
В) гетероциклические соединения, которые кроме атомов углерода в циклическом скелете содержат один или несколько гетероатомов (лат. гетерос – иной, другой): азот, кислород, серу

важнейшие функциональные группы:
|
Функциональная группа |
Название класса |
Общая формула класса | ||||
|
формула |
название | |||||
|
– |
– |
Углеводороды |
R–H | |||
|
–F, –Cl, –Br, –I (–Hal) |
галогены |
Галогено-производные |
R–Hal | |||
|
–ОН |
гидроксильная |
Спирты Фенолы |
R–OH Ar–OH | |||
|
–О– |
окси |
Простые эфиры |
R–O–R' | |||
|
–SH |
меркапто |
Тиолы |
R–SH | |||
|
–NH2 |
амино |
Амины (первичные) |
R–NH2 | |||
|
– NO2 |
нитро |
Нитросоединения |
R–NO2 | |||
|
>C=O |
карбонильная |
Альгедиды Кетоны |
R–CH=O R–CO–R' | |||
|
–COOH |
карбоксильная |
Карбоновые кислоты |
R–COOH | |||
|
–SO3H |
сульфо |
Сульфокислоты |
R–SO3H | |||
2. Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
Согласно теории А.М. Бутлерова, свойства и реакционная способность молекулы во многом зависят от взаимного влияния атомов или групп атомов друг на друга. Результатом взаимного влияния атомов в молекулах является перераспределение электронной плотности, что вызывает изменение реакционной способности отдельных связей и молекулы в целом. Взаимное влияние передается с помощью электронных эффектов. Различают электроноакцепторные (оттягивающие электроны – эффект « – ») и электронодонорные (посылающие электроны – эффект « + ») заместители.
Индуктивный эффект (I-эффект) – передача электронного влияния заместителей по цепи σ-связей.
Заместитель, вызвавший появление в молекуле полярной связи, способствует поляризации ближайших двух-трех σ-связей и приводит к возникновению частичных зарядов (δ) на соседних атомах. Электроноакцепторные заместители (Х), уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект (– I-эффект). Электронодонорные заместители (Y), повышающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект (+I-эффект). Графически индуктивный эффект обозначают стрелкой на конце валентной черты с острием, направленным в сторону более электроотрицательного атома. Как правило, через три-четыре связи он уже не проявляется.
Мезомерный эффект (М-эффект) – передача электронного влияния заместителей по сопряженной системе. В отличие от индуктивного, мезомерный эффект не затухает, а передается по всей сопряженной системе, т.к. р- и π-электроны более подвижны, чем σ-электроны.
Заместители, отдающие пару электронов в сопряженную систему (электронодоноры), проявляют положительный (+М-эффект) мезомерный эффект. Этот эффект характерен для заместителей, содержащих гетероатомы с неподеленной электронной парой или целым отрицательным зарядом. Заместители, являющиеся участниками сопряженной системы и содержащие кратную связь с электроотрицательным атомом, оттягивающим на себя делокализованную электронную плотность системы, проявляют отрицательный мезомерный эффект (–М-эффект). Графически М-эффект обозначают изогнутыми стрелками, начало которых показывает, какие π- или р-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются:

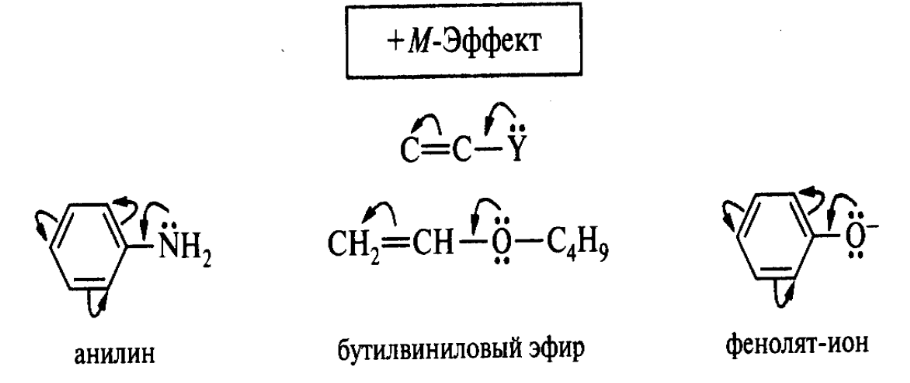
при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие обоих эффектов. Например, в анилине отрицательный I-эффект перекрывается более сильным +М-эффектом. За редким исключением (атомы галогенов) мезомерный эффект превалирует над индуктивным.
